小鼠骨髓间充质干细胞对血管内皮祖细胞分化潜能的影响
葛权虎,吴向未,2,程文哲,万龙飞,王小义,赵伯文
(1 石河子大学医学院第一附属医院,新疆石河子832008;2 石河子大学医学院)
小鼠骨髓间充质干细胞对血管内皮祖细胞分化潜能的影响
葛权虎1,吴向未1,2,程文哲1,万龙飞1,王小义1,赵伯文1
(1 石河子大学医学院第一附属医院,新疆石河子832008;2 石河子大学医学院)
目的 探讨小鼠骨髓间充质干细胞(MSCs)对血管内皮祖细胞(EPCs)向内皮细胞(ECs)分化的影响。方法 分离、培养及扩增小鼠骨髓MSCs和EPCs。取5×105个EPCs接种于含5% FBS的EBM-2培养液,置于Transwel下室(对照组);取5×105个EPCs接种于含5% FBS的EBM-2+20 ng/mL血管内皮细胞生长因子(VEGF)的培养液,置于Transwell下室(VEGF组);取5×105个MSCs接种于Transwell insert膜上、5×105个EPCs接种于Transwell下室(共培养组),培养液同对照组。培养48 h,收集各组下室EPCs,采用RT-PCR法检测内皮型一氧化氮合成酶(eNOS)和激酶插入结构域受体(KDR)mRNA表达;ELISA法检测各组细胞培养液上清VEGF含量。提取MSC条件培养基(MSCCM)及LG-DMEM基础培养基,ELISA法检测VEGF含量。取传3代EPCs,分别用LG-DMEM、MSCCM、MSCCM+IgG、MSCCM+VEGF抗体的培养液培养48 h(分别设为LG-DMEM组、MSCCM组、MSCCM+IgG组、MSCCM+VEGF抗体组),收集细胞,采用RT-PCR法检测各组eNOS、KDR mRNA表达。结果 共培养组eNOS、KDR mRNA相对表达量明显高于对照组和VEGF组(P<0.05或<0.01);共培养组、VEGF组培养液上清VEGF含量均明显高于对照组(P均<0.01)。MSCCM中VEGF含量较LG-DMEM基础培养基明显增加(P<0.01)。MSCCM组和MSCCM+IgG组eNOS、KDR mRNA相对表达量较LG-DMEM组、MSCCM+VEGF抗体组均明显增加(P均<0.01)。结论 小鼠骨髓MSCs可能通过旁分泌VEGF促进血管EPCs向ECs分化。
骨髓间充质干细胞;血管内皮祖细胞;内皮细胞;细胞分化;血管内皮细胞生长因子
近年来,以干细胞为主的细胞疗法在缺血性疾病的治疗方面取得了显著进展[1~3]。内皮祖细胞(EPCs)主要存在于骨髓,在某些情况下可被动员到外周血,分化为内皮细胞(ECs)并归巢到靶组织,参与血管生成和组织修复[4]。间充质干细胞(MSCs)主要来源于骨髓的非造血成体干细胞,具有自我更新和多向分化潜能[5,6]。目前,学者们在干细胞移植时大多选择单一移植EPCs或MSCs,尚无同时移植两种细胞的先例。而EPCs/MSCs分化受多种因素的影响[7],一种细胞是否会影响另一种细胞的分化能力甚至是生物学行为,尚不清楚。2015年12月~2016年9月,本研究通过共培养小鼠MSCs和EPCs,用MSCs条件培养基(MSCCM)诱导EPCs,并用血管内皮细胞生长因子(VEGF)抗体中和MSCCM,同时检测诱导细胞分化的内皮细胞特异性标志基因内皮型一氧化氮合成酶(eNOS)和激酶插入结构域受体(KDR)表达情况,旨在探讨MSCs对EPCs分化的影响。
1 材料与方法
1.1 材料 C57BL/6小鼠24只,SPF级,雌雄不限,4~6周龄,体质量18~22 g,购自新疆医科大学实验动物中心,动物合格证号:SCXK(新)2011- 0003。低糖DMEM、胰蛋白酶,美国Gibco公司;EBM-2、EGM-2MV,美国Lonza公司;FBS,美国Hyclone公司。VEGF,美国Peprotech公司。TRIzol Reagent,美国Invitrogen公司;cDNA合成试剂盒,美国Thermo公司;荧光定量PCR试剂盒,美国Qiagen公司;VEGF ELISA试剂盒,武汉伊莱瑞特生物科技有限公司;VEGF抗体,美国Abcam公司;小鼠IgG,北京中杉金桥生物技术有限公司;Transwell小室,美国康宁公司。PCR仪,美国Thermo公司。
1.2 MSCs、EPCs分离培养 参照本课题组前期研究方法[8,9]。①MSCs分离培养:随机选取1只C57BL/6小鼠,10%水合氯醛麻醉,颈椎脱臼法处死,乙醇消毒后置于超净台上,无菌条件下取出双侧股骨和胫骨,剔除两端骨质。用无菌注射器取MSCs培养基约5 mL(含10% FBS的LG-DMEM),立即更换1 mL无菌注射器针头,反复冲洗骨髓腔,直至骨髓腔变为白色。将冲洗出的骨髓液吹打均匀后接种于60 mm的无菌培养皿中,置于37 ℃、5% CO2培养箱中培养48 h,PBS清洗2次,去除悬液中未贴壁细胞,同时加入新鲜配制的LG-DMEM培养基3 mL,隔日换液。待细胞生长至80%~90%融合时,弃去培养基,加入含0.25% EDTA的胰蛋白酶1 mL消化,显微镜下可见细胞回缩变圆、细胞间隙出现时,用含血清的培养基终止消化,用移液枪轻轻吹打,直至培养皿上大部分细胞脱落。收集细胞,1 000 r/min离心5 min,弃去上清液,用1 mL完全LG-DMEM培养基重悬细胞。将细胞悬液均匀接种至2个新培养皿中,按1∶2进行传代培养,取传3代细胞用于后续研究。②EPCs分离培养:小鼠处理及骨髓细胞提取方法同MSCs。骨髓细胞培养48 h首次换液时,收集未贴壁细胞,1 000 r/min离心5 min,EGM-2重悬细胞,均匀接种于预先包被有人纤维连接蛋白的60 mm无菌细胞培养皿中,37 ℃、5% CO2培养箱中培养48 h,PBS浸洗2遍,加入EPCs培养基,隔天换液。其余步骤同MSCs。
1.3 细胞共培养系统建立及ECs分化能力鉴定 ①细胞分组培养:将传3代MSCs和EPCs消化计数,取5×105个EPCs接种于含5% FBS的EBM-2培养液,置于Transwell下室(对照组);取5×105个EPCs接种于含5% FBS的EBM-2+20 ng/mL VEGF的培养液,置于Transwell下室(VEGF组);取5×105个MSCs接种于Transwell insert膜上、5×105个EPCs接种于Transwell下室(共培养组),培养液同对照组。三组均置于37 ℃、5% CO2培养箱中培养48 h。②eNOS、KDR mRNA表达检测:采用RT-PCR法。收集各组下室EPCs。采用TRIzol法提取细胞总RNA,按第一链cDNA合成试剂盒说明逆转录为cDNA,然后进行PCR扩增。引物序列由上海生工生物工程股份有限公司设计、合成。引物序列:eNOS上游引物:5′-CATCACCTACGACACCCTCA-3′,下游引物:5′-CGGCTCTGTAACTTCCTTGG-3′;KDR上游引物:5′-TGCCTACCTCACCTGTTTCC-3′,下游引物:5′-CGGCTCTTTCGCTTACTGTT-3′;β-actin上游引物:5′-TTCCTTCTTGGGTATGGAAT-3′,下游引物:5′-GAGCAATGATCTTGATCTTC-3′。PCR反应体系共20 μL:2×SybrGreen qPCR Master Mix混合物10 μL,上下游引物各1 μL,cDNA 3 μL,无酶水 5 μL;PCR反应条件:95 ℃预变性3 min,95 ℃变性15 s、55 ℃退火延伸30 s共40个循环。以β-actin作为内参,2-ΔΔCt法计算目的基因mRNA相对表达量。③VEGF含量:采用ELISA法。收集各组细胞培养液,3 000 r/min 离心10 min,留取上清液。将待测样品与VEGF标准品加入包被有VEGF抗体的96孔板中,37 ℃孵育1 h;加入100 μL检测溶液A,37 ℃孵育1 h;加入100 μL检测溶液B,37 ℃孵育1 h;然后加入底物溶液90 μL,37 ℃避光显色15~20 min。当标准品孔呈现明显梯度蓝色时,加入终止液50 μL终止反应。酶标仪450 nm波长处检测各孔光密度(OD)值,绘制标准曲线,通过标准曲线方程计算待测样本VEGF含量。
1.4 MSCCM提取及其VEGF含量检测 取传3代MSCs消化计数,接种于6孔板(含10% FBS的LG-DMEM),每孔1×106个,置于37 ℃、5% CO2培养箱中培养12 h,更换为2.5 mL无血清和生长因子的LG-DMEM,继续培养24 h,提取上清,3 000 r/min离心10 min,留取上清液,即为MSCCM。以LG-DMEM基础培养基作空白对照。采用ELISA法检测MSCCM以及LG-DMEM基础培养基中VEGF含量。具体步骤参照1.3。
1.5 MSCCM对EPCs分化影响的观察 取传3代EPCs消化计数,接种于6孔板(内含10% FBS的LG-DMEM),每孔5×105个,置于37 ℃、5% CO2培养箱中培养12 h,分别更换为2 mL LG-DMEM、MSCCM、MSCCM+IgG(100 ng/mL)、MSCCM+VEGF抗体(100 ng/mL)的培养液,分别设为LG-DMEM组、MSCCM组、MSCCM+IgG组、MSCCM+VEGF抗体组,继续培养48 h。收集各组EPCs,采用RT-PCR法检测eNOS、KDR mRNA表达。具体步骤参照1.3。
2 结果
2.1 各组细胞eNOS、KDR mRNA表达及VEGF含量比较 见表1。
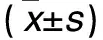
表1 各组细胞eNOS、KDR mRNA相对表达量及VEGF含量比较
注:与对照组比较,*P<0.05,#P<0.01。
2.2 MSCCM及LG-DMEM中VEGF含量比较 MSCCM中VEGF含量为(166.03±11.09)pg/mL,LG-DMEM中为(11.77±3.04)pg/mL,二者比较P<0.01。
2.3 MSCCM对EPCs向ECs分化的影响 见表2。
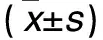
表2 各组MSCCM刺激EPCs后细胞eNOS、KDRmRNA相对表达量比较
注:与LG-DMEM组比较,*P<0.01;与MSCCM组比较,#P<0.05;与MSCCM+IgG组比较,△P<0.05。
3 讨论
有研究报道, EPCs能够直接参与血管新生,或间接分化为ECs参与血管新生和组织修复[10]。过去几十年,干细胞移植在治疗缺血性疾病方面已取得了显著进展[11,12]。但干细胞的生物学行为易受多种因素影响,其生长环境改变后生物学行为是否会发生变化,目前尚不清楚。
本课题组前期研究发现,MSCs和EPCs在体内外均具有高度黏附性[13,14]。恶性肿瘤患者放疗后出现的骨损伤,属难治性创伤,治疗较为棘手。Cao等[15]对小鼠股骨远端局部放射,彻底破坏放射部位骨髓组织后分别局部单纯注射EPCs或MSCs和二者联合注射,以重建骨髓微环境;结果发现,单纯注射EPCs或MSCs 3个月,骨髓内无血管新生,而二者联合注射血管新生良好。由此推测,骨髓血管重建需要MSCs和EPCs共同作用实现,二者可能存在协同作用。但其相互作用机制鲜见报道。
VEGF在细胞增殖和分化中扮演重要角色。李鹏等[16]研究发现,在体外VEGF可诱导人脐带MSCs向内皮样细胞分化。杨书强等[17]研究表明,人骨髓MSCs在VEGF的诱导下可定向分化为ECs,并保持干细胞的增殖能力。谢安明等[18]研究发现,EPCs与VEGF均参与增生性糖尿病视网膜病变新生血管的形成,二者可能具有协同作用。VEGF能促进EPCs血管新生和内皮化,这有可能为慢性缺血性心脏病和肢体缺血病提供一种新的治疗方法[19]。有研究还发现,MSCs和ECs共培养可生成毛细血管样结构,而介导MSCs和ECs相互作用的关键分子正是VEGF[20]。由此可见,VEGF在细胞分化以及介导细胞间相互作用的过程中具有重要作用。本研究结果显示,MSCs与EPCs共培养后,内皮细胞特异性标志基因eNOS、KDR mRNA相对表达量显著增加,说明MSCs可促进EPCs向ECs分化;同时,共培养体系中VEGF含量较对照组明显升高,且MSCCM中VEGF含量亦高于LG-DMEM基础培养中,提示MSCs分泌的VEGF可能对共培养体系EPCs的分化起作用。本研究用MSCCM刺激EPCs发现,MSCCM组eNOS、KDR mRNA相对表达量显著增加;添加VEGF抗体中和后再次验证发现,MSCCM+VEGF抗体组eNOS、KDR mRNA相对表达量较MSCCM组明显降低。证实MSCs分泌的VEGF可影响EPCs的分化。
VEGF可能只是MSCs分泌的众多参与EPCs分化的细胞因子之一。尽管本研究共培养组和VEGF组中VEGF含量比较无统计学差异,但共培养组内皮细胞特异性标志基因eNOS、KDR mRNA表达却明显高于VEGF组;而且中和MSCCM中的VEGF后,也只能部分削弱MSCCM对EPCs分化的影响。这说明可能存在其他旁分泌的细胞因子,而这些细胞因子对EPCs的分化可能与VEGF具有协同作用。Guo等[21]研究发现,CD34+来源的EPCs能分化为内皮样细胞,而这种分化过程依赖于碱性成纤维细胞生长因子(bFGF)和血小板衍生生长因子。Gnecchi等[22]研究发现,MSCs可分泌包括VEGF和bFGF在内的多种细胞因子,而这些细胞因子对血管损伤修复和血管再生具有促进作用。这或许可解释为何VEGF抗体只能部分削弱MSCCM对EPCs分化的影响。
综上所述,MSCs可能通过旁分泌VEGF促进EPCs向ECs分化,但其具体机制尚未完全明确。本研究仅是初步的体外实验,体内实验尚未开展,今后我们将进一步研究MSCs调节EPCs分化的机制,为将来其临床用于组织修复与血管重建提供依据。
[1] Bank JR, Rabelink TJ, de Fijter JW, et al. Safety and efficacy endpoints for mesenchymal stromal cell therapy in renal transplant recipients[J]. J Immunol Res, 2015,2015:391797.
[2] Davatchi F, Sadeghi Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis: 5 years follow-up of three patients[J]. Int J Rheum Dis, 2016,19(3):219-225.
[3] 虞桂平,王忠.自体骨髓干细胞移植治疗下肢缺血性疾病[J].中国组织工程研究,2012,16(14):2625-2628.
[4] Asahara T, Kawamoto A, Masuda H. Concise review: circulating endothelial progenitor cells for vascular medicine[J]. Stem Cells, 2011,29(11):1650-1655.
[5] Martin SK, Fitter S, Dutta AK, et al. Brief report: the differential roles of mTORC1 and mTORC2 in mesenchymal stem cell differentiation[J]. Stem Cells, 2015,33(4):1359-1365.
[6] Nazari M, Ni NC, Lüdke A, et al. Mast cells promote proliferation and migration and inhibit differentiation of mesenchymal stem cells through PDGF[J]. J Mol Cell Cardiol, 2016(94):32-42.
[7] Miller A, Ralser M, Kloet SL, et al. Sall4 controls differentiation of pluripotent cells independently of the Nucleosome Remodelling and Deacetylation (NuRD) complex[J]. Development, 2016,143(17):3074-3084.
[8] 张猛,张宏伟,冯文磊,等.血管内皮前体细胞通过旁分泌功能促进间充质细胞成骨分化[J].中华医学杂志,2015,95(16):1253-1257.
[9] 冯文磊,张猛,徐芳洁,等.内皮祖细胞条件培养基对间充质干细胞增殖和成骨分化的影响及其机制[J].吉林大学学报(医学版),2015,41(2):218-224.
[10] Caiado F, Carvalho T, Silva F, et al. The role of fibrin E on the modulation of endothelial progenitors adhesion, differentiation and angiogenic growth factor production and the promotion of wound healing[J]. Biomaterials, 2011,32(29):7096-7105.
[11] Li G, Yu F, Lei T, et al. Bone marrow mesenchymal stem cell therapy in ischemic stroke: mechanisms of action and treatment optimization strategies[J]. Neural Regen Res, 2016,11(6):1015-1024.
[12] 马红芳,王富军.脐血干细胞移植及血管成形治疗糖尿病下肢缺血性疾病[J].中国组织工程研究,2015,19(23):3755-3760.
[13] Zhang H, Xian L, Lin Z, et al. Endothelial progenitor cells as a possible component of stem cell niche to promote self-renewal of mesenchymal stem cells[J]. Mol Cell Biochem, 2014,397(1-2):235-243.
[14] 郭军,夏杰,张宏伟,等.细胞间黏附分子-1在MSC和EPC间黏附作用的研究[J].中国实验血液学杂志,2016,24(1):211-216.
[15] Cao X, Wu X, Frassica D, et al. Irradiation induces bone injury by damaging bone marrow microenvironment for stem cells[J]. Proc Natl Acad Sci U S A, 2011,108(4):1609-1614.
[16] 李鹏,周长勇,尹磊,等.低氧对人脐带间充质干细胞活性和内皮分化能力的影响及VEGF的干预作用[J].中南大学学报医学版,2013,38(4):329-340.
[17] 杨书强,张振香,法宪恩,等.VEGF诱导人骨髓间充质干细胞分化为内皮细胞的可行性[J].郑州大学学报(医学版),2008,43(3):503-506.
[18] 谢安明,王雅君,崔丽珺.血管内皮祖细胞与VEGF对增生性糖尿病视网膜病变新生血管形成的影响[J].西安交通大学学报医学版,2013,34(2):233-236.
[19] Kim J, Kim M, Jeong Y, et al. BMP9 Induces cord blood-derived endothelial progenitor cell differentiation and ischemic neovascularization via ALK1[J]. Arterioscler Thromb Vasc Biol, 2015,35(9):2020-2031.
[20] Li H, Daculsi R, Grellier M, et al. The role of vascular actors in two dimensional dialogue of human bone marrow stromal cell and endothelial cell for inducing self-assembled network[J]. PLoS One, 2011,6(2):e16767.
[21] Guo S, Cheng Y, Ma Y, et al. Endothelial progenitor cells derived from CD34+cells form cooperative vascular networks[J]. Cell Physiol Biochem, 2010,26(26):679-688.
[22] Gnecchi M, Zhang Z, Ni A, et al. Paracrine mechanisms in adult stem cell signaling and therapy[J]. Circ Res, 2008,103(11):1204-1219.
Effect of mesenchymal stem cells on differentiation potential of blood endothelial progenitor cells
GEQuanhu1,WUXiangwei,CHENGWenzhe,WANLongfei,WANGXiaoyi,ZHAOBowen
(1TheFirstAffiliatedHospitalofShiheziUniversitySchoolofMedicine,Shihezi832008,China)
Objective To investigate the effect of mesenchymal stem cells (MSCs) on the differentiation of endothelial progenitor cells (EPCs) into endothelial cells (ECs). Methods MSCs and EPCs were isolated, cultured, and amplified from murine bone marrow in vitro. MSCs and EPCs were cultured in Transwell co-culture system. The experiment was totally divided into three groups, EPCs cultured group (control group), co-culture group, and vascular endothelial growth factor group (VEGF group). After being cultured for 48 h, EPCs were collected and the expression of the specific markers of eNOS and KDR was measured by RT-PCR; the expression of VEGF in the culture medium of each group was detected by ELISA. MSC conditioned medium (MSCCM) was collected. EPCs which were at passage 3 were cultured in the medium of LG-DMEM, MSCCM, MSCCM+IgG, MSCCM+VEGF neutralizing antibody (Anti-VEGF), respectively, which were taken as the following four groups, LG-DMEM group, MSCCM group, MSCCM+IgG group, and MSCCM+Anti-VEGF group. After being cultured for 48 h, EPCs were collected and the expression of eNOS and KDR was measured by RT-PCR. Results The mRNA expression of the specific markers was significantly higher in the co-culture group and VEGF group than that in the control group (P<0.05 or <0.01). The expression of VEGF in the co-culture group and VEGF group was significantly increased as compared with that of the control group (P<0.01). The mRNA expression of the specific markers in the MSCCM group and MSCCM+IgG group was significantly higher than that of the LG-DMEM group and MSCCM+Anti-VEGF group (P<0.01). Conclusion MSCs can promote the differentiation of EPCs into ECs through paracrine factors such as VEGF.
mesenchymal stem cells; endothelial progenitor cells; endothelial cells; cell differentiation; vascular endothelial growth factor
国家自然科学基金资助项目(31271458)。
葛权虎(1990-),男,硕士在读,研究方向为肝胆外科疾病的基础与临床。E-mail: 282651595@qq.com
吴向未(1973-),男、主任医师、博士生导师,研究方向肝胆外科疾病的基础与临床。E-mail: wxwshz@126.com
10.3969/j.issn.1002- 266X.2017.28.004
R329.2
A
1002- 266X(2017)28- 0012- 04
2016-11- 04)

