IL-36α对银屑病小鼠皮肤病变的影响及其作用机制
朱超英,温炬,李婷,赵琪楠,秦思
(1 南方医科大学附属广东省第二人民医院,广州510317;2南方医科大学第三临床医学院)
IL-36α对银屑病小鼠皮肤病变的影响及其作用机制
朱超英1,2,温炬1,李婷1,赵琪楠1,秦思1
(1 南方医科大学附属广东省第二人民医院,广州510317;2南方医科大学第三临床医学院)
目的 探讨白细胞介素36α(IL-36α)对银屑病小鼠皮肤病变的影响及其作用机制。方法 将30只雌性小鼠随机分为对照组、模型组及观察组,每组10只。模型组及观察组于背部裸露皮肤处涂抹5%咪喹莫特乳膏62.5 mg,对照组涂抹等量凡士林乳膏,1次/d,连续8天。观察组隔日皮下注射IL-36α 5 μg,对照组、模型组注射等量PBS,共注射4次。评估各组建模第1~8天银屑病皮损面积和严重程度评分(PASI评分)。建模第8天处死,测量表皮垂直厚度,分别采用实时荧光定量PCR法、Western blotting法检测皮肤组织血管内皮生长因子(VEGF)和IL-36α mRNA和蛋白相对表达量。结果 随建模时间延长,模型组和观察组PASI评分逐渐升高(P均<0.05)。观察组、模型组建模第5天开始PASI评分明显升高,以观察组升高更明显(P均<0.05)。观察组表皮垂直厚度为(98.519±3.442)μm,模型组为(68.383±2.499)μm,对照组为(9.804±1.682)μm,组间两两比较P均<0.05。观察组、模型组和对照组皮肤组织VEGF、IL-36α mRNA和蛋白相对表达量依次降低,组间两两比较P均<0.05。结论 IL-36α可加重银屑病小鼠皮肤病变,其机制可能与促进VEGF表达有关。
银屑病;白细胞介素36α;血管内皮生长因子
银屑病属于慢性炎症性增生性皮肤病之一,主要组织病理学改变为新生血管形成、角质形成、细胞过度增生及炎症细胞浸润等[1]。白细胞介素36(IL-36)是一种新型促炎性因子,属于IL-1家族,由3个生物学功能相似的分子(IL-36α、IL-36β及IL-36γ)组成。IL-36受体(IL-36R)主要表达于皮肤组织,IL-36与其受体结合后激活丝裂原活化蛋白激酶(MAPK)和NF-κB,在银屑病、系统性红斑狼疮、干燥综合征等疾病的发生中具有重要作用[2~5]。目前,关于IL-36α在银屑病发病中的作用及其机制尚不完全明了。为此,我们于2016年2~8月进行如下研究。
1 材料与方法
1.1 材料 实验动物:雌性BALB/c小鼠30只,SPF级,6~8周龄,体质量18~20 g,购自南方医科大学。饲养环境:温度20~24 ℃,光照12 h明暗交替,自由摄食饮水。5%咪喹莫特乳膏(美国3M公司),凡士林乳膏(河北兰炼飞天石化有限公司),IL-36α(美国R&D公司),Anti-VEGFA抗体(美国Abcam公司),ECL显色液及DAB显色液(杭州弗德生物科技有限公司),逆转录试剂盒、荧光定量PCR试剂盒(美国DBI公司);多功能酶标仪(上海现科分光仪器有限公司),实时荧光定量PCR仪(美国ABI公司)。
1.2 银屑病模型建立及干预 将30只小鼠随机分为对照组、模型组及观察组,每组10只,单笼饲养。各组背部剃毛,裸露皮肤,面积约2 cm×3 cm。模型组及观察组于裸露皮肤处涂抹5%咪喹莫特乳膏62.5 mg,对照组涂抹等量凡士林乳膏,1次/d,连续8天。观察组隔日皮下注射IL-36α 5 μg,对照组、模型组注射等量PBS,共注射4次。
1.3 相关指标观察
1.3.1 银屑病皮损面积和严重程度评分(PASI评分) 观察各组建模第1~8天皮肤变化并行PASI评分。PASI评分标准包括红斑、鳞屑及浸润增厚3个项目,每个项目共4分,无为0分、轻度为1分、中度为2分、重度为3分、极重度为4分,总分12分。PASI评分越高说明银屑病皮损越严重[6]。
1.3.2 皮肤组织病理学变化及表皮厚度 各组于建模第8天采用颈椎脱臼法处死,取背部皮损面积约1 cm×1 cm,4%多聚甲醛固定,脱水,石蜡包埋,3 μm厚切片。常规HE染色,100倍显微镜下观察皮损增厚程度、炎症细胞浸润情况等。同时,测量表皮垂直厚度。
1.3.3 皮肤组织血管内皮生长因子(VEGF)和IL-36α mRNA表达 采用实时荧光定量PCR法。取冻存皮肤组织,TRIzol法提取组织总RNA。根据逆转录试剂盒说明进行逆转录。采用实时荧光定量PCR仪进行扩增。引物序列:VEGF上游引物:5′-GTCTGTGCTCTGGGATTTG-3′,下游引物:5′-ATTTCCACAATCCGAAGTGA-3′;IL-36α上游引物:5′-ACCTCTACATTTGAGTCTGC-3′,下游引物:5′-GATGAAGATTTCCCCCAGTT-3′;GAPDH上游引物:5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物:5′-TGTAGACCATGTAGTTGAGGTCA-3′。扩增条件:95 ℃ 10 min,95 ℃ 10 s、60 ℃ 30 s共45个循环。以2-ΔΔCt法计算VEGF和IL-36α mRNA相对表达量。
1.3.4 皮肤组织IL-36α蛋白表达 采用Western blotting法。取冻存皮肤组织,RIPA裂解,提取皮肤组织蛋白,BCA法进行蛋白定量。取适量蛋白样品进行SDS-PAGE,然后将蛋白电泳产物转印至NC膜,用含3%脱脂牛奶的TBST室温封闭1 h。加入一抗(1∶1 000)4 ℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔二抗(1∶20 000)室温孵育1 h,ECL显色。采用Image J图像分析系统分析电泳条带的光密度(OD)值。以β-actin为内参,以目的蛋白与内参蛋白OD值的比值作为目的蛋白相对表达量。
1.3.5 皮肤组织VEGF蛋白表达 ①Western blotting法。参照1.3.4的方法检测VEGF蛋白相对表达量。②免疫组化法。皮肤组织石蜡切片经脱蜡、水化,抗原修复,加入一抗(1∶100)4 ℃孵育过夜,加入二抗(1∶1 000)4 ℃孵育50 min。DAB显色,苏木精复染,同步设立阴性对照。以细胞质、细胞核内出现淡棕色、淡褐色、棕色、棕褐色以及褐色颗粒为阳性染色。每张切片随机选取5个高倍镜视野,根据阳性细胞百分比及染色强度综合评分。阳性细胞百分比:0~5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。染色强度:无着色为0分,淡褐色为1分,棕色为2分,棕褐色为3分。两项评分相加≥1分为阳性。
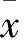
2 结果
2.1 各组皮肤变化及PASI评分比较 对照组背部皮肤正常,无明显变化。随着建模时间延长,模型组和观察组逐渐出现红斑、增厚、鳞屑;模型组建模第7、8天出现典型银屑病样改变,第8天部分出现脱屑;观察组建模第4~8天开始出现典型银屑病样改变,其红斑、鳞屑、增厚表现均较模型组严重。各组建模第1、2天PASI评分均为0分;随建模时间延长,观察组及模型组PASI评分逐渐升高(P均<0.05)。与对照组比较,观察组、模型组建模第5天开始PASI评分均升高,但观察组升高更明显(P均<0.05)。见表1。
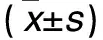
表1 各组建模第3~8天PASI评分比较
注:与对照组同时间比较,*P<0.05;与模型组同时间比较,#P<0.05。
2.2 各组皮肤组织病理学变化及表皮厚度比较 对照组皮肤未见明显异常。模型组呈银屑病样改变,表皮明显增厚,可见鳞屑、角化不全及Muro微脓肿,棘层增厚明显,表皮突延长。观察组各层变化及炎症细胞浸润均较模型组明显。见插页Ⅰ图3。观察组表皮垂直厚度为(98.519±3.442)μm,模型组为(68.383±2.499)μm,对照组为(9.804±1.682)μm,组间两两比较P均<0.05。
2.3 各组皮肤组织VEGF及IL-36α表达比较 观察组、模型组和对照组皮肤组织VEGF、IL-36α mRNA和蛋白相对表达量均依次降低,组间两两比较P均<0.05。见表2。
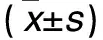
表2 各组皮肤组织VEGF、IL-36α mRNA和蛋白相对表达量比较
注:与对照组比较,*P<0.05,与模型组比较,#P<0.05。
2.4 各组皮肤组织VEGF蛋白表达比较 见插页Ⅰ图4。免疫组化染色结果显示,对照组VEGF仅少量表达,在真皮乳头微血管轻度染色,呈淡褐色;模型组着色细胞层数及数量显著增多,VEGF显著染色,主要表达于表皮及血管内皮细胞,呈褐色;观察组着色细胞数量多于模型组,VEGF染色呈深褐色,主要表达于表皮层及血管内皮细胞。观察组、模型组和对照组皮肤组织VEGF 阳性表达率分别为100%、100%、10%。观察组、模型组明显高于对照组(P均<0.05)。
3 讨论
多项研究表明,IL-36与银屑病的发生密切相关[7~10]。银屑病发病过程中表皮角质形成细胞加强了VEGF的自我表达,并通过一系列信号传导,促进血管通透性增加及血管内皮细胞增殖、迁移,最终形成新生血管。朱凡等[11]研究表明,由角质形成细胞分泌的VEGF对银屑病皮损部血管异常起着决定性作用。Towne等[2]研究认为,IL-36可促进角质形成细胞分泌VEGF。既往研究表明,IL-17可促进角质形成细胞分泌VEGF,而IL-36又可促进角质形成细胞分泌IL-17[12],这间接提示IL-36可促进VEGF分泌。有研究发现,IL-1家族中的IL-1及IL-33可促进VEGF分泌[13],而IL-36也属于IL-1家族,进一步提示IL-36可促进VEGF分泌。
咪喹莫特是一种免疫激活剂,通过激活Toll样受体刺激小鼠产生银屑病样皮损,并已广泛用于银屑病动物模型的建立[14]。本研究结果显示,模型组与观察组在背部涂抹咪喹莫特后逐渐出现红斑、鳞屑、增厚现象,伴有角质层、棘细胞层的增厚以及颗粒层消失,而对照组未见明显异常,表明银屑病小鼠建模成功。既往研究发现,皮下注射IL-36α的小鼠背部皮肤可出现明显的炎症细胞浸润[9],而气管内灌注IL-36α的小鼠肺部可出现大量的趋化因子、肿瘤坏死因子等炎症因子浸润[15]。本研究结果显示,观察组较模型组皮肤炎症反应更为严重,且观察组、模型组和对照组IL-36α mRNA和蛋白相对表达量依次降低,表明IL-36α可加重银屑病小鼠的皮肤炎症反应。本研究结果显示,与对照组比较,模型组与观察组VEGF mRNA和蛋白相对表达量均明显升高,而观察组升高更明显,表明IL-36α可促进VEGF表达。另外,免疫组化结果显示,对照组表皮层几乎不表达VEGF,仅在真皮乳头层微血管处低表达,呈淡褐色;而模型组与观察组着色细胞层数及数量较对照组增多,VEGF表达于表皮层及真皮层,且观察组着色细胞数量多于模型组,呈深棕褐色;且观察组与模型组VEGF阳性表达率明显高于对照组,进一步证实IL-36α可促进VEGF的表达。
综上所述,IL-36α可加重银屑病小鼠皮肤病变,其机制可能与促进VEGF的表达有关。
[1] 赵京霞,底婷婷,王燕,等.IL-23/ IL-17炎症轴在咪喹莫特诱导的小鼠.银屑病样皮肤损害中的作用[J].中国病理生理杂志,2013,29(6):1086-1094.
[2] Towne JE, Sims JE. IL-36 in psoriasis[J].Curr Opin Pharmacol, 2012,12(4):486-490.
[3] Hovdenak N, Haram K. Influence of mineral and vitamin supplements on pregnancy outcome[J]. Eur J Obstet Gynecol Reprod Biol, 2012,164(2):127-132.
[4] Ciccia F, Accardo-Palumbo A, Alessandro R. IL-36 α axis is modulated in patients with primary Sjogren′s Syndrome[J]. Clin Exp Immunol, 2015,181(2):230-238.
[5] Takahashi K, Nishida A, Shioya M, et al. Interleukin (IL)-1β is a strong inducer of IL-36γ expression in human colonic myofibroblasts[J]. PLoS One, 2015,10(11):e138423.
[6] Wolf J, Ferris LK. And-IL-36R antibodies, potentially useful for the treatment of psoriasis: a patent evaluation of W02013074569[J]. Expert Opin Ther Pat, 2014,24(4):477-479.
[7] Blumberg H, Dinh H, Trueblood ES, et al. Opposing activities of two novel members of the IL-1 ligand family regulate skin inflammation[J]. J Exp Med, 2007,204 (11):2603-2614.
[8] Kanazawa N, Nakamura T, Mikita N, et al. Novel IL36RN mutation in a Japanese case of early onset generalized pustular psoriasis[J]. J Dermatol, 2013,40(9):749-751.
[9] Foster AM, Baliwag J, Chen CS, et al. IL-36 promotes myeloid cell infiltration, activation, and inflammatory activity in skin[J]. J Immunol, 2014,192(12):6053-6061.
[10] Tortola L, Rosenwald E, Abel B, et al. Psoriasiform dermatitis is driven by IL-36-mediated DC-keratinocyte crosstalk[J]. J Clin Invest, 2012,122 (11):3965-3976.
[11] 朱凡,郑敏,鲍彰,等.银屑病患者皮损中血管内皮生长因子受体的表达与血管增生的关系[J].中华皮肤科杂志,2003,36(7):365-367.
[12] Friedrich M, Tillack C, Wollenberg A, et al. IL-36g sustains a proinflammatory self-amplifying loop with IL-17C in anti-TNF-induced psoriasiform skin lesions of patients with Crohn ′s Disease[J]. Inflamm Bowel Dis, 2014,20(11):1891-1901.
[13] Theoharides TC, Zhang B, Kempuraj D, et al. IL-33 augments substance P-induced VEGF secretion from human mast cells and is increased in psoriatic skin[J]. Proc Natl Acad Sci U S A, 2010,107(9):4448-4453.
[14] Gilliet M, Conrad C, Geiges M, et al. Psoriasis triggered by toll like receptor 7 agonist imiquimod in the presence of dermal plasmacytoid dendritic cell precursors[J]. Arch Dermatol, 2004,140(12):1490-1495.
[15] Ramadas RA, Ewart SL, Iwakura Y, et al. IL-36a exerts pro-inflammatory effects in the lungs of mice[J]. PLoS One, 2012,7(9):e45784.
广东省中医药局基金资助项目(20141008)。
温炬(E-mail: gdwenju@163.com)
10.3969/j.issn.1002- 266X.2017.28.010
R758.63
A
1002- 266X(2017)28- 0037- 03
2016- 09- 03)

