妊娠期糖尿病患者外周血Sfrp5、FoxM1水平与胰岛素抵抗的关系
孟莉
(苏州大学附属第一医院,江苏苏州215006)
妊娠期糖尿病患者外周血Sfrp5、FoxM1水平与胰岛素抵抗的关系
孟莉
(苏州大学附属第一医院,江苏苏州215006)
目的 探讨妊娠期糖尿病(GDM)患者血清分泌型卷曲相关蛋白5(Sfrp5)、血浆Fox基因家族成员FoxM1水平与胰岛素抵抗的关系。方法 选择GDM患者56例(GDM组)及正常产妇56例(对照组),采集空腹静脉血检测空腹胰岛素(FINS)、空腹血糖(FPG),并计算胰岛素抵抗指数(HOMA-IR),分别采用ELFSA法和实时荧光PCR法检测血清Sfrp5水平及血浆FoxM1 mRNA水平,并分析其与HOMA-IR的相关性。结果 GDM组血清FPG、FINS、HOMA-IR和血浆FoxM1 mRNA水平均高于对照组(P均<0.05),GDM组血清Sfrp5水平低于对照组(P<0.05)。GDM患者HOMA-IR与血清Sfrp5水平呈负相关(r=-0.571,P<0.01),与血浆FoxM1 mRNA水平呈正相关(r=0.613,P<0.01)。结论 GDM患者血清Sfrp5水平降低且与胰岛素抵抗呈负相关,血浆FoxM1水平增加且与胰岛素抵抗呈正相关。
妊娠期糖尿病;胰岛素抵抗;FoxM1基因;分泌型卷曲相关蛋白5
妊娠期糖尿病(GDM)指孕妇在孕前无糖尿病或仅有糖耐量减退,在妊娠期发生的糖尿病[1],是危害母体和胎儿健康的常见妊娠合并症[2]。流行病学调查显示,我国GDM发生率为1%~5%[3]。除了对孕妇本身的远期危害外,GDM也可对围产期胎儿造成危害,导致流产、胎儿宫内生长受限、巨大儿、新生儿低血糖、新生儿呼吸窘迫综合征等[4]。目前尚不清楚GDM的发病机制,研究表明胰岛素抵抗在GDM所致的不良结局中发挥重要作用[5]。血清分泌型卷曲相关蛋白5(Sfrp5)是脂肪因子的一种,具有增加胰岛素敏感性、调节血糖的作用[6]。Fox基因家族成员FoxM1是调控细胞周期和有丝分裂的重要基因,近期研究发现其可能参与了胰岛素抵抗[7]。2014年1月~2016年1月,我们检测了56例GDM患者血清Sfrp5及血浆FoxM1 mRNA的表达情况,并分析其与胰岛素抵抗的关系。
1 资料与方法
1.1 临床资料 选择同期在我院产检的GDM患者56例为GDM组,年龄22~38(30.55±4.13)岁,孕周(38.8±1.4)周。GDM诊断标准参照人民卫生出版社出版的《妇产科学》(第8版)[2]。纳入标准:①初产妇;②单胎活产;③无不良生活嗜好;④孕期未使用过皮质激素;⑤非人工辅助生育;⑥孕期在我院进行连续产检。排除标准:①孕前有糖尿病及糖尿病家族史;②胎儿畸形;③合并高血压、肝肾功能不全、多囊卵巢综合征、内分泌疾病等。选择同期在我院体检的糖耐量正常产妇56例为对照组,年龄与GDM组配对,排除孕前BMI≥24 kg/m2和糖尿病家族史,且空腹血糖<7 mmol/L、任意血糖<11.0 mmol/L。两组产妇年龄、孕周具有可比性。本研究经过医院伦理委员会审查,所有研究对象自愿签署知情同意书。
1.2 血糖检测及胰岛素抵抗水平测算 抽取两组空腹肘静脉血2 mL,应用Cobase601全自动电化学发光分析仪检测空腹胰岛素(FINS)、FPG。计算稳态模型胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5。
1.3 血清Sfrp5水平检测 两组患者于清晨空腹时采集肘静脉血4 mL,离心取血清。采用ELISA法检测血清Sfrp5水平,试剂盒购自美国R&D公司,操作严格按照说明书进行。
1.4 血浆FoxM1 mRNA检测 采用德国QIAGEN公司的全血RNA试剂盒提取血浆RNA,采用美国Bio-Rad公司的RT-PCR试剂盒逆转录合成cDNA,采用Bio-Rad公司的SYBR定量PCR试剂盒进行实时荧光定量PCR检测FoxM1 mRNA。引物和内参基因均通过GenBank检索得到,由TAKARA公司合成。mRNA表达水平采用2-ΔΔCt法进行计算。
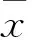
2 结果
2.1 两组血清FPG、FINS、HOMA-IR、Sfrp5及血浆FoxM1 mRNA水平比较 GDM组血清FPG、FINS、HOMA-IR和FoxM1 mRNA表达水平均高于对照组(P均<0.05),GDM组血清Sfrp5水平低于对照组(P<0.05)。见表1。
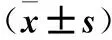
表1 两组血清FPG、FINS、HOMA-IR、Sfrp5及血浆FoxM1 mRNA水平比较
2.2 GDM患者血清Sfrp5、血浆FoxM1 mRNA水平与胰岛素抵抗的相关性 GDM患者HOMA-IR与血清Sfrp5水平呈负相关(r=-0.571,P<0.01),与血浆FoxM1 mRNA水平呈正相关(r=0.613,P<0.01)。
3 讨论
GDM的发病原因与2型糖尿病(T2DM)相同,与胰岛素抵抗和胰岛β细胞功能降低有关[8]。目前许多学者认为,胰岛素抵抗可能先于胰岛β细胞功能降低[9]。妊娠过程中大量孕酮、雌激素、胰岛素酶等抵抗胰岛素活性的激素增加,这些激素结合到靶组织上,可降低胰岛素的敏感性,导致孕妇出现一过性的、生理性的胰岛素抵抗状态,机体为了补偿胰岛素水平的“相对不足”而上调胰岛素释放水平,当代偿分泌的胰岛素仍不足以调节血糖时,则出现糖耐量异常[9],继而发生GDM。GDM患者的糖代谢在产后能回复正常,但会增加将来患T2DM的风险,约60%的GDM产妇最终发展为T2DM[10]。本研究发现,GDM组血清FPG、FINS、HOMA-IR均高于对照组,提示GDM患者的血糖水平及HOMA-IR增高,可能与胰岛素抵抗有关。
妊娠期孕妇摄入能量增加,为胎儿生长提供能量和营养,同时也为母体储存能量,若没有良好的饮食指导,很容易出现脂肪快速积累。目前研究证实,脂肪组织除了储存能量外,还可能是体内重要的且十分活跃的内分泌器官,其分泌的多种脂肪因子直接或间接参与了体内多种代谢[11]。Sfrp5是最近研究比较多的一种脂肪因子,动物研究发现其在肥胖小鼠血清中降低,给正常小鼠注入Sfrp5后,可增加胰岛素敏感性,促进葡萄糖摄入和脂肪合成[12]。研究发现,糖尿病患者脂肪组织中的Sfrp5基因表达水平显著降低[13]。本研究发现,GDM组血清Sfrp5水平低于对照组,且GDM患者HOMA-IR与血清Sfrp5水平呈负相关,表明GDM患者体内Sfrp5分泌受到影响,可能是导致胰岛素抵抗的一个重要因素,Sfrp5表达下调是胰岛素抵抗的特征表现。
胰岛素抵抗的发生除了胰岛素敏感性降低,可能还与胰岛细胞的增殖改变有关。FoxM1是Fox家族的成员,是与细胞增殖密切相关的转录因子,在具有分裂活性的细胞内高表达,对调控细胞周期和有丝分裂起重要作用[8]。在多种肿瘤细胞中发现FoxM1异常高表达,且与预后不良具有相关性。最新的研究显示,FoxM1可能参与了胰岛素抵抗的发展过程,当GDM患者体内出现胰岛素敏感性降低时,FoxM1表达上调,促进胰岛β细胞增生,分泌更多胰岛素以代偿胰岛素敏感性降低的影响[14]。此外,FoxM1并不是作为单一因素影响胰岛细胞,当FoxM1表达上调时,会激活一系列与胰岛β细胞增殖、分泌及血糖调节有关的基因。已有研究发现,在肥胖患者胰岛组织中FoxM1基因及其靶基因表达水平均显著增高[15],且FoxM1基因的表达水平与患者BMI具有相关性。本研究发现,GDM患者血浆FoxM1 mRNA水平增高,并且与GDM患者HOMA-IR呈正相关,提示FoxM1基因表达水平增加参与了GDM的发病过程,并且与GDM的发展密切相关。
综上所述,GDM患者血清Sfrp5水平降低且与胰岛素抵抗呈负相关,血浆FoxM1水平增加且与胰岛素抵抗呈正相关;血浆Sfrp5和FoxM1 mRNA可用于早期发现和诊断GDM,二者之间的关系和作用机制还有待进一步研究。
[1] 王璇,陈廷美,于德纯,等.IADPSG标准下妊娠期糖尿病发病率及危险因素调查[J].实用医学杂志,2014,30(8):1318-1320.
[2] 罗静,常青,王廷洲,等.新妊娠期糖尿病诊断标准与围生期母儿结局分析[J].实用妇产科杂志,2012,28(9):755-758.
[3] 蔡慧华,何援利,王雪峰,等.糖化血红蛋白联合空腹血糖检测在妊娠期糖尿病筛查中的应用价值[J].实用妇产科杂志,2014,30(3):205-208.
[4] 赵旭,李嵘娟.时间-空间相关成像技术用于评估妊娠期糖尿病孕妇胎儿心脏收缩功能的临床研究[J].中国计划生育学杂志,2014,22(6):417-420.
[5] 段娥,李英勇.补充维生素D对妊娠期糖尿病孕妇胰岛素抵抗的影响[J].中国妇幼保健,2014,29(9):1449-1451.
[6] Tumurbaatar B, Poole AT, Olson G, et al. Adipose tissue insulin resistance in gestational diabetes[J]. Metab Syndr Relat Disord,2017,15(2):86-92.
[7] 潘宝龙,马润玫.脂肪因子Vaspin体外表达与妊娠期糖尿病胰岛素抵抗研究[J]. 实用医学杂志,2016,32(19):3123-3126.
[8] Shirakawa J, Fernandez M, Takatani T, et al. Insulin signaling regulates the FoxM1/PLK1/CENP-A pathway to promote adaptive pancreatic β cell proliferation[J].Cell Metab, 2017,25(4):868-882.
[9] 任茜,马宇航,黄倩芳,等.血清甘油三酯对初诊妊娠期糖尿病患者胰岛β细胞功能及胰岛素抵抗的影响[J].中华糖尿病杂志,2014,6(9):640-644.
[10] 韩一栩.两种血糖监测方法在妊娠期糖尿病和2型糖尿病合并妊娠患者中的应用效果观察[J].海南医学,2015,26(14):2122-2124.
[11] Grkem A, Küükler FK, Torul C, et al. Are adipokines associated with gestational diabetes mellitus[J]. J Turk Ger Gynecol Assoc, 2016,17(4):186-190.
[12] Oztas E, Ozler S, Ersoy E, et al. Prediction of gestational diabetes mellitus by first trimester serum secreted frizzle-related protein-5 levels[J]. J Matern Fetal Neonatal Med, 2016,29(9):1515-1519.
[13] Hu Z, Deng H, Qu H. Plasma SFRP5 levels are decreased in Chinese subjects with obesity and type 2 diabetes and negatively correlated with parameters of insulin resistance[J]. Diabetes Res Clin Pract, 2013,99(3):391-395.
[14] Banerjee RR, Cyphert HA, Walker EM, et al. Gestational diabetes mellitus from inactivation of prolactin receptor and MafB in islet β-cells[J]. Diabetes, 2016,65(8):2331-2341.
[15] Davis DB, Lavine JA, Suhonen JI, et al. FoxM1 is up-regulated by obesity and stimulates beta-cell proliferation[J]. Mol Endocrinol, 2010,24(9):1822-1834.
江苏省科技计划发展项目(BK2014189)。
10.3969/j.issn.1002-266X.2017.30.014
R714.25;R587.1
B
1002-266X(2017)30-0048-03
2017-02-10)

