柠檬酸钙在体外条件下对新鲜血液影响的实验研究*
彭磊 杨枚 周英勇 赵志蓉 刘建莉
柠檬酸钙在体外条件下对新鲜血液影响的实验研究*
彭磊 杨枚 周英勇 赵志蓉 刘建莉
目的探讨柠檬酸钙在体外条件下对新鲜血液的影响。方法测量加入柠檬酸钙后新鲜血液中红细胞的溶血率;分别向2 mL血清中加入柠檬酸钙0 mg、1.0 mg、2.0 mg、3.0 mg、4.0 mg、5.0 mg、6.0 mg、7.0 mg、8.0 mg、9.0 mg、10.0 mg和12.0 mg后测量血清中钙离子浓度,在此实验基础上,把实验分为四组,向5 mL新鲜血液中分别加入柠檬酸钙0 mg,1.0 mg,5.0 mg和9.0 mg后分别测量血液凝固前血清钙浓度、血液凝固后血清钙浓度、凝血块体积、凝血时间,测算单位体积凝血块中的钙浓度。结果柠檬酸钙具有良好的血液相容性,加入柠檬酸钙后新鲜血液中血清钙离子浓度增加,单位体积血凝块中的钙含量有统计学差异(<0.01),新鲜血液凝血时间延长。结论柠檬酸钙具有良好的生物相容性,加入新鲜血液中能够为骨折愈合提供适宜的钙离子浓度,柠檬酸钙溶解的钙离子能储存在凝血块中,可为骨折愈合后期提供所需的钙离子,柠檬酸钙作为骨生物材料具有良好的应用前景。
柠檬酸钙;骨修复材料;血清钙;钙离子;骨折愈合
创伤以及慢性疾病如骨质疏松症等会使骨折发生率大大增加,如何使骨折更好更快的愈合或者减少骨不连已成为骨科医生研究的热点问题。在骨修复材料领域,半水硫酸钙[1]、柠檬酸钙[2]、TCP[3]、HA[4]及复合材料被广泛应用在骨缺损或骨折治疗中。这些材料促进骨折愈合短期效果尚可,但吸收困难、降解性差,长期疗效不明[5]。
柠檬酸钙是临床广泛应用的有机补钙制剂,具有含钙高,吸收好,无毒副作用的特点,适用于老年人预防钙流失和增加骨密度。经过不断的研究探索,我们课题组前期把柠檬酸钙载体材料植入兔股骨髁部骨缺损处,证实柠檬酸钙具有促进兔股骨髁部骨缺损修复的功效;柠檬酸钙对BMP诱导成骨具有促进作用,并呈剂量依赖性;柠檬酸钙是一类重要的成骨激活物质,适合进行高钙离子成骨的体内外研究[6,7]。柠檬酸钙作为生物骨修复材料的应用前景诱人,但是柠檬酸钙作为骨修复材料植入骨折部位对周围局部新鲜血液的影响却不清楚。本实验采用单纯柠檬酸钙对新鲜的抗凝血进行溶血试验,向血清中加入不同剂量的柠檬酸钙后比较其钙离子浓度变化、凝血时间及血凝块体积的不同,探讨柠檬酸钙的血液相容性以及对局部新鲜血液的影响,为其作为骨生物修复材料应用于骨损伤修复提供理论基础。
1 材料与方法
1.1 材料
实验动物:新西兰大白兔30只(海南医学院动物实验中心提供)。试剂与仪器:100 g柠檬酸钙(分析纯,市售)(国药集团化学试剂有限公司);FA2004电子分析天平(上海方瑞仪器有限公司);H-5300R离心机(湖南湘仪实验室仪器开发有限公司);UV1800PC紫外可见分光光度计(上海凤凰光学科仪有限公司);ADVIA2400型全自动生化分析仪(西门子公司);含肝素钠一次性使用真空储血管、10 mL塑料血清试管、100 mL容量瓶、5 mL、10 mL注射器(带7号针头)、三角漏斗、滤纸、称量纸、秒表、棉花及胶手套等(海南医学院创伤医学实验室提供)。
1.2 实验方法
1.2.1 柠檬酸钙对体外红细胞的溶血试验
取新鲜的兔血5mL,加入抗凝剂2%草酸钾0.25mL。轻轻摇晃试管,使血液与抗凝剂充分混合,防止血液凝固。量取新鲜的抗凝血2mL,加入2.5 mL的生理盐水配制成4:5的稀释抗凝血。称取柠檬酸钙1.5 g加入到量有15 mL生理盐水的烧杯中,摇匀。在37℃恒温水浴锅中预热30分钟,配制浸提液,取一只离心管中加入10mL浸提原液和0.2 mL稀释抗凝血。阳性对照在10 mL蒸馏水中加入0.2 mL稀释兔全血;阴性对照在10 mL生理盐水中加入0.2 mL稀释兔全血。将实验各组用振荡器混匀,置37℃恒温水域60min,2000r/min离心5分钟。取上清液用分光光度计在波长为545 nm测定每孔吸光值。按下列公式计算溶血率(测定值<5%时在正常范围内)

1.2.2 测定柠檬酸钙在血清中的最大浓度
有学者研究了柠檬酸钙水溶液的饱和钙浓度约为5 mmol/L[8],根据此浓度再次测定了不同梯度的柠檬酸钙在血清中的浓度。用电子分析天平称取的柠檬酸钙粉末0mg、1.0 mg、2.0mg、3.0 mg、4.0 mg、5.0mg、6.0 mg、7.0mg、8.0 mg、9.0 mg、10.0 mg和12.0 mg,加入2 mL的血清混合液,连续三天根据西门子全自动生化分析仪的标准(OCPC比色法)测定血清原液血清钙的浓度结果。
1.2.3 测定血液凝固前的血清钙浓度、凝血时间(CT)及血液凝固后的血清钙浓度
根据1.2.2测定的结果,经过多次预实验,取柠檬酸钙的质量分别为0 mg,1.0 mg,5.0 mg,9.0 mg和新鲜兔全血5 mL进行凝血时间、凝血块体积及其钙浓度的实验。
取2只离心管,分为两组,编号1和2,第2组加入1.0 mg柠檬酸钙。用带采血针的15mL的注射器采取日本大白兔血液10mL,平均分装到2支离心管中混匀,立即用离心机(3500 r/min)离心5分钟。依照西门子全自动生化分析仪的操作规程分别测定血清钙的浓度。
取3只离心管,分为3组,编号1、2和3,第2和3组加入1.0 mg柠檬酸钙。用带采血针的20 mL的注射器采取日本大白兔血液15 mL,平均分装到3支离心管中混匀,立即开始计时,以编号1血液凝固时间为对照点,记录此点的时间,助手立即取出编号1和3组,低速(500 r/min)分离,测量血清的体积,血液总体积减去血清体积从而计算血凝块的体积,并测定血清中的钙浓度。计时的人员不停止计时,直到编号2血液凝固停止秒表,记录实验数据。
柠檬酸钙质量为5 mg和9 mg时重复上述方法。
1.2.4 计算加入柠檬酸钙前后在单位体积凝血块中的钙含量
根据测出的血液凝固前、凝固后的血清钙浓度及凝血块体积,可以用下面公式

1.3 统计学方法
所有的实验均被重复10次以上,数据采用SPSS17.0软件处理,所有实验数据用表示,实验组和对照组数据采用配对检验,<0.05认为差异有统计学意义。
2 结果
2.1 溶血实验
柠檬酸钙浸提液引发的红细胞溶血率为2.94%,低于国家标准中的溶血率5%,说明柠檬酸钙在新鲜血液中不会引起溶血反应(表1)。
表1 柠檬酸钙的溶血结果(n=10,)

表1 柠檬酸钙的溶血结果(n=10,)
组别平均吸光度值阳性对照阴性对照1.107±0.0072 0.051±0.0014浸提原液0.080±0.0007

2.2 测定血清钙的最大浓度
相同体积的血清中,实验组与空白组比较,各组差异均具有统计学意义(<0.01),说明加入柠檬酸钙能使血清中的钙浓度增大。随着剂量的增加,柠檬酸钙在血清中的解离程度有相应的变化,所以在质量范围内柠檬酸钙在血清中的溶解或解离程度可能达到最大(图1)。
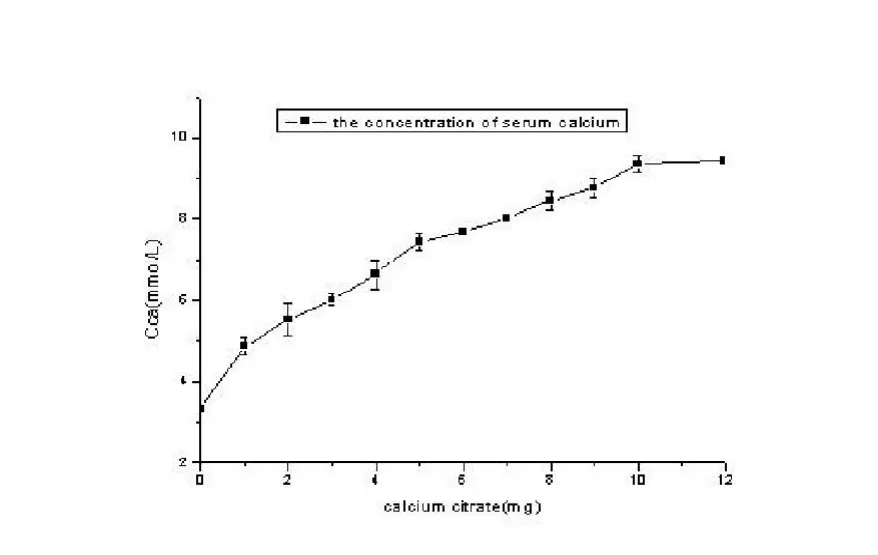
图1 测定柠檬酸钙在血清中的溶解度
2.3 测定凝血时间、凝血块体积及钙浓度
2.3.1 不同剂量的柠檬酸钙血液凝固前后血清钙浓度的测定
在相同体积的血液中,当加入不同剂量的柠檬酸钙时,血液凝固前与凝固后血清钙浓度的比较,各组血清钙浓度的差异具有统计学意义(<0.01),随着柠檬酸钙剂量的增加,各组血清钙浓度的差异具有统计学意义(<0.01)。5.0mg组和9.0mg组在凝固前的血清钙浓度比较后者有下降的趋势,说明当柠檬酸钙达到一定质量后在血液中的解离程度会降低(图2)。
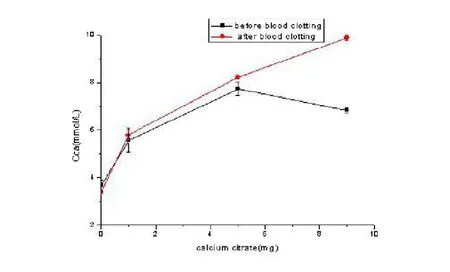
图2 加入不同剂量的柠檬酸钙血液凝固前后血清钙的浓度
2.3.2 测定加入不同剂量柠檬酸钙的单位体积血凝块中的钙浓度
在相同体积的血液中,与空白组比较,加入柠檬酸钙后的单位体积血凝块中的钙含量的有统计学差异(<0.01),说明溶解部分的柠檬酸钙可保存于血凝块中(图3)。但从5 mg及9 mg组看出,柠檬酸钙加入过量会使单位体积血凝块中钙的储存量减少。

图3 加入不同剂量柠檬酸钙的单位体积血凝块中的钙浓度
2.3.3 血液凝固时间的测定
在相同体积的血液中,与空白组比较,实验组的凝血时间具有统计学意义(<0.01),表明了柠檬酸钙能使血凝凝固时间延后的作用,但是各组之间时间差异较小,表明柠檬酸钙对新鲜血液的抗凝作用较弱。

表2 加入不同质量柠檬酸钙的血液凝固时间
3 分析与讨论
随着人类对骨折愈合机制研究不断的深入、骨折愈合基础理论的不断完善,越来越多的研究证明钙离子在骨折愈合的过程中扮演着重要作用。细胞外高Ca2+与细胞膜上相应的钙敏感性受体结合后可产生一系列的生物化学反应,促进成骨细胞的趋化、增殖及成熟,诱导相应细胞分化成成骨细胞并刺激骨形成[9]。机体补钙能够预防骨折疏松和由骨折疏松而导致的病理性骨折,骨性组织中的钙元素含量决定骨折愈合后的机械强度。
在临床治疗上,越来越多的含钙骨生物材料如磷酸氢钙和羟基磷灰石、半水硫酸钙治疗骨缺损和骨不连,取得了不错的临床治疗效果。但骨修复材料植入到骨折局部,骨折周围局部血液和凝血块中的钙离子浓度如何变化及促进骨折愈合的机制并不清楚。我们拟在体外新鲜血液中加入不同浓度的柠檬酸钙,对新鲜血液中钙离子浓度的变化进行研究,进一步揭示柠檬酸钙促进骨折愈合的机制。
HinichiMaeno[10]发现:当局部钙浓度为2~4mmol/L时有利于成骨细胞的增殖;6~8 mmol/L可以促进成骨细胞在二、三维支架上增殖和分化;10 mmol/L以上则具有一定的细胞毒性。5 mmol/L的钙浓度既有利于成骨细胞的增殖,又有利于成骨细胞的矿化。5 mmol/L的Ca2+浓度为最佳钙离子成骨浓度,能满足成骨细胞成骨需求。图2表明新鲜血液加入不同质量的柠檬酸钙后,较对照组有明显的统计学意义(<0.01)。新鲜血液中加入柠檬酸钙质量为1mg时,血清中钙浓度接近5mmol/L,在局部的微环境形成了相对稳定的钙浓度,理论上符合最佳成骨浓度要求。Duncan[11]证实Ca2+浓度大于10mmol/L对成骨细胞具有细胞毒性作用,加入柠檬酸钙0mg,1.0mg,5.0mg和9.0mg时,血清钙的浓度分别为4.06mmol/L,5.53mmol/L,7.74mmol/L和6.83mmol/ L,柠檬酸钙在新鲜血液中的钙离子溶解度可能介于4.06mmol/ L-7.74mmol/L,低于10mmol/L,对成骨细胞具有安全性。充分证明了柠檬酸钙作为骨修复材料在局部植入时,可以为骨折愈合解离出既适宜又在安全范围内的钙离子浓度。
骨折愈合过程一般分为血肿机化期、原始骨痂形成期、骨痂改造塑形期。我们课题组前期动物试验已经研究证实柠檬酸钙作为骨生物材料植入骨折局部后,能够促进骨缺损尤其是缺损不大的早期愈合。最早的钙离子浓度与骨折之间的关系的研究,主要集中在骨折早期血液钙离子浓度的变化;首先发现在桡骨远端或股骨干骨折患者,血液钙离子浓度在骨折后2~5天降低,说明钙离子参与骨折的早期血痂机化过程。除此之外,研究表明在骨折愈合早期所需要的钙是从骨组织吸收的,并不需要食物来源中的钙,在骨折的愈合后期,来源于食物的钙对骨折愈合才是极其重要的。所以,理想中的骨修复材料在骨折愈合的后期应该能够提供充足的钙,图3表明新鲜血液中加入柠檬酸钙后形成的凝血块中的钙含量比空白试验更多(<0.01),钙离子最大浓度也低于10 mmol/L,具有安全性。新鲜血液局部植入柠檬酸钙后,钙离子通过凝血过程在骨折血肿期通过凝血块储存更多的钙源,这可能是柠檬酸钙作为骨修复材料另外一个优势。随着时间延长,局部凝血块崩解,通过释放可溶性钙离子来增加局部的钙离子浓度,为骨折愈合后期愈合提供所需的钙源。凝血块的降解过程需要进一步体内实验进行证实。
溶血实验是通过对材料与血红细胞在体外接触所导致的红细胞溶解和血红蛋白游离程度的测定来评价材料的血液相容性。因其敏感度高,重现性好,是目前筛选及评价生物材料首选实验,对于直接接触血液系统的生物材料尤为重要,柠檬酸钙对体外红细胞的溶血率为2.94%,低于5%,具有生物材料的安全性。表2表明体外新鲜血液中加入柠檬酸钙粉末前后的凝血时间差异不大,进一步证实了体内植入柠檬酸钙的安全性。在临床上广泛用柠檬酸盐抗凝血,柠檬酸钙具有微弱的抗凝效果,原因可能是血液中完全解离出来的柠檬酸根离子与可扩散的钙离子结合形成不易解离但可溶解的络合物,从而减少血浆中的钙离子,防止血液凝固[12,13]。
综上所述,柠檬酸钙具有良好的血液相容性和微弱的抗凝效果,柠檬酸钙在新鲜血液中能够解离出适宜的钙离子浓度,柠檬酸钙在新鲜血液中溶解的钙离子能储存在凝血块中。柠檬酸钙可以作为适宜的骨生物修复材料,具有良好的应用前景。
[1]Evaniew N,Tan V,Parasu N,et al.Use of a calcium sulfate-calcium phosphatesyntheticbonegraftcompositeinthesurgicalmanagement of primary bone tumors[J].Orthopedics.2013,36(2):216-222.
[2]Jehle S,Hulter HN,Krapf R.Effect of potassium citrate on bone density,microarchitecture,and fracture risk in healthy older adults without osteoporosis:a randomized controlled trial[J].TheJournal of clinical endocrinology and metabolism.2013,98(1):207-217.
[3]Cao L,Liu X,Liu S,et al.Experimental repair of segmental bone defects in rabbits by angiopoietin-1 gene transfected MSCs seeded on porous-TCP scaffolds[J].Journal of Biomedical Matericals research PartB,Applied Biomaterial.2012,100(5):1229-1236.
[4]Walsh WR,Pelletier MH,Bertollo N,et al.Does PEEK/HA enhance boneformationcomparedwithPEEKinasheepcervicalfusionmodel?[J].Clin Orthop Relat Res.2016,474(11):2364-2372.
[5]Yeo A,Sju BR.The degradation profile of novel,bioresorbable PCL-TCP scaffolds:an in vitro and in vivo study[J].Journal of Biomedical Materials Research Part A,2008,84(1):208.
[6]Wei Zhang,Wei Wang et al.Effect of calcium citrate on bone integration in a rabbit femur defect[J].Asian Pacific Journal of Tropical Medicine,2012,5(4):310-314.
[7]Wang Wei,Chen Qingyu,Li Xiucui,et al.Enhancement of bone formation with a synthetic matrix containing bone morphogenetic protein-2 by the addition of calcium citrate[J].Knee Surg Sports Traumatol Arthrosc,2013,21(2):456-465.
[8]石莉萍.生化自动分析仪在测定血清钙镁中的应用与质量评价[J].微量元素与健康研究,1996,13(3):53-53.
[9]Maeno S,Niki Y,Matsumoto H,et al.The effect of calcium ion concentration on osteoblast viability,proliferation and differentiation in monolayerand3Dculture[J].Biomaterials,2005,26(23):4847-4855.
[10]Shinichi M,Yasuo N,Hideo M,et a1.The effect of calcium ion concentration Onosteoblast viability,proliferation and differentiation in monolayer and 3D culture[J].Biomaterials,2005,26:4847-4855.
[11]Duncan RL,Akanbi KA,Farach-Carson MC.Calcium signals and calciumchannels inosteoblastic cells[J].Semin Nephrol,1998,18 (2):178-190.
[12]Davis TK,Neumayr T,Geile K,et a1.Citrate anticoagulation during continuous renal replacement therapy in pediatric critical care [J].Pediatr Crit Care Med.2014,15(5):471-485.
[13]OngSC,WilleKM,Speer R,eta1.Acontinuous veno-venous hemofiltration protocol with anticoagulant citrate dextrose formula A and a calcium-containing replacement fluid[J].Int J Artif Organs. 2014,37(6):499-502.
In vitro study of the effect of calcium citrate on the fresh blood
Peng Lei,Yang Mei,Zhou Yingyong,et al.Department of trauma medicine,the First Affiliated Hospital of Hainan Medical University,Haikou Hainan 570100,China
Objective To study the affect of calcium citrate on the fresh blood in vitro.Method In this study,erythrocyte hemolysis rate was calculated.Various amounts ofcalcium citratewere addedinto the blood serums.The concentrations of the calcium ion in the treated blood serums were measured.After that,various amounts of calcium citrate were added into the fresh blood.The concentrations of blood calcium before and after blood clotting,the time of blood clotting and the volumes of the blood clots were measured respectively.Results Erythrocyte hemolysis rate is about 2.94%,the concentration of serum calcium increased with calcium citrate addition.The concentrations of calcium ion in the blood clots were significantly enhanced by adding the calcium citrate.The time of blood clotting was delayed.when the calcium citrate dissolved in the fresh blood,the concentration of serum calcium was proper for fracture healing,the calcium ions could be depositedin the bloodclots,which can providethesource of calciumions for the laterbone healing.Conclusion Calcium citrate exhibit excellent biocompatibility.Calcium citrate as biomedical materials has a huge market potential and the good market prospect.
Calcium citrate;Bone repair materials;Serum calcium;Calcium ion;Fracture healing
R318.08
A
10.3969/j.issn.1672-5972.2017.04.003
swgk2017-03-00049
彭磊(1975-)男,博士,主任医师。研究方向:骨科。
2017-03-07)
国家自然科学基金资助项目(81460339),海南省科技厅资助项目(SF201416),海南省自然科学基金资助项目(514216),海南省科技合作专项资助项目(KJHZ2015-05),海南省卫生厅重点项目课题项目(2013-06),海南省科学技术厅(ZDXM20110051),浙江省卫生厅:(2009B107)
海南医学院第一附属医院创伤医学中心,海南海口570100

