电子束熔融法制备的医用Ti6Al4V在人工模拟体液中的耐腐蚀行为*
魏崇斌马骏王彩梅*马小林杨晓杰张卫平李志疆
电子束熔融法制备的医用Ti6Al4V在人工模拟体液中的耐腐蚀行为*
魏崇斌1,2马骏1,2王彩梅1,2*马小林1,2杨晓杰1,2张卫平1,2李志疆1,2
目的研究电子束熔融技术(EBM)3D打印制备的医用Ti6Al4V不同打印截面在Hank's模拟人工体液中的电化学腐蚀行为。方法采用开路电位和动电位极化曲线方法研究了Ti6Al4V不同打印截面,分别记为EBMXOY面(垂直于打印方向的钛合金截面)和EBM-YOZ面(平行于打印方向的钛合金截面),在Hank's模拟人工体液中的电化学腐蚀行为,利用SEM、XRD和金相显微镜分析了其表面形貌和物相组成及其腐蚀机理,并与传统医用锻造Ti6Al4V进行了对比研究。结果与传统医用锻造Ti6Al4V合金相比,EBM-YOZ面钛合金在Hank's模拟人工体液中的开路电位、腐蚀电位和腐蚀电流与之相当,显示出与之接近的耐腐蚀性能;EBM-XOY面钛合金的耐腐蚀性能较EBM-XOZ面和传统锻造钛合金稍差,主要原因是EBM-XOY面的+相界面积大,相含量较高,且被优先溶解,因此,耐腐蚀性能较差。结论电子束熔融制造的Ti6Al4V不同截面的耐腐蚀性能不同,EBM-YOZ面的耐腐蚀性能与传统医用锻造钛合金相当,EBM-XOY面的耐腐蚀性能稍差。
电子束熔融;Ti6Al4V;耐腐蚀性能
随着生物医用材料的进步和发展、人们健康意识的增强和医疗观念的转变,骨科植入物及相关医疗器械实现了快速发展。根据ORTHOWORLD的报道,2014年外科植入物及相关医用材料的销售额总计约为455亿美元,预计在2015年到2020年之间将保持3%的增长率[1]。植入医用金属材料已成为植入治疗的主要手段,而钛合金具有比重小、比强度高、弹性模量低,生物力学性能优良,尤其是生物相容性好等特点,在临床上已成为植入材料的主流[2],如人工关节等硬组织修复与替代[3]、口腔修复领域[4]、心血管修复[5]以及颅骨颌面骨[6]等复杂部位的修复。
虽然医用钛合金Ti6Al4V具有良好的生物相容性,但是作为植入假体需要长期置于人体体液环境中,由于植入物表面物质与体液发生反应,存在一定的腐蚀行为。一方面会导致腐蚀产物进入人体组织,引起严重的生理危害,已有研究证实V、Al是对生物体有潜在毒副作用的元素,特别是V的生物毒性要超过Ni/Cr[7];另一方面也会导致植入假体材料力学性能降低和耐磨蚀性能恶化,甚至出现植入假体在人体内的松动或造成局部骨溶解,最终造成植入假体失败[8]。对传统的医用钛合金的耐腐蚀性能已有较多的研究。Balyanov等[9]研究了超细晶粒钛合金与粗大晶粒钛合金耐腐蚀性能的差异,超细晶粒钛合金的耐腐蚀性能显著优于粗晶粒的钛合金,由此说明不同钛合金的耐腐蚀行为与晶粒大小有关。Atapour等[10]对不同组分的两种钛合金Ti-13Mo-7Zr-3F和Ti-35Nb-7Zr-5Ta在0.9%NaCl溶液和5M HCl溶液中的耐腐蚀性能进行了研究。结果表明:两种不同组分钛合金的显微组织形貌及分布大小是引起耐腐行为不同的主要因素。Martin等[11]对具有不同组织及晶粒取向的Ti6Al4V合金的耐腐蚀性能进行了报道,双相和钛合金的耐腐蚀性能优于马氏体和针片状组织。Hoseini等[12]的研究也表明了工业纯钛晶粒大小和取向对腐蚀性能具有显著的影响。因此,大量的研究报道均表明钛合金的显微组织和晶粒大小及取向对其耐腐蚀行为具有显著的影响。
近年来,电子束熔融(EBM)制造Ti6Al4V已经在骨科植入物上广泛应用[13-15]。EBM制造的钛合金由于加工制造过程的特殊性,其组织与传统工艺制造的合金(如锻件)存在较大差异,因此,众多的研究对增材制造工艺参数的设置、后处理方式以及其它影响组织和性能的因素等方面进行了大量报道[16-18]。对增材制造过程中相变过程和梯度组织结构形成的机理进行了深入的研究[19-20]。由于增材制造加工过程是在激光束或电子束的扫描下,由线到面再到三维体的逐渐融化凝固成型,金属粉末的融化凝固存在一定方向性,因此,其形成的微观组织在水平方向和垂直方向具有明显差异性。Murr[21]等研究表明,平行于加工方向即和加工平台垂直的部件截面,有明显的柱状晶存在,这种晶粒的取向性导致力学性能的各向异性。即平行于加工方向和垂直于加工方向的界面上相组成和比例不同,由此导致了钛合金力学性能的差异。但截至目前,还未有EBM制造医用钛合金的耐腐蚀性能的研究报道。
EBM制造的医用钛合金在人体体液的腐蚀环境下,显微组织和相的形态等因素对其耐蚀性及腐蚀行为均具有重要的影响,由此可能造成的EBM制造的钛合金不同打印截面在人体体液中的化学稳定性不同。因而研究EBM制造的Ti6Al4V合金的不同打印截面在人工模拟体液中的电化学腐蚀行为及腐蚀机理不仅能够对EBM制造的Ti6Al4V合金不同截面的耐腐蚀性能差异提供有价值的参考数据,而且对打印的人工植入物的应用具有重要指导作用。本文以EBM打印的Ti6Al4V合金为例,采用开路电位、动电位极化曲线的方法,研究了Ti6Al4V合金不同的打印方向截面在Hank's模拟人工体液中的电化学腐蚀行为及腐蚀机理,并与传统锻造Ti6Al4V(股骨柄用钛合金锻件)进行了对比研究。
1 实验
采用Arcam公司生产的Q10Plus型电子束熔融设备打印医用Ti6Al4V合金,打印坐标系如图1所示,在成型的打印块体上取样,分别在XOY面和YOZ面取样作为腐蚀面,记做EBM-XOY和EBM-YOZ。加工成的圆片试样,用水砂纸打磨并抛光表面,保证表面粗糙度一致,最后用乙醇超声清洗后干燥备用。EBM制造的Ti6Al4V合金和股骨柄用锻造钛合金(Forged)试样成分符合国标GB/T13810-2007要求。

图1 不同打印截面的Ti6Al4V取样示意图:(a)EBM-XOY;(b)EBMYOZ。
采用BrukerD8Advance型X射线衍射仪(XRD)对打磨抛光后的Ti6Al4V样片进行物相结构分析;采用体积比为3:7:90的氢氟酸、硝酸和水的混合溶液进行腐蚀,并借助Axiovert 200MAT/Zeiss光学显微镜进行显微组织的观察。采用JSM-IT300扫描电镜观察样品表面形貌,采用Image-Pro Plus软件统计组织中不同相含量。
电化学实验在扫描电化学工作站(VersaScan)上进行,电化学体系为标准三电极体系,工作电极为测试试样,参比电极为饱和甘汞电极(SCE),辅助电极为铂片。以Hank's模拟人工体液作为测试溶液,pH=7.4,实验温度37℃。开路电位:将测试试样浸入测试溶液中,记录30 min内开路电位电位(Eocrr)的变化情况。测试试样在测试溶液中稳定30 min后进行极化曲线测量,极化曲线测试时从开路电位-0.8V(vsSCE)扫描至2V(vsSCE),扫描速率为1mV/ s。测得每片试样在Hank's模拟体液中的极化曲线。
2 结果与讨论
2.1 开路电位
图2所示为Ti6Al4V试样在Hank's人工模拟体液中的开路电位随时间变化曲线。图中曲线表明,经过一段时间,EBM-XOY、EBM-YOZ和锻造钛合金的开路电位均达到较稳定的值,其中锻造钛合金随着浸泡时间的延长,进一步升高,并趋于稳定,说明锻造钛合金表面在溶液中浸泡后,合金表面形成了新的钝化膜并逐渐增厚、致密,使得耐蚀性提高。其中EBM-YOZ面的开路电位比EBM-XOY面的电位正移约0.08 V,与锻造钛合金的开路电位相当。
开路电位反映了材料在介质中的化学稳定性,且开路电位越高,合金的腐蚀倾向下降,即电位正移表明材料具有更佳的耐腐蚀性能[22]。根据测试结果可以看出锻造钛合金、EBM-XOY、EBM-YOZ的开路电位分别为-231、-239、-309 mV。表明在Hank's溶液中,EBM制造的钛合金YOZ面与锻态钛合金的开路电位基本相同,EBM-XOY面的耐腐蚀性能与EBM-YOZ面存在一定的差异,EBM制造的钛合金的XOY面的耐腐蚀性较差。

图2 三种Ti6Al4V合金在Hank's模拟体液中的开路电位随时间变化曲线。
2.2 动电位极化曲线
图3(a)所示为Ti6Al4V合金试样在Hank's溶液中开路电位随时间的变化曲线,三种试样均为典型的金属极化曲线,表现出较低的腐蚀电流密度。电位超过一定值之后,进入钝化阶段,腐蚀电流保持稳定,大小不变;电位超过1.3 V之后,合金发生过钝化,表明此时点蚀发生在局部区域,腐蚀电流增大。EBM-YOZ面钛合金的腐蚀电位与锻造钛合金的腐蚀电位基本相当,EBM-XOY面钛合金的腐蚀电位较低。钛合金植入物在人体内的电位为0.4V~0.6V[23],将该电位部分的极化曲线放大,如图3(b)所示,在此电位区间,3种类合金的腐蚀电流变化十分微小,大小基本没有变化。EBM-XOY面钛合金的腐蚀电流最低,锻造钛合金的腐蚀电流最大,但腐蚀电流的大小均在同一数量级。
由热力学原理可知,材料发生腐蚀行为的倾向可由腐蚀电位表征,腐蚀电位越低,材料发生腐蚀行为的倾向越大。腐蚀倾向表征腐蚀行为发生的难易程度,因此在Hank's人工模拟溶液中EBM-YOZ面钛合金和锻造钛合金的腐蚀性能优于EBM-XOY面的钛合金。
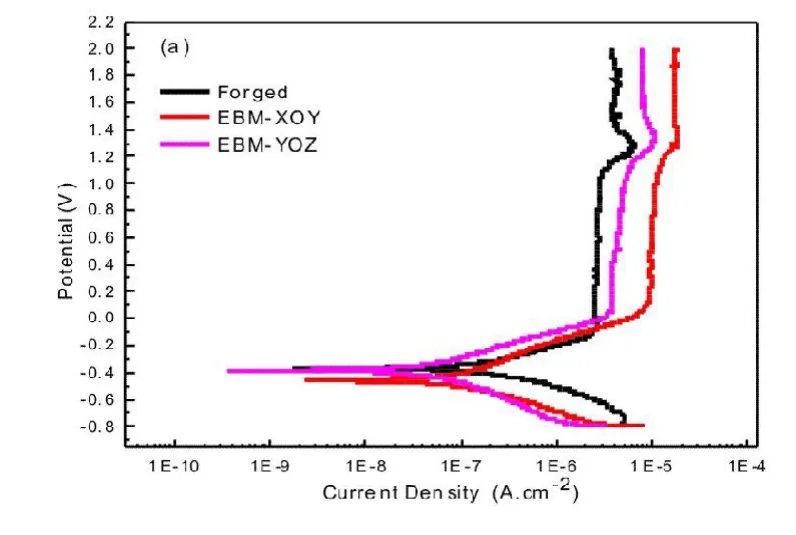
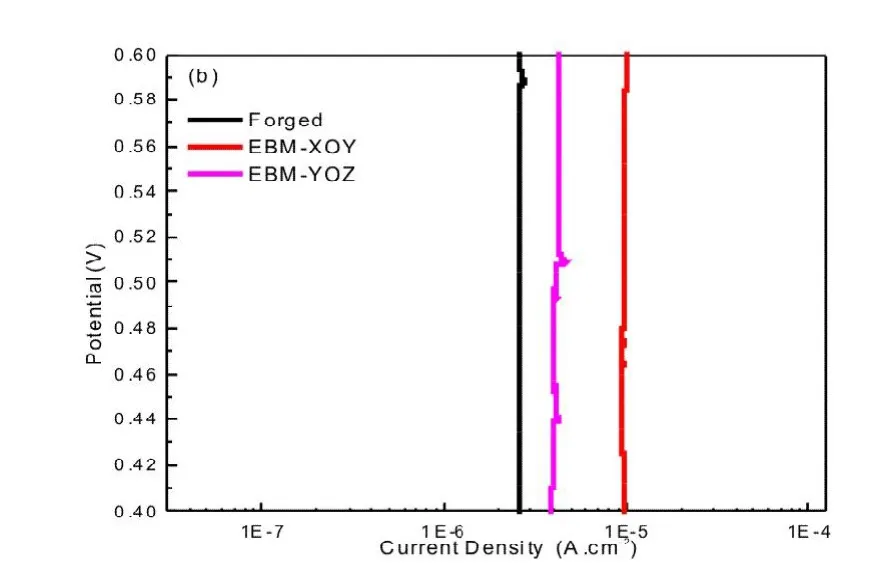
图3 三种Ti6Al4V合金在Hank's模拟体液中的腐蚀行为:(a)动电位极化曲线;(b)电位极化曲线局部图。
表1所示为由图3计算出的电化学腐蚀参数。三种Ti6Al4V的腐蚀电位Ecorr不同,其中锻造钛合金的腐蚀电位最高,EBM制造钛合金的不同截面上的腐蚀电位不同,XOY面的腐蚀电位最低。腐蚀电流密度Icorr由大到小的顺序依次是:EBM-XOY面、EBM-YOZ面、锻造钛合金。Icor的值越大,则表示腐蚀反应速度越迅速,因而EBM-XOY面钛合金的腐蚀速度较其它合金的快。钝化电流密度Ip越小,表明材料更容易从活化状态进入到钝化状态,固锻造钛合金更容易钝化,EBM-XOY面钛合金较难钝化。从表1可见,由Ecorr、Icorr和Ip三个参数判断:锻造钛合金和EBMYOZ面钛合金的腐蚀性能显著优于EBM-XOY面。由极化曲线得到的各合金的自腐蚀电位Ecorr值大小顺序为锻造钛合金>EBM-YOZ>EBM-XOY,则合金腐蚀倾向由大到小的顺序与之相反,此处与前述开路电位与时间的关系曲线得到的结果相吻合。
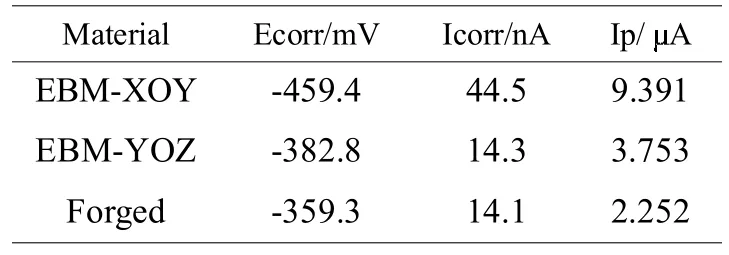
表1 EBM-XOY、EBM-YOZ和锻造钛合金在Hank's溶液中的动电位极化曲线参数
2.3 腐蚀后合金的表面状态
图4所示为三种Ti6Al4V合金在Hank's溶液中腐蚀之后的表面形貌图。从图中可以看出三种Ti6Al4V合金的表面相均发生了明显腐蚀。在三种合金的表面同时存在一定的孔蚀,这是一种局部腐蚀形态。通常在钝化膜的缺陷处,如划痕,晶界上有碳化物沉积时,在这些特定点上优先形成孔蚀核,并分布于钝化金属的表面上[24]。EBM-XOY面和锻造钛合金表面有较多的连续腐蚀孔,EBM-YOZ面仅有分散的腐蚀坑。

图4 Ti6Al4V在Hank's模拟体液中腐蚀之后的表面形貌图:(a)EBMXOY,(b)EBM-YOZ和(c)锻造钛合金。
2.4 电化学腐蚀分析
EBM制造Ti6Al4V的XOY面和YOZ面,以及锻造钛合金的元素和组织形貌,对其在Hank's溶液腐蚀过程中表面钝化膜的形成与破坏具有重要影响。三种钛合金的主要成分均是Ti6Al4V,在腐蚀过程中,表面主要生成了由Al2O3,V2O5和TiO2组成的钝化膜,从元素成分上看三种Ti6Al4V的形成钝化膜基本一致。因此,三种合金耐腐蚀性能产生差异的主要原因是由相组成的不同、相界分布不同、组织均匀程度等因素造成的[9,25,26]。
图5所示为三种Ti6Al4V合金的XRD图谱,从图中所示,三种Ti6Al4V的主衍射峰物相均为两相:密排六方相相和体心立方相。与锻造钛合金和EBM-YOZ面Ti6Al4V的衍射峰相比,EBM-XOY面上的相衍射峰衍射强度低,说明在该截面上相含量较低。而相的自腐蚀电位高于相,因此,相的耐腐性更好[25,26],EBM-XOY面相含量较低,由此,在一定程度上可以认为是其耐腐蚀性较差的原因之一。
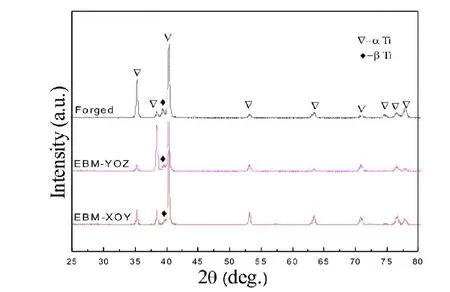
图5 三种Ti6Al4V的XRD图谱
图6所示为EBM-XOY面、EBM-YOZ面和锻造钛合金的金相组织照片。电子束熔融技术制造的Ti6Al4V的合金组织与锻造钛合金的显微组织明显不同。图6(a)中,EBMXOY面的金相组织中,连续的晶界相清晰可见,其间有片层状的相和针状’相,相含量约为71.3%。在EBM-YOZ面上,如图6(b)所示,原始的柱状晶粒轴线与堆积高度方向基本平行,在原始晶界内部是较多的细小的针状’相,有较为完整的晶界相;原始晶粒长度约为,直径约,并且穿过多个沉积层定向生长,相含量约为69.1%。由图6(a)和6(b)可以看出,EBM打印的XOY面和YOZ面上的组织的形貌有较大差异,图6(c)为锻造Ti6Al4V典型的双相组织,等轴状的相和呈类球状的孤立相随机分布,其中相含量约为68.2%。

图6 Ti6Al4V合金金相组织照片:(a)EBM-XOY、(b)EBM-YOZ和(c)锻造钛合金。
3 结论
[1]Lin X,Yang S,Lai K,et al.Orthopedic implant biomaterials with both osteogenic and anti-infection capacities and associated in vivo evaluation methods[J].Nanomedicine:Nanotechnology,Biology and Medicine.2017,13(1):123-142.
[2]Geetha M,Singh A K,Asokamani R,et al.Ti based biomaterials, the ultimate choice for orthopaedic implants-A review[J].Progress in Materials Science,2009,54(3):397-425.
[3]Liu X,Chu P,Ding C.Surface modification of titanium,titanium alloys,andrelatedmaterials for biomedical applications[J].Materials Science and Engineering:R:Reports,2004,47(3-4):49-121.
[4]Elias C N,Lima J H C,Valiev R,et al.Biomedical applications of titanium and its alloys[J].JOM,2008,60(3):46-49.
[5]Achneck H E,Jamiolkowski R M,Jantzen A E,et al.The biocompatibility of titanium cardiovascular devices seeded with autologous blood-derived endothelial progenitor cells:EPC-seeded antithrombotic Ti Implants[J].Biomaterials,2011,32(1):10-18.
[6]Winder J,Cooke RS,Gray J,etal.Medical rapid prototyping and 3D CT in the manufacture of custom made cranial titanium plates[J]. Journal of Medical Engineering&Technology,1999,23(1):26-28.
[7]Long M,Rack H J.Titanium alloys in total joint replacement--a materialsscienceperspective[J].Biomaterials,1998,19(18):1621-1639.
[8]Fojt J,Joska L,Málek J.Corrosion behaviourof porous Ti-39Nb alloy for biomedicalapplications[J].Corrosion Science,2013,71(3):78-83.
[9]BalyanovA,KutnyakovaJ,AmirkhanovaNA,etal.Corrosionresistance ofultrafine-grainedTi[J].ScriptaMaterialia,2004,51(3):225-229.
[10]Atapour M,Pilchak A L,Frankel G S,et al.Corrosion behavior of titanium alloys for biomedical applications[J].Materials Science &Engineering C,2011,31(5):885-891.
[11]Martin é,Azzi M,Salishchev G A,et al.Influence of microstructure and texture on the corrosion and tribocorrosion behavior of Ti-6Al-4V[J].Tribology International,2010,43(5-6):918-924.
[12]Hoseini M,Shahryari A,Omanovic S,et al.Comparative effect of grain size and texture on the corrosion behaviour of commercially pure titanium processed by equal channel angular pressing[J]. Corrosion Science,2009,51(12):3064-3067.
[13]黄卫东,吕晓卫,林鑫.激光成形制备生物医用材料研究现状与发展趋势[J].中国材料进展,2011,30(4):1-10.
[14]周梦,成艳,周晓晨,等.基于增材制造技术的钛合金医用植入物[J].中国科学:技术科学,2016,46(11):1097-1115.
[15]KumarA,MandalS,BaruiS,etal.Lowtemperatureadditivemanufacturing of three dimensional scaffolds for bone-tissue engineering applications:Processing related challenges and property assessment[J]. MaterialsScience&EngineeringR Reports,2016,103:1-39.
[16]Murr L E,Gaytan S M,Medina F,et al.Next-generation biomedical implants using additive manufacturing of complex,cellular and functional mesh arrays[J].Philosophical Transactions,2010, 368(1917):1999-2032.
[17]Sallica-Leva E,Jardini A L,Fogagnolo J B.Microstructure and mechanical behavior of porous Ti-6Al-4V parts obtained by selective laser melting[J].Journal of the Mechanical Behavior of Biomedical Materials,2013,26(30):98-108.
[18]Guo C,Ge W,Lin F.Effects of scanning parameters on material deposition during Electron Beam Selective Melting of Ti-6Al-4V powder[J].Journal of Materials Processing Tech,2015,217:148-157.
[19]Tan X,Kok Y,Tan Y J,et al.Graded microstructure and mechanical properties of additive manufactured Ti6Al4V via electron beam melting[J].Acta Materialia,2015,97:1-16.
[20]Lu S L,Qian M,Tang H P,et al.Massive transformation in Ti6Al4V additively manufactured by selective electron beam melting[J].Acta Materialia,2016,104:303-311.
[21]MurrLE,GaytanSM,RamirezDA,etal.Metal FabricationbyAdditiveManufacturingUsingLaserandElectronBeamMeltingTechnologies[J].Journal of Materials Science&Technology,2012,28(1):1-14.
[22]Metikos-Hukovi M,Kwokal A,Piljac J.The influence of niobium and vanadium on passivity of titanium-based implants in physiological solution[J].Biomaterials,2003,24(21):3765-3775.
[23]Velten D,Biehl V,Aubertin F,et al.Preparation of TiO2layers on cp-Ti and Ti6Al4V by thermal and anodic oxidation and by sol-gel coating techniques and their characterization.[J].Journal of Biomedical Materials Research,2002,59(1):18-28.
[24]邦江涛,赵西成,杨西荣.医用钛的腐蚀性能研究[J].热加工工艺,2012,41(22):17-19.
[25]Zhou Y L,Niinomi M,Akahori T,et al.Corrosion resistance and biocompatibility of Ti-Ta alloys for biomedical applications[J]. Materials Science&Engineering A,2005,398(1-2):28-36.
[26]AtapourM,PilchakAL,FrankelGS,etal.CorrosionBehaviorofFrictionStir-ProcessedandGasTungstenArc-WeldedTi-6Al-4V[J].Metallurgical andMaterials TransactionsA,2010,41(9):2318-2327.
[27]Mythili R,Shankar A R,Saroja S,et al.Influence of microstructure on corrosion behavior of Ti-5%Ta-1.8%Nb alloy[J].Journal of Materials Science,2007,42(15):5924-5935.
[28]Shankar A R,Dayal R K,Balasubramaniam R,et al.Effect of heat treatment on the corrosion behaviour of Ti-5Ta-1.8Nb alloy in boiling concentrated nitric acid[J].Journal of Nuclear Materials, 2008,372(2):277-284.
[29]Mythili R,Saroja S,Vijayalakshmi M,et al.Selection of optimum microstructure for improved corrosion resistance in a Ti-5%Ta-1.8% Nb alloy[J].Journal of Nuclear Materials,2005,345(2-3):167-183.
Corrosion behavior of medical Ti6Al4V alloys prepared by electron beam melting in artificial body fluid
Wei Chongbin1,2,Ma Jun1,2,Wang Caimei1,2,et al.1 Beijing AK medical Co.,Ltd;2 Beijing 3D printing orthopaedics application engineering research center,Beijing,102200,China
Objective To study the corrosion behavior of medical Ti6Al4V alloys prepared by electron beam melting with EBM-XOYandEBM-YOZcross-section thatrespectto the builddirection in Hank'ssolution.Methods Corrosionbehavior and mechanism of the alloys was investigated in Hank's solution by means of open-circuit potential and potentiodynamic polarization techniques.The surface morphologies and phases were analyzed by SEM,XRD and optical micrographs. Commercially forged medical Ti6Al4V was also investigated to make a comparison.Results In comparison with forged Ti6Al4V,EBM-YOZTi6Al4V exhibitedagoodcorrosionresistance withnearly the sameopen-circuit potential,corrosion potential and corrosion current.EBM-XOY Ti6Al4V exhibited inferior corrosion behavior to EBM-YOZ and forged Ti6Al4V alloys.This behavior can be attributed to morephase and+phase interfaces,and thephase appeared to becorroded tocontinueddissolutionthanthephase.ConclusionThedifferentcross-section of medical Ti6Al4Vprepared by electron beam meltinghas the different corrosion resistance.EBM-YOZ section whichis parallel to the build direction exhibited the similar corrosion resistance with commercially forged Ti6Al4V,while EBM-XOY section which is perpendicular to the build direction shown inferior corrosion behavior.
Electron beam melting;Ti6Al4V;Corrosion resistance
R318.08
A
10.3969/j.issn.1672-5972.2017.04.002
swgk2017-05-00102
魏崇斌(1983-)男,博士,工程师。研究方向:医用3D打印钛合金。
*[通讯作者]王彩梅(1973-)女,博士,研究员。研究方向:人工关节植入物。
2017-05-05)
国家重点研发计划项目(2016YFB1101504),北京科委首都市民健康课题培育项目(Z161100000116100)
1北京爱康宜诚医疗器材有限公司;2北京市3D打印骨科应用工程技术研究中心,北京102200

