SIRT3在脱氧胆酸诱导人正常结肠上皮NCM460细胞能量代谢损伤中的作用*
王传杰, 周 洋, 张 萌, 周 英, 徐佳琪, 朱敏航, 詹 琳, 周乾毅, 袁 琼
(武汉科技大学医学院药学系, 湖北 武汉 430065)
SIRT3在脱氧胆酸诱导人正常结肠上皮NCM460细胞能量代谢损伤中的作用*
王传杰, 周 洋, 张 萌, 周 英, 徐佳琪, 朱敏航, 詹 琳, 周乾毅, 袁 琼△
(武汉科技大学医学院药学系, 湖北 武汉 430065)
目的: 探讨脱氧胆酸(deoxycholic acid,DCA)对人结肠上皮NCM460细胞能量代谢损伤的影响及可能机制。方法: 培养人正常结肠上皮NCM460细胞,采用DCA(10 μmol/L、30 μmol/L和100 μmol/L)作用5 d,或DCA(100 μmol/L)作用3、5和7 d;DCA(100 μmol/L)处理3 d后,用去乙酰化酶sirtuin 3 (SIRT3)激动剂白藜芦醇(resveratrol,REV)处理细胞后继续培养至第7天。细胞腺苷三磷酸(adenosine triphosphate,ATP)和乳酸生成量用试剂盒检测,Western blot 检测细胞的SIRT3表达。结果: DCA能浓度和时间依赖性地抑制NCM460细胞生成ATP并促进乳酸生成,抑制SIRT3蛋白表达;白藜芦醇能逆转DCA对NCM460细胞的作用。结论: DCA对人结肠上皮NCM460细胞的能量代谢具有损伤作用,其损伤作用与SIRT3相关。
脱氧胆酸; 能量代谢; 乳酸; 腺苷三磷酸; Sirtuin 3; 白藜芦醇
胆汁排入肠腔后,初级胆汁酸在回肠和结肠上段经细菌水解和脱羟基作用转化为次级胆汁酸,包括脱氧胆酸(deoxycholic acid,DCA)和石胆酸,其中DCA是次级胆汁酸中活性最强的成分[1]。有研究结果显示DCA对正常的结肠上皮细胞具有损伤作用。DCA能诱导结肠上皮细胞内氧化应激水平从而改变线粒体膜通透性[2-3],释放细胞色素C并激活凋亡诱导因子(apoptosis-inducing factor, AIF)等促进结肠上皮细胞的损伤[4-5],然而,DCA是否能诱导结肠上皮细胞能量代谢障碍导致损伤尚未见文献报道。
Sirtuin家族成员通过对组蛋白及多种非组蛋白的乙酰化修饰参与细胞分化、凋亡、衰老及肿瘤发生等多个生理病理过程[6]。其中依赖于烟酰胺腺嘌呤二核苷酸的去乙酰化酶sirtuin 3 (SIRT3)的主要功能是催化线粒体应激反应蛋白去乙酰化[7]。近期质谱实验显示至少65%的线粒体蛋白赖氨酸乙酰化,而SIRT3表达增高抑制了线粒体蛋白的乙酰化水平[8]。在SIRT3缺陷小鼠模型中发现,SIRT3参与调节代谢、腺苷三磷酸(adenosine triphosphate,ATP)生成和氧化应激反应等多种线粒体功能。研究证实SIRT3在有氧呼吸第二、三阶段均能发挥作用,它通过对蛋白的去乙酰化从而催化三羧酸循环过程中的相关作用酶活性引起ATP生成增加[8]。细胞内线粒体功能障碍从而对有氧氧化造成影响导致的能量代谢损伤是否与SIRT3对有氧呼吸的调节有关目前尚无定论。
本研究通过离体细胞实验探讨DCA诱导结肠上皮细胞能量代谢受损及SIRT3是否参与该过程。
材 料 和 方 法
1 试剂及药物
脱氧胆酸(Sigma);新生牛血清(浙江天杭生物科技有限公司);RPMI-1640培养基(Thermo);BCA试剂盒和细胞线粒体分离试剂盒(碧云天);白藜芦醇(同田生物);兔抗人SIRT3及鼠抗人β-actin抗体(Santa Cruz);乳酸测定试剂盒(南京建成公司);ATP检测试剂盒(南京建成公司)。
2 实验方法
2.1 细胞实验方案 细胞实验分为3部分:(1)探讨DCA诱导细胞能量代谢障碍的量效作用,采用DCA(10 μmol/L、30 μmol/L和100 μmol/L)干预5 d;(2)探讨DCA对细胞能量代谢影响的时效性,DCA(100 μmol/L)处理 3 d、5 d和7 d;(3)探讨SIRT3涉及DCA的损伤作用,采用sirtuin家族激动剂白藜芦醇(resveratrol,REV)干预处理,实验分为4组:正常组;REV组,REV(10 μmol/L)处理4 d; DCA 组,DCA(100 μmol/L)处理7 d; DCA+REV组,DCA(100 μmol/L)干预3 d后,REV (10 μmol/L)与DCA同时继续干预4 d。
2.2 细胞培养及给药处理 人正常结肠上皮细胞系NCM460购于广州吉尼欧生物科技公司,常规复苏,RPMI-1640培养基于恒温培养箱中37 ℃、5% CO2培养。
2.3 乳酸及ATP测定 各组干预完成后收集细胞培养液上清,采用乳酸测定试剂盒测定细胞乳酸生成量,收集细胞采用细胞线粒体分离试剂盒分离线粒体,ATP检测试剂盒测定细胞ATP生成量,实验严格按照测定试剂盒说明书进行操作。
2.4 Western blot检测SIRT3的蛋白表达 采用RIPA裂解液裂解细胞收集蛋白,BCA比色法测定总蛋白浓度,每孔40 μg蛋白上样,蛋白凝胶电泳、转膜,5%脱脂奶粉封闭,TBST洗膜3次,分别加入抗SIRT3的抗体(1∶1 000)和抗β-actin抗体(1∶1 000)4 ℃孵育过夜。TBST洗膜3次后孵育II抗(1∶1 000)1 h,ECL显影。
3 统计学处理
所有数据均用均数±标准误(mean±SEM)表示。组间差异采用单因素方差分析(one-way ANOVA)和Student-Newman-Keuls多重比较检验分析。以P<0.05为差异有统计学意义。
结 果
1 DCA干预对NCM460细胞线粒体ATP生成的影响
采用不同剂量的DCA处理正常的结肠上皮细胞NCM460,检测线粒体生成ATP能力。结果显示与对照组相比,DCA能剂量依赖性地抑制NCM460细胞线粒体生成ATP,并在DCA浓度为100 μmol/L时,线粒体合成ATP能力最低(P<0.01)。DCA(100 μmol/L)分别处理NCM460细胞3 d、5 d和7 d均能显著抑制ATP生成的作用,且具有时间依赖性(P<0.01),见图1。
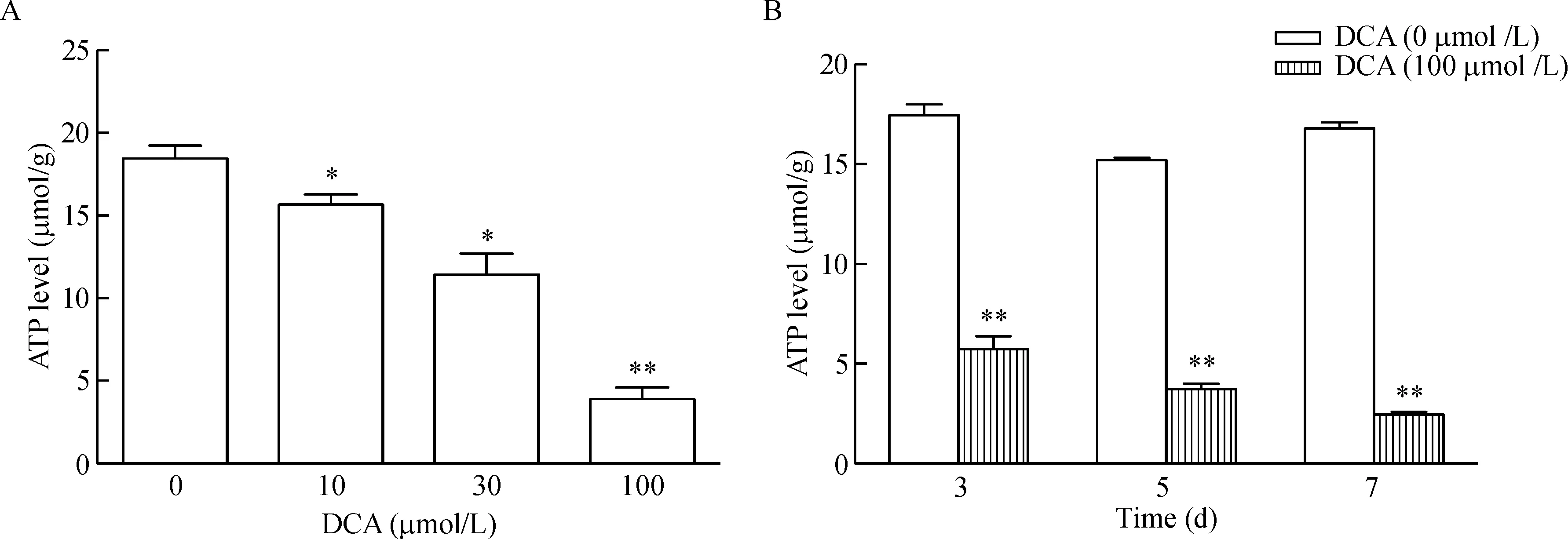
Figure 1.The effect of deoxycholic acid (DCA) on the ATP production in the mitochondria of NCM460 cells. DCA inhibited the ATP production in a dose-dependent manner (A) and a time-dependent manner (B). Mean±SEM.n=3.*P<0.05,**P<0.01vsDCA (0 μmol/L) group.
图1 脱氧胆酸对NCM460细胞线粒体合成ATP的影响
2 DCA干预对NCM460细胞乳酸生成的影响
以不同剂量的DCA处理正常的结肠上皮细胞NCM460,检测细胞乳酸的生成能力。结果显示与对照组相比,DCA能剂量依赖性地促进NCM460细胞生成乳酸,并在DCA浓度为100 μmol/L时,合成乳酸能力最强(P<0.01)。DCA (100 μmol/L)分别处理NCM460细胞3 d、5 d和7 d均能显著增加乳酸的合成,且具有时间依赖性(P<0.01),见图2。
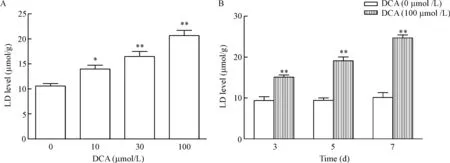
Figure 2.The effect of daeoxycholic acid (DCA) on the lactic acid (LD) production of NCM460 cells. DCA inhibited the LD production in a dose-dependent manner (A) and a time-dependent manner (B). Mean±SEM.n=3.*P<0.05,**P<0.01vsDCA (0 μmol/L) group.
图2 脱氧胆酸对NCM460细胞乳酸生成的影响
3 DCA干预对NCM460细胞SIRT3蛋白表达的影响
与对照组相比,DCA能剂量依赖性地抑制NCM460细胞SIRT3蛋白的表达,且当DCA浓度达100 μmol/L时,SIRT3的蛋白表达水平最低(P<0.01)。DCA(100 μmol/L)分别处理NCM460细胞3 d、5 d和7 d,SIRT3的蛋白表达呈时间依赖性下降,且处理7 d时表达水平最低(P<0.01),见图3。
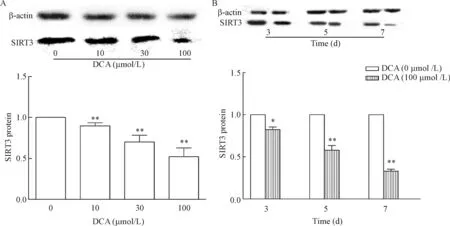
Figure 3.The effect of deoxycholic acid (DCA) on the protein expression of SIRT3 in the NCM460 cells. DCA inhibited the protein expression of SIRT3 in a dose-dependent manner (A) and a time-dependent manner (B). Mean±SEM.n=3.*P<0.05,**P<0.01vsDCA (0 μmol/L) group.
图3 脱氧胆酸对 NCM460细胞中SIRT3蛋白表达的影响
4 白藜芦醇干预对DCA处理后的NCM460细胞能量代谢的影响
为了进一步探讨SIRT3在DCA损伤中的作用,本实验应用sirtuin家族激动剂白藜芦醇进行反证。如图4所示,以DCA(100 μmol/L)处理NCM460细胞至第3天,白藜芦醇(10 μmol/L)继续处理4 d。DCA处理的NCM460经白藜芦醇干预后细胞的乳酸生成显著降低(P<0.01);DCA处理的NCM460细胞经白藜芦醇干预后细胞线粒体的ATP生成显著升高(P<0.01)。
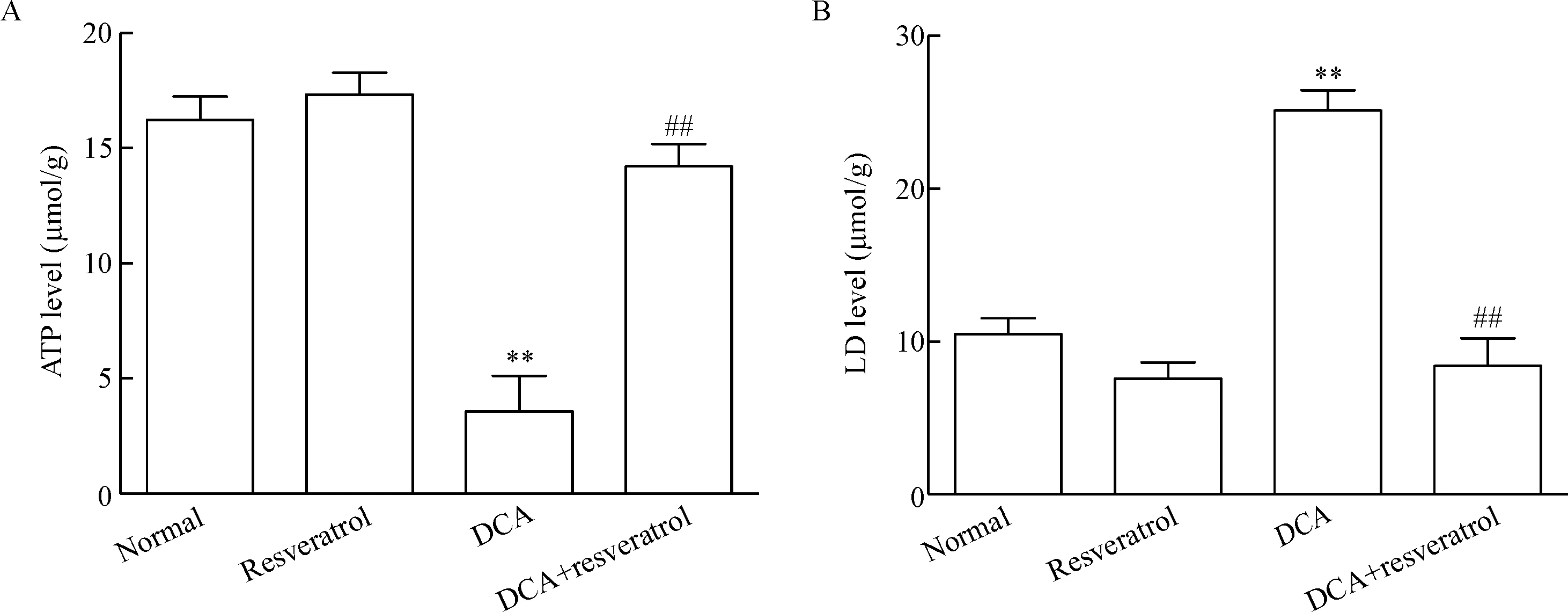
Figure 4.The effect of resveratrol on ATP and lactic acid (LD) production level induced by deoxycholic acid (DCA). Resveratrol (10 μmol/L, 4 d) reversed the effect of DCA on ATP (A) and LD (B) production. Mean±SEM.n=3.**P<0.01vsnormal group;##P<0.01vsDCA (100 μmol/L) group.
图4 白藜芦醇抑制脱氧胆酸对NCM460细胞ATP和乳酸生成的影响
讨 论
肠黏膜屏障由物理屏障和生化屏障两部分构成,前者主要由肠道上皮细胞和侧面的细胞紧密连接等组成,后者主要由各种消化酶、抗菌肽等化学物质及免疫相关组织、细胞等组成,可阻止肠腔内致病菌和毒素等进入血液循环,而肠黏膜屏障功能受损参与多种疾病的发生发展[9-11]。施行胆囊切除的患者或长期进食高脂、高蛋白食物的人群肠腔内次级胆汁酸(DCA和石胆酸)的含量增加[1]。然而,长期暴露于DCA会造成结肠上皮细胞的损伤。研究证实,DCA通过结合磷酸鞘氨醇受体2,促进组织蛋白酶B的释放,可以剂量依赖性地激活NLRP3炎症小体活性,并进一步促进IL-1β的生成从而介导结肠炎的发生[12]。此外,在DCA诱导的结肠损伤细胞中发现,ERK及P38的活性明显提升,且上调ERK的表达可抑制细胞凋亡从而促进局部炎症部位组织增生[13]。能量代谢损伤的产生主要原因之一是线粒体功能障碍[14]。近期研究人员通过增加细胞线粒体的质量,能有效地逆转乳酸生成的增多,增加ATP产生[15]。本研究结果显示DCA能浓度及时间依赖性地抑制结肠上皮细胞线粒体ATP的生成、促进乳酸生成。该结果提示DCA能通过引起结肠上皮细胞线粒体能量障碍而导致结肠损伤。
SIRT3定位于线粒体,其主要功能是催化线粒体应激反应蛋白去乙酰化[7],包括乙酰辅酶A合成酶2[16-17]、谷氨酸脱氢酶[18-19]、NADH脱氢酶[泛]1α-亚复合亚基9等在内的有氧呼吸各阶段关键酶活性均与SIRT3介导的去乙酰化调节有关。线粒体功能异常与其内部多种酶的乙酰化水平增高有关[20]。SIRT3被证实能通过抑制线粒体DNA损伤阻断心肌成纤维细胞分化和肺纤维化[21]。实验首次证实,DCA能浓度和时间依赖性地抑制SIRT3表达;预先给予SIRT3激动剂白藜芦醇能逆转DCA对结肠上皮细胞ATP生成的抑制作用及其增加乳酸生成作用。该结果提示SIRT3表达下调介导了DCA诱导的结肠上皮细胞能量代谢障碍。
综上所述,本研究首次发现DCA对结肠上皮细胞的线粒体能量代谢造成损伤作用,该作用可能与其抑制SIRT3表达下调引起线粒体功能障碍有关。然而,该机制还需进一步确证。
[1] Ignacio Barrasa J, Olmo N, Pérez-Ramos P, et al. Deoxycholic and chenodeoxycholic bile acids induce apoptosis via oxidative stress in human coloadenocarinoma cells[J]. Apoptosis, 2011, 16(10):1054-1067.
[2] Bernstein H, Bernstein C, Payne CM, et al. Bile acids as carcinogens in human gastrointestinal cancers[J]. Mutat Res, 2005, 589(1):47-65.
[3] Benedetti A, Alvaro D, Bassotti C, et al. Cytotoxicity of bile salts against biliary epithelium: a study in isolated bile ductule fragments and isolated perfused rat liver[J]. Hepatology, 1997, 26(1):9-21.
[4] Araki Y, Katoh T, Ogawa A, et al. Bile acid modulates transepithelial permeability via the generation of reactive oxygen species in the Caco-2 cell line[J]. Free Radic Biol Med, 2005,39(6):769-780.
[5] Sola S, Brito MA, Brites D, et al. Membrane structural changes support the involvement of mitochondria in the bile salt-induced apoptosis of rat hepatocytes[J]. Clin Sci (Lond), 2002, 103(5):475-485.
[6] 陶娜娜, 周洪钟, 任吉华, 等. Sirtuin 6对肝癌细胞增殖的影响[J]. 中国病理生理杂志, 2016,32(6): 1031-1036.
[7] Frye RA. Characterization of five human cDNAs with homology to the yeast SIR2 gene:Sir2-like proteins (sirtuins) metabolize NAD and may have protein ADP-ribosyltrasferase activity[J]. Biochem Biophys Res Commun, 1999, 260(1):273-279.
[8] Ahn BH, Kim HS, Song S, et al. A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J]. Proc Natl Acad Sci U S A, 2008, 105(38):14447-14452.
[9] Turner HR. Intestinal mucosal barrier function in health and disease[J]. Nat Rev Immunol, 2009, 9(11):799-809.
[10]Grivennikov SI, Wang K, Mucida D, et al. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth[J]. Nature, 2012, 491(7423):254-258.
[11]董文逍, 曹海龙, 许梦雀, 等. 肠黏膜屏障损伤在脱氧胆酸诱导肠腺瘤癌变过程中的作用研究[J]. 中华肿瘤防治杂志, 2016, 23(14):918-923.
[12]Zhao S, Gong Z, Zhou J, et al. Deoxycholic acid triggers NLRP3 inflammasome activation and aggravates DSS-induced colitis in mice[J]. Front Immunol, 2016, 7:536.
[13]Qiao D, Stratagouleas ED, Martinez JD. Activation and role of mitogen-activated protein kinases in deoxycholic acid-induced apoptosis[J]. Carcinogenesis, 2001, 22(1):35-41.
[14]Upadhyay M, Samal J, Kandpal M, et al. The Warburg effect: insights from the past decade [J]. Pharmacol Ther, 2013, 137(3):318-330.
[15]Liu W, Beck BH, Vaidya KS, et al. Metastasis suppressor KISS1 seems to reverse the Warburg effect by enhancing mitochondrial biogenesis[J]. Cancer Res, 2014, 74(3): 954-963.
[16]Hallows WC, Lee S, Denu JM. Sirtuins deacetylate and activate mammalian acetyl-CoA synthetases[J]. Proc Natl Acad Sci U S A, 2006, 103(27):10230-10235.
[17]Schwer B, Bunkenborg J, Verdin RO, et al. Reversible lysine acetylation controls the activity of the mitochondrial enzyme acetyl-CoA synthetase 2[J]. Proc Natl Acad Sci U S A, 2006, 103(27):10224-10229.
[18]Lombard DB, Alt FW, Cheng HL, et al. Mammalian Sir2 homolog SIRT3 regulates global mitochondrial lysine acetylation[J]. Mol Cell Biol, 2007, 27(24):8807-8814.
[19]Schlicker C, Gertz M, Papatheodorou P, et al. Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5[J]. J Mol Biol, 2008, 382(3):790-801.
[20]Hebert AS, Dittenhafer-Reed KE, Yu W, et al. Calorie restriction and SIRT3 trigger global reprogramming of the mitochondrial protein acetylome[J]. Mol Cell, 2013, 49(1):186-199.
[21]Bindu S, Pillai VB, Kanwal A, et al. SIRT3 blocks myofibroblast differentiation and pulmonary fibrosis by preventing mitochondrial DNA damage[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312(1):L68-L78.
(责任编辑: 陈妙玲, 罗 森)
Role of SIRT3 in dysfunction of energy metabolism induced by deoxycho-lic acid in human colon NCM460 cells
WANG Chuan-jie, ZHOU Yang, ZHANG Meng, ZHOU Ying, XU Jia-qi, ZHU Min-hang, ZHAN Lin, ZHOU Qian-yi, YUAN Qiong
(DepartmentofPharmacology,MedicalCollege,WuhanUniversityofScienceandTechnology,Wuhan430065,China.E-mail:yuanqiong@wust.edu.cn)
AIM: To investigate the effect of deoxycholic acid (DCA) on the energy metabolism in human normal colon epithelial NCM460 cells. METHODS: NCM460 cells was treated with DCA at 10, 30 and 100 μmol/L for 5 d, or DCA at 100 μmol/L for 3, 5 and 7 d. After treated with DCA at 100 μmol/L for 3 d, the cells were treated with resveratrol, the activator of sirtuin 3 (SIRT3), for the next 4 d. Adenosine triphosphate (ATP) production in the mitochondria and lactate acid level were detected. The protein expression of SIRT3 was determined by Western blot. RESULTS: DCA inhibited the ATP production, increased lactate acid level, and downregulated the protein expression of SIRT3 in a dose- and time-dependent manner. Resveratrol at 10 μmol/L reversed the effects of DCA on the NCM460 cells. CONCLUSION: DCA induces the dysfunction of energy metabolism in NCM460 cells, and the mechanism may be related with SIRT3.
Deoxycholic acid; Energy metabolism; Lactate acid; Adenosine triphosphate; Sirtuin 3; Resvertrol
1000- 4718(2017)08- 1494- 05
2016- 10- 31
2017- 05- 22
武汉科技大学大学生科技创新基金(No. 15ZRA167)
R363
A
10.3969/j.issn.1000- 4718.2017.08.024
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 18627005258; E-mail: yuanqiong@wust.edu.cn

