山柰酚通过Wnt/β-catenin信号通路抑制HBx-HepG2细胞增殖、侵袭及迁移*
黄茂莘, 陈 玲, 韩鹏定, 林诗可
(海南省农垦总医院药学部, 海南 海口 570311)
山柰酚通过Wnt/β-catenin信号通路抑制HBx-HepG2细胞增殖、侵袭及迁移*
黄茂莘△, 陈 玲, 韩鹏定, 林诗可
(海南省农垦总医院药学部, 海南 海口 570311)
目的: 探讨山柰酚对HBx-HepG2 细胞增殖、侵袭及迁移的影响,并研究其潜在分子作用机制。方法: 利用实时荧光定量PCR检测相关基因的表达水平,利用蛋白印迹实验检测相关蛋白的水平,流式细胞术检测细胞的凋亡率,MTT实验和平板集落形成实验检测细胞的增殖,Transwell侵袭实验和划痕愈合实验检测细胞的侵袭和转移。结果: 山柰酚(10~200 μmol/L)能够剂量和时间依赖性地抑制HBx-HepG2 细胞的增殖。山柰酚(100 μmol/L)能显著抑制HBx-HepG2细胞的集落形成数量、细胞侵袭能力以及细胞愈合率,诱导HBx-HepG2细胞凋亡,引起cleaved caspase-3、cleaved caspase-9及Bax蛋白水平上升,Bcl-2蛋白水平下降,降低β-catenin、c-Myc 和 cyclin D1 mRNA及蛋白的表达水平。山柰酚(100 μmol/L)同时能够降低p-GSK-3β蛋白水平以及细胞质和细胞核中的β-catenin蛋白水平,对GSK-3β蛋白水平没有影响。 LiCl处理能够反转山柰酚(100 μmol/L)对HBx-HepG2细胞的增殖、侵袭以及迁移抑制作用。结论: 山柰酚对HBx-HepG2 细胞的增殖、侵袭及转移有显著的抑制作用,这种抑制作用很有可能是通过抑制Wnt/β-catenin 信号通路的活性来实现的。
HBx-HepG2细胞; 山柰酚; 细胞增殖; 细胞侵袭; 细胞迁移; Wnt/β-catenin信号通路
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,研究发现慢性乙肝病毒(hepatitis B virus,HBV)感染是肝细胞癌发病的重要原因之一[1]。HBV编码的HBx 蛋白与HCC的发展有着密切的联系[2]。山柰酚(kaempferol)是属于黄酮类的一种化合物,主要来源包括姜科植物山柰及小檗科植物窝儿七的茎和根[3]。现有的研究发现山柰酚可以通过不同分子机制抑制不同种类的肿瘤细胞增殖并且可以诱导肿瘤细胞的凋亡[4],但未有山柰酚对HBx-HepG2细胞影响的报道。本研究首次探讨了山柰酚对HBx-HepG2细胞增殖、侵袭及迁移的影响,并研究其潜在的分子机制。
材 料 和 方 法
1 主要材料
山柰酚购于Sigma;HBx-HepG2细胞购于上海中科院细胞库;胎牛血清和RPMI-1640培养液购自HyClone;各种基因qRT-PCR的引物购自上海吉玛生物科技有限公司;TRIzol试剂购于Invitrogen;细胞核蛋白与细胞浆蛋白抽取试剂盒购于Beyotime;蛋白印迹实验所用的 I 抗和 II 抗均购于Cell Signaling Technology。
2 主要方法
2.1 细胞培养 利用含有10%胎牛血清的RPMI-1640培养液培养HBx-HepG2 细胞,培养条件为5% CO2、37 ℃细胞培养箱内常规培养,消化传代。于6孔板里每孔接种2×105个细胞,利用不含双抗的含有10%胎牛血清的RPMI-1640培养液培养24 h,当细胞融合率达到80%时,将细胞用不同浓度的山柰酚处理,用于后面各项实验。
2.2 实时荧光定量PCR检测山柰酚处理后细胞的不同基因的表达水平 利用山柰酚(100 μmol/L)或正常培养液处理HBx-HepG2 细胞48 h后,用TRIzol溶剂提取mRNA, 提取的mRNA逆转录成cDNA, 采用荧光定量PCR仪器扩增β-catenin、c-myc以及cyclin D1目的片段。这些基因的表达水平以GAPDH为内参照,采用2-ΔΔCt方法计算,每组设3个复孔,实验重复3次。
2.3 MTT法检测HBx-HepG2的细胞活力 利用不同浓度山柰酚(10~200 μmol/L)或正常细胞培养液分别处理HBx-HepG2细胞24 h、48 h 及72 h后,将处理的HBx-HepG2细胞每孔加入20 μL MTT溶液继续孵育4 h后,吸弃孔内培养上清夜,然后于每孔加入150 μL DMSO,利用酶联免疫标记分析仪测量每孔在570 nm波长的吸光度来计算细胞活力。
2.4 平板集落形成实验 (colony formation assay) 利用山柰酚(100 μmol/L)、正常培养液或100 μmol/L山柰酚+1 mmol/L LiCl(Wnt/β-catenin 信号通路的激活剂)处理HBx-HepG2 细胞48 h后,将HBx-HepG2于每孔2 mL接种于6孔培养板,常规培养10 d, 每组设3个复孔,实验重复3次。每隔3 d更换新鲜培养液继续培养,培养10 d 后,弃掉培养液后利用生理盐水洗涤3次,常温空气中干燥后利用75%乙醇固定细胞15 min, 然后利用0.5%结晶紫染色2 h,将染色的细胞在显微镜下观察拍照,计算形成的集落数量。
2.5 Transwell侵袭实验 将Matrigel 按每孔40 μL 均匀铺在 Transwell 小室膜上。将用山柰酚(100 μmol/L)、正常培养液或山柰酚(100 μmol/L)+ LiCl(1 mmol/L)处理48 h后的HBx-HepG2 细胞用无血清RPMI-1640培养基重悬,吸取100 μL悬液加到小室的上层,下层加入500 μL含有10%胎牛血清的RPMI-1640培养液,5% CO2、37 ℃细胞培养箱内常规培养24 h后,将不铺胶的小室取出,利用PBS洗涤3次后再利用4%的多聚甲醛固定20 min, 然后利用结晶紫染色30 min,揭下Transwell小室膜反贴在载玻片上。在显微镜下计数每膜上下左右中5个随机不同视野的穿膜细胞数,每组设3个孔,实验重复3次。
2.6 划痕愈合实验 利用山柰酚(100 μmol/L)、正常培养液或山柰酚(100 μmol/L)+LiCl(1 mmol/L)处理HBx-HepG2 细胞48 h后,将细胞接种于6孔板中,24 h常规培养后吸弃培养基,用PBS洗涤3次,用20 μL 枪头在每孔细胞中均匀划3条横线(每隔1 cm划1条),横穿过孔。然后在含有10%胎牛血清的RPMI-1640培养液,5% CO2、37 ℃细胞培养箱内常规培养48 h 分别进行显微镜观察和拍照,计算融合率。划痕融合率(%)=(Area0 h-Area48 h)/Area0 h×100%, Area 表示未愈合面积。
2.7 流式细胞术检测细胞凋亡 利用山柰酚(100 μmol/L)或者正常培养液处理HBx-HepG2 细胞48 h后,将细胞利用PBS洗涤3次,然后加入70%冷乙醇固定后收集细胞,将收集的细胞利用PBS洗涤去除固定液,然后加入RNA酶,反应过夜,再利用Annexin V-FITC/PI 对细胞进行双染色,然后利用流式细胞仪对细胞凋亡率进行分析。
2.8 蛋白印迹实验 利用山柰酚(100 μmol/L)或者正常培养液处理HBx-HepG2 细胞48 h后,利用含有蛋白酶抑制剂的RIPA缓冲液裂解细胞提取蛋白,用细胞核蛋白与细胞浆蛋白抽提试剂盒分离细胞核和细胞浆蛋白。取25 μg等量蛋白上样,利用10% SDS-PAGE,将电泳后的蛋白转移至醋酸纤维素膜,用含有5%脱脂奶粉的TBST溶液于室温封闭1 h,然后用TBST 洗涤5 min,洗涤3次。然后将醋酸纤维素膜分别与不同的 I 抗(抗cleaved caspase-3、cleaved caspase-9、Bcl-2、Bax、β-catenin、c-Myc、cyclin D1、p-GSK-3β、GSK-3β、α-tubulin、lamin A及β-actin抗体)4 ℃孵育过夜。将I抗孵育后的抗体利用TBST洗涤3次,再跟辣根过氧化物酶标记的II抗于室温孵育1 h。醋酸纤维素膜进行曝光显影,利用凝胶成像仪器对各显色条带的灰度值进行测量,以β-actin为内参照计算各个目的蛋白的相对表达水平。
3 统计学处理
采用GraphPad Prism 6.0软件进行数据分析。所有数据以均数±标准差(mean±SD)表示,组与组之间的比较采用Studentt检验分析。以P<0.05为差异有统计学显著性。
结 果
1 山柰酚对HBx-HepG2 细胞活力的影响
用不同浓度的山柰酚分别处理HBx-HepG2 细胞24 h、48 h 及72 h,然后利用MTT实验检测了HBx-HepG2细胞的活力。MTT结果显示山柰酚可抑制HBx-HepG2细胞活力,并呈剂量依赖性及时间依赖性,24 h、48 h及72 h处理后的IC50分别为101.8 μmol/L、98.3 μmol/L和73.5 μmol/L,见图1。
2 山柰酚对HBx-HepG2细胞生长、侵袭及迁移的影响
山柰酚(100 μmol/L)处理HBx-HepG2 细胞48 h后,分别利用集落形成实验、细胞侵袭实验及愈合实验检测HBx-HepG2细胞的生长、侵袭及迁移。集落形成实验结果显示,与对照组相比,山柰酚处理HBx-HepG2 细胞48 h 后能够显著抑制集落形成的数量(P<0.01);细胞侵袭实验结果显示,山柰酚处理HBx-HepG2 细胞48 h后能够减少侵袭细胞的数量,与对照组相比差异有统计学显著性(P<0.05);细胞愈合实验结果显示山柰酚处理HBx-HepG2 细胞48 h后能够降低愈合率,并且与对照组相比差异有统计学显著性(P<0.05),见图2。
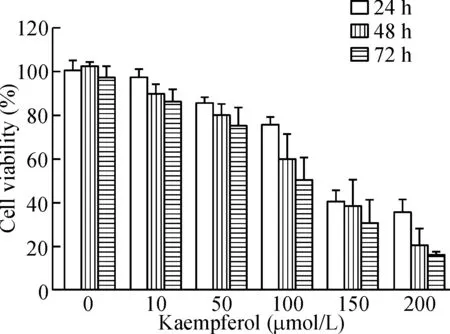
Figure 1.The effect of kaempferol on the viability of the HBx-HepG2 cells. The viability of the HBx-HepG2 cells treated with kaempferol (10~200 μmol/L) for 24 h, 48 h and 72 h was measured by MTT assay. Mean±SD.n=3.
图1 山柰酚对HBx-HepG2 细胞活力的影响

Figure 2.The effect of kaempferol on the growth, invasion and migration of HBx-HepG2 cells. A: the growth of HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was measured by colony formation assay; B: the invasion ability of HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was measured by Transwell invasion assay; C: the migration ability of HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was measured by wound healing assay. Mean±SD.n=3.*P<0.05,**P<0.01vskaempferol (0 μmol/L) group.
图2 山柰酚对HBx-HepG2 细胞生长、侵袭及迁移的影响
3 山柰酚对HBx-HepG2细胞凋亡的影响
用山柰酚(100 μmol/L)处理HBx-HepG2 细胞48 h后,用流式细胞术检测HBx-HepG2细胞的凋亡率。与对照组相比,山柰酚处理HBx-HepG2 细胞48 h 后能显著增加细胞的凋亡率(P<0.05)。进一步的蛋白印迹实验检测了凋亡通路相关蛋白,包括cleaved caspase-3、cleaved caspase-9、Bcl-2及Bax,与对照组相比,山柰酚处理HBx-HepG2 细胞48 h后能够显著增加cleaved caspase-3、cleaved caspase-9和Bax蛋白的水平,同时降低Bcl-2蛋白的表达水平 (P<0.05),见图3。
Figure 3.The effect of kaempferol on the apoptosis of the HBx-HepG2 cells. A: the apoptosis of HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was analyzed by flow cytometry; B: the expression levels of apoptosis-related proteins, cleaved caspase-3, cleaved caspase-9, Bcl-2 and Bax, in the HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was measured by Western blot. Mean±SD.n=3.*P<0.05vskaempferol (0 μmol/L) group.
图3 山柰酚对HBx-HepG2细胞凋亡的影响
4 山柰酚对HBx-HepG2细胞Wnt/β-catenin信号通路的影响
用山柰酚(100 μmol/L)处理HBx-HepG2 细胞48 h后,RT-qPCR 和蛋白印迹实验分别检测Wnt/β-catenin信号通路相关基因的mRNA及蛋白表达水平。与对照组相比,山柰酚处理HBx-HepG2 细胞48 h后能够显著降低β-catenin、c-Myc 和 cyclin D1 mRNA及蛋白的表达水平(P<0.05),进一步的实验发现山柰酚处理HBx-HepG2 细胞48 h后能够显著降低p-GSK-3β的蛋白水平 (P<0.05),对GSK-3β的蛋白水平没有影响。山柰酚能够降低细胞质中β-catenin蛋白水平,同时对细胞核中的β-catenin蛋白水平的降低更为明显,见图4。
5 山柰酚对LiCl处理的HBx-HepG2细胞生长、侵袭以及迁移的影响
用山柰酚(100 μmol/L)或山柰酚(100 μmol/L)+ LiCl(1 mmol/L)处理HBx-HepG2 细胞48 h后, 分别利用集落形成实验、细胞侵袭实验及愈合实验检测HBx-HepG2细胞的生长、侵袭及迁移。100 μmol/L山柰酚+1 mmol/L LiCl处理HBx-HepG2 细胞48 h后能够显著促进细胞的生长、侵袭及迁移,与100 μmol/L山柰酚组相比差异有统计学显著性(P<0.05),见图5。
讨 论
肝癌是中国最常见的肿瘤之一,研究发现HBx基因是HBV基因组中最小的开放读码框,其所编码的HBx蛋白在肝细胞的恶性转化以及癌变起着重要的作用[2]。HBx蛋白可以作为一种反式激活因子激活多种信号通路,这些信用通路包括MAPK、PI3K-Akt、Ras、Notch/Jagged和Src等,从而影响细胞周期、细胞凋亡以及细胞增殖等[5]。
最近的研究发现山柰酚在不同类型的肿瘤细胞中通过不同的机制抑制细胞的增殖。山柰酚可以通过抑制上皮间质转化从而抑制乳腺癌细胞的迁移[6]。Lee等[7]发现山柰酚可以通过阻断EGFR相关的信号通路来抑制胰腺癌细胞的增殖和迁移。Cho等[8]研究发现山柰酚通过引起G1和G2/M 细胞周期阻滞,从而抑制大肠癌细胞增殖。本研究发现山柰酚能够抑制HBx-HepG2 细胞的增殖、侵袭以及迁移。进一步的流式细胞实验发现山柰酚能够诱导细胞凋亡,而诱导细胞凋亡的机制可能是通过增加cleaved caspase-3、cleaved caspase-9和Bax蛋白水平,同时降低Bcl-2蛋白表水平诱导细胞凋亡。这些结果提示山柰酚很有可能通过诱导细胞凋亡从而抑制HBx-HepG2细胞的增殖。本研究的结果与Song等[9]的研究结果一致,该研究发现山柰酚可以通过增加cleaved caspase-3、cleaved caspase-9、Bax 蛋白水平同时降低Bcl-2蛋白水平来诱导胃癌细胞凋亡,并且山柰酚可以导致胃癌细胞在G2/M期阻滞,从而影响细胞的增殖。本研究将来可能也有必要去进一步探讨山柰酚对HBx-HepG2 细胞周期的影响,从而进一步确定其中潜在的机制。

Figure 4.The effect of kaempferol on Wnt/β-catenin signaling pathway in the HBx-HepG2 cells. A: the mRNA expression levels of β-catenin, c-Myc and cyclin D1 in the HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was detected by RT-qPCR; B: the protein expression levels of β-catenin, c-Myc and cyclin D1 in HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was determined by Western blot; C: the protein expression levels of p-GSK-3β and GSK-3β in HBx-HepG2 cells after kaempferol (100 μmol/L) or vehicle treatment for 48 h was measured by Western blot; D: the protein expression levels of β-catenin in the cytoplasm and nucleus in HBx-HepG2 cells after kaempfe-rol (100 μmol/L) or vehicle treatment for 48 h was measured by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vskaempferol (0 μmol/L) group.
图4 山柰酚对HBx-HepG2细胞Wnt/β-catenin信号通路的影响

Figure 5.The effect of kaempferol on the growth, invasion and migration of LiCl-treated HBx-HepG2 cells. A: the colony formation ability of the HBx-HepG2 cells treated with kaempferol or kaempferol+LiCl for 48 h was measured by colony formation assay; B: the cell invasion ability of the HBx-HepG2 cells treated with kaempferol or kaempferol+LiCl for 48 h was measured by Transwell invasion assay; C: the cell migration ability of the HBx-HepG2 cells treated with kaempferol or kaempferol+LiCl for 48 h was measured by wound healing assay. a: kaempferol (100 μmol/L); b: kaempferol (100 μmol/L)+LiCl (1 mmol/L). Mean±SD.n=3.*P<0.05vsa group.
图5 山柰酚对LiCl处理的HBx-HepG2细胞生长、侵袭及迁移的影响
Wnt信号途径由Wnt蛋白、受体以及调节蛋白等组成了复杂的信号通路, 调节细胞的分化、增殖、迁移以及哺乳动物生殖系统发育的多个重要环节[10-12]。近年来发现很多肿瘤的发生与Wnt信号的异常相关[13-14],在HCC的发生发展中也不乏Wnt信号通路异常的报道[15]。最近的研究发现HBx 蛋白对于肝癌细胞Wnt/β-catenin信号通路的激活起到关键的作用[16]。Chen等[17]研究发现HBx蛋白能够促进Wnt/β-catenin 信号通路从而增加肝癌细胞的迁移。本研究首次发现山柰酚能够抑制β-catenin、c-myc 和 cyclin D1的mRNA以及蛋白的水平。同时发现山柰酚能够抑制p-GSK-3β 的蛋白水平,而山柰酚对于Wnt/β-catenin信号通路的抑制可能是通过抑制β-catenin从细胞质向细胞核转移。进一步的实验发现Wnt/β-catenin 信号通路的激活剂LiCl可以阻断山柰酚对HBx-HepG2细胞的增殖、侵袭以及转移抑制作用。这些结果提示山柰酚很有可能是通过抑制Wnt/β-catenin 信号通路活性来抑制HBx-HepG2细胞的增殖、侵袭以及转移。
本研究发现山柰酚对HBx-HepG2 细胞的增殖、侵袭以及迁移有显著性的抑制作用,这种抑制作用很有可能是通过抑制Wnt/β-catenin 信号通路的活性来实现的。本研究的不足之处在于缺少相应的体内动物实验来进一步确定山柰酚对HBx-HepG2的抑制作用。
[1] Bozza C, Cinausero M, Iacono D, et al. Hepatitis B and cancer: a practical guide for the oncologist[J]. Crit Rev Oncol Hematol, 2016, 98: 137-146.
[2] Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma[J]. J Hepatol, 2016, 64(1 Suppl): S84-S101.
[3] Devi KP, Malar DS, Nabavi SF, et al. Kaempferol and inflammation: from chemistry to medicine[J]. Pharmacol Res, 2015, 99:1-10.
[4] Kim SH, Choi KC. Anti-cancer effect and underlying mechanism(s) of kaempferol, a phytoestrogen, on the regulation of apoptosis in diverse cancer cell models[J]. Toxicol Res, 2013, 29 (4):229-234.
[5] Geng M, Xin X, Bi LQ, et al. Molecular mechanism of hepatitis B virus X protein function in hepatocarcinogenesis[J]. World J Gastroenterol, 2015, 21(38):10732-10738.
[6] Lee GA, Choi KC, Hwang KA. Kaempferol, a phytoestrogen, suppressed triclosan-induced epithelial-mesenchymal transition and metastatic-related behaviors of MCF-7 breast cancer cells[J]. Environ Toxicol Pharmacol, 2016, 49:48-57.
[7] Lee J, Kim JH. Kaempferol inhibits pancreatic cancer cell growth and migration through the blockade of EGFR-rela-ted pathwayinvitro[J]. PLoS One, 2016, 11(5): e0155264.
[8] Cho HJ, Park JH. Kaempferol induces cell cycle arrest in HT-29 human colon cancer cells[J]. J Cancer Prev, 2013, 18(3):257-263.
[9] Song H, Bao J, Wei Y, et al. Kaempferol inhibits gastric cancer tumor growth: aninvitroandinvivostudy[J]. Oncol Rep, 2015, 33(2):868-874.
[10]Dickinson ME, McMahon AP. The role of Wnt genes in vertebrate development[J]. Curr Opin Genet Dev, 1992, 2(4):562-566.
[11]McMahon AP, Gavin BJ, Parr B, et al. The Wnt family of cell signalling molecules in postimplantation development of the mouse[J]. Ciba Found Symp, 1992, 165:199-212; discussion 212-198.
[12]Visweswaran M, Pohl S, Arfuso F, et al. Multi-lineage differentiation of mesenchymal stem cells: to Wnt, or not Wnt[J]. Int J Biochem Cell Biol, 2015, 68:139-147.
[13]Shimizu T, Nakagawa K. Novel signal transduction pathways: the molecular basis for targeted cancer therapies in Hedgehog/Notch/Wnt pathway[J]. Nihon Rinsho, 2015, 73(8):1342-1348.
[14]Tai D, Wells K, Arcaroli J, et al. Targeting the WNT signaling pathway in cancer therapeutics[J]. Oncologist, 2015, 20(10):1189-1198.
[15]Yoshida N, Kinugasa T, Ohshima K, et al. Analysis of Wnt and β-catenin expression in advanced colorectal can-cer[J]. Anticancer Res, 2015, 35(8):4403-4410.
[16]Cha MY, Kim CM, Park YM, et al. Hepatitis B virus X protein is essential for the activation of Wnt/β-catenin signaling in hepatoma cells[J]. Hepatology, 2004, 39(6): 1683-1693.
[17]Chen Z, Tang J, Cai X, et al. HBx mutations promote hepatoma cell migration through the Wnt/β-catenin signaling pathway[J]. Cancer Sci, 2016, 107(10):1380-1389.
(责任编辑: 卢 萍, 罗 森)
Kaempferol inhibits cell proliferation, invasion and migration via Wnt/β-catenin signaling in HBx-HepG2 cells
HUANG Mao-xin, CHEN Ling, HAN Peng-ding, LIN Shi-ke
(DepartmentofPharmacy,HainanNongkenHospital,Haikou570311,China.E-mail:huang_maoxin@126.com)
AIM: To explore the effects of kaempferol on the proliferation, invasion and migration abilities of HBx-HepG2 cells and to examine the underlying molecular mechanisms. METHODS: The expression levels of related genes at mRNA and protein levels were determined by RT-qPCR and Western blot. The cell apoptotic rate was analyzed by flow cytometry. The cell proliferation, growth, invasion and migration abilities were measured by MTT assay, colony formation assay, Transwell invasion assay and wound healing assay, respectively. RESULTS: Kaemferol inhibited HBx-HepG2 cell proliferation in a concentration- and time-dependent manner. Kaempferol at 100 μmol/L significantly inhibited the colony formation, invasion and migration abilities of the HBx-HepG2 cells. Kaemferol at 100 μmol/L also increased cell apoptotic rate, increased the protein levels of cleaved caspase-3, cleaved caspase-9 and Bax, and decreased the expression level of Bcl-2. In addition, kaemferol at 100 μmol/L suppressed the mRNA and protein expression levels of β-catenin, c-Myc and cyclin D1 in the HBx-HepG2 cells. Kaemferol at 100 μmol/L also suppressed the protein level of p-GSK-3β and the β-catenin protein levels in both cytoplasm and nucleus. LiCl treatment reversed the inhibitory effect of kaempferol on the growth, invasion and migration of the HBx-HepG2 cells. CONCLUSION: Kaempferol inhibits cell proliferation, invasion and migration via activating Wnt/β-catenin signaling in HBx-HepG2 cells.
HBx-HepG2 cells; Kaempferol; Cell proliferation; Cell invasion; Cell migration; Wnt/β-catenin signaling pathway
1000- 4718(2017)08- 1417- 06
2016- 12- 14
2017- 04- 12
海南省卫计委普通医学科研(No. 14A210221)
R735.7; R965
A
10.3969/j.issn.1000- 4718.2017.08.012
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0898-66808275; E-mail: huang_maoxin@126.com

