植物甾醇酯对大鼠主动脉衰老及相关基因表达的影响*
丁程程, 李文芳, 周 锦, 冉 钶, 吴晓青, 荣 爽
(武汉科技大学医学院公共卫生学院, 武汉科技大学营养与慢性病防治研究所, 湖北 武汉 430065)
植物甾醇酯对大鼠主动脉衰老及相关基因表达的影响*
丁程程, 李文芳, 周 锦, 冉 钶, 吴晓青, 荣 爽△
(武汉科技大学医学院公共卫生学院, 武汉科技大学营养与慢性病防治研究所, 湖北 武汉 430065)
目的: 探讨植物甾醇酯延缓大鼠主动脉衰老的作用及其机制。方法: 将42只12月龄雌性SD大鼠随机均分为对照组、模型组和植物甾醇酯干预组,分别喂食基础饲料、高脂饲料和高脂加2% 植物甾醇酯(W/W)饲料6个月。采用HE染色法和Masson染色法对主动脉横截面石蜡切片进行染色,观察主动脉组织的病理学改变,对血管壁平滑肌细胞和胶原纤维的绝对面积进行图像分析。检测血浆脂质蛋白、晚期糖基化终末产物(AGEs)、丙二醛(MDA)的含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性。分别采用real-time PCR和Western blot的方法评估主动脉组织沉默信息调节因子1(SIRT1)和过氧化物酶体增殖物激活受体γ(PPARγ)的mRNA和蛋白表达水平。结果: 与模型组相比,植物甾醇酯干预组的血浆总胆固醇和低密度脂蛋白胆固醇水平显著降低,高密度脂蛋白胆固醇的水平相反(P<0.05),甘油三酯的水平没有统计学差异;主动脉内膜和中膜的增厚以及平滑肌细胞的迁移均得到改善;主动脉平滑肌细胞和胶原纤维的含量显著下降(P<0.05);血浆AGEs的含量显著降低(P<0.05);机体的抗氧化功能有所提升,血浆MDA的含量显著减少(P<0.05),SOD和CAT活性的差异没有统计学意义;PPARγ的表达下调,SIRT1的表达上调(P<0.05)。结论: 植物甾醇酯能够延缓大鼠主动脉的衰老。其机制可能与降低机体活性氧的生成有关。植物甾醇酯可能通过激活SIRT1或抑制PPARγ的表达而发挥作用。
植物甾醇酯; 主动脉衰老; 沉默信息调节因子1; 过氧化物酶体增殖物激活受体γ
随着全球老龄化社会的不断发展,老龄化问题日趋严重,年龄的增长将成为血管疾病的首位危险因素[1]。随着年龄的增长,血管的结构和功能发生特征性改变。植物甾醇(plant sterol,PS)是一类以环戊烷全氢菲(甾核)为骨架的天然醇类化合物,存在于植物油及其脱臭馏出物中。植物甾醇酯(phytosterol ester,PSE)是PS和脂肪酸发生酯化反应生成的产物。PS的生物活性多样,包括抗氧化、抗炎、降脂和抗癌等活性,其中降脂作用已得到许多实验和临床研究证实。从PS的生物学活性上,我们有理由相信PSE具有延缓血管衰老的可能。
在血管老化相关的研究中,活性氧学说是公认的学说。当活性氧水平过高时,机体将生成一些终末产物,如晚期糖基化终末产物(advanced glycosylation end products,AGEs)和脂质过氧化终产物,引起细胞功能失调进而导致衰老的发展[2-3]。另外,衰老相关基因在血管衰老的发生和发展中有着至关重要的作用。例如,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)已被认为是延缓内皮细胞衰老的重要作用靶点之一[4-5]。沉默信息调节因子1(silent information regulator 1, SIRT1)被认为具有抑制PPARγ的作用[6],其抑制作用是通过结合PPARγ上的辅因子核受体,阻遏PPARγ结合到目标基因而实现的。另外,SIRT1能够通过抑制NADPH氧化酶的激活,保护血管内皮功能[6],具有调控血管新生过程中内皮生成的作用[7]。调节机体抗氧化水平或衰老相关基因的表达可能是PSE减缓血管衰老的机制。
细胞实验证明氧化型胆固醇能够诱导内皮细胞凋亡[8],而氧化型胆固醇的其中一个来源是高脂膳食。另有研究表明,高脂饮食能够引起大鼠动脉血管内皮细胞衰老增加,促进血管衰老[9]。
因此,本研究给予大鼠高脂膳食,加速主动脉的衰老,并用含PSE的膳食进行干预,探索PSE是否具有改善大鼠主动脉衰老的作用,从抗氧化及相关基因的表达方面探索其作用机制。
材 料 和 方 法
1 动物
健康清洁级Sprague-Dawley (SD)大鼠,12月龄,体重300~400 g,由湖北省疾病预防控制中心提供,动物合格证号为42000600002422。
2 主要试剂
植物甾醇酯由BASF提供;AGEs ELISA试剂盒购自Bio-Swamp;考马斯亮蓝蛋白定量测试盒、超氧化物歧化酶(superoxide dismutase, SOD)测试盒、丙二醛(malondialdehyde, MDA)测试盒和过氧化氢酶(catalase, CAT)测试盒购自南京建成生物工程研究所;无酶水购自TaKaRa;组织裂解液和cDNA合成试剂盒购自Thermo Fisher Scientific;所有引物购自武汉天一辉远生物科技有限公司;BCA蛋白定量试剂盒购自碧云天生物技术研究所;抗β-actin单克隆抗体、抗PPAR-γ单克隆抗体和II抗购自Santa Cruz;抗SIRT1单克隆抗体购自Abcam;Super Signal West Durao发光液和Super Signal West Pico发光液购自GE;聚乙二烯二氟化物膜购自Millipore;Epoch酶标仪购自BioTek;CFX Manager real-time PCR仪和凝胶成像分析系统购自Bio-Rad。
3 主要方法
3.1 动物分组及取材 60只大鼠(每笼5只)在温度为(24±1)℃、相对湿度为(55±10)%、昼夜交替(08∶00~20∶00)的环境下,自由进食进水,适应性饲养3 d。筛选实验动物,剔除患有慢性呼吸性疾病和肿瘤的动物。将剩余的42只大鼠随机均分为3组,分别为对照(control)组、模型(model)组和PSE干预组(PSE组)。各组饲料配方如下:(1) 对照组:基础饲料;(2) 模型组:5%蛋黄粉、10%猪油、2%胆固醇、0.3%胆盐、0.2%丙基硫氧嘧啶和82.5%基础饲料;(3) PSE干预组:2% PSE和98%高脂饲料。喂养24周后,禁食12 h,采血并离心取血浆,-80 ℃冷冻保存。每组随机选取4只大鼠用4%多聚甲醛进行心脏灌注,轻柔地分离主动脉,并浸泡于4%多聚甲醛溶液中固定。剩余大鼠快速分离主动脉,-80 ℃冷冻保存。
3.2 血浆脂质水平的检测 严格按照试剂盒的说明书检测血浆中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的水平。
3.3 主动脉形态学的观察 将固定的主动脉常规脱水、透明、浸蜡、包埋,连续切片,制成厚约5 μm的切片。(1) HE染色:将切片脱蜡水化,Harris 苏木素染色,1%盐酸乙醇分化,返蓝后,用乙醇伊红染色,脱水,透明,中性树胶封片,最后在显微镜下观察各组大鼠血管组织形态的差异。(2) Masson 染色:将切片脱蜡水化,用地衣红染色,Weigert 铁苏木精染核,磷钼酸水溶液分化,亮绿染色后,脱水,透明,树胶封固,显微镜下观察。采用Image-Pro Plus 7.0图像分析软件测量血管壁中膜平滑肌细胞(smooth muscle cells,SMC)和胶原纤维(collagen fibers,CF)的绝对面积,计算不同着色面积与测试区域整体面积之比(Aa%),反映SMC和CF在各血管壁中的相对含量。
3.4 血浆AGEs含量的测定 严格按照AGEs ELISA试剂盒的说明书进行操作,测量血浆中AGEs的含量。在酶标包被板上加入样品,再加生物素标记的抗AGEs抗体,温育,洗涤,加入酶试剂,温育,洗涤,加入显色剂,最后加入终止液,在450 nm波长处检测吸光度(A)。AGEs的浓度通过标准曲线计算,单位用μg/L表示。
3.5 血浆SOD、CAT的活性及MDA的含量检测 按照说明书的步骤,完成对血浆SOD、CAT活性以及MDA含量的检测。
3.6 Real-time PCR实验 以β-actin作为内参照,检测主动脉PPARγ和SIRT1 mRNA的表达水平。用Trizol提取和分离血管组织的总mRNA,以高容量cDNA逆转录试剂盒将RNA转化为cDNA。加入引物(详细序列见表1)和Taq聚合酶,用Bio-Rad CFX Manager real-time PCR仪进行定量分析。
3.7 Western blot实验 称取约100 mg血管组织(按组织∶裂解液=1∶4)加入400 μL裂解液,充分匀浆,直到无法看到明显的组织块。冰浴25 min后,收集裂解液。4 ℃下14 000 r/min离心10 min,取上清,采用BCA法测定上清总蛋白的含量。蛋白质在12%的聚丙烯酰胺凝胶电泳上分离,用半干转移法将蛋白转移到聚乙二烯二氟化物膜中。将膜放入有Tween-20 的5%脱脂牛奶TBST中封闭1 h,然后放入包含抗PPARγ或SIRT1抗体的 TBST中孵育1 h,再放入稀释的II抗中孵1 h。制备Super Signal West Durao和Super Signal West Pico(1∶1)混合发光液,加在膜上,反应30 s后,用凝胶成像分析系统对条带进行成像和分析。
4 统计学处理
用SPSS 17.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 PSE对血浆脂质水平的影响
实验结束时,模型组大鼠血浆的TC和LDL-C水平显著高于对照组,差异有统计学意义(P<0.05);与模型组大鼠相比,PSE干预能够显著降低血浆的TC和LDL-C水平,差异有统计学意义(P<0.05);此外,与对照组相比,模型组血浆的HDL-C水平显著降低(P<0.05),而给予PSE干预后血浆的HDL-C水平显著升高(P<0.05),且升高至与对照组的HDL-C水平相近的水平。血浆的TG水平3组大鼠之间的差异没有统计学显著性,见表2。
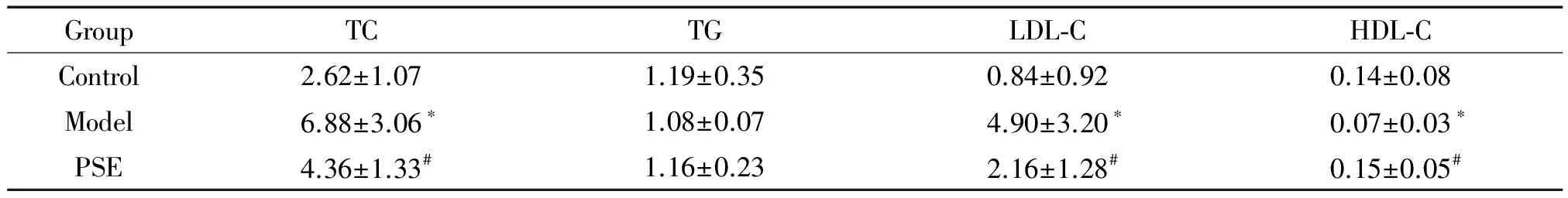
表2 PSE对血浆TC、TG、LDL-C和HDL-C水平的影响
*P<0.05vscontrol;#P<0.05vsmodel.
2 PSE对大鼠主动脉形态学的影响
2.1 PSE对主动脉的结构的影响 由图1可见,对照组大鼠主动脉结构完整,内膜薄,中膜的平滑肌细胞排列整齐。模型组大鼠主动脉内膜增厚,并可见隆起,内膜下间隙变宽,出现泡沫细胞;中膜增厚,平滑肌细胞排列紊乱,部分迁移至内膜。PSE干预大鼠的主动脉结构基本完整,内膜较薄,可观察到部分隆起;中膜未见明显增厚,平滑肌细胞排列整齐,较少发生迁移。
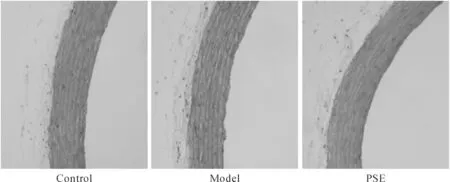
Figure 1.The effect of PSE on the morphological changes of aorta in high-fat diet-fed rats (HE staining, ×400).
图1 PSE对衰老大鼠主动脉结构的影响
2.2 PSE对衰老主动脉SMC及CF的影响 主动脉组织进行Masson染色后,SMC呈红色,CF呈绿色,结果见图2。与对照组相比,模型组的SMC绿染区域增加;与模型组相比较,PSE干预组的绿染区域减少。图像分析结果显示,与对照组相比,模型组大鼠的主动脉SMC和CF的含量均显著增加,PSE的摄入显著减少了SMC和CF的含量,差异均具有统计学意义(P<0.05);比较对照组和PSE干预组之间的差异没有统计学显著性。
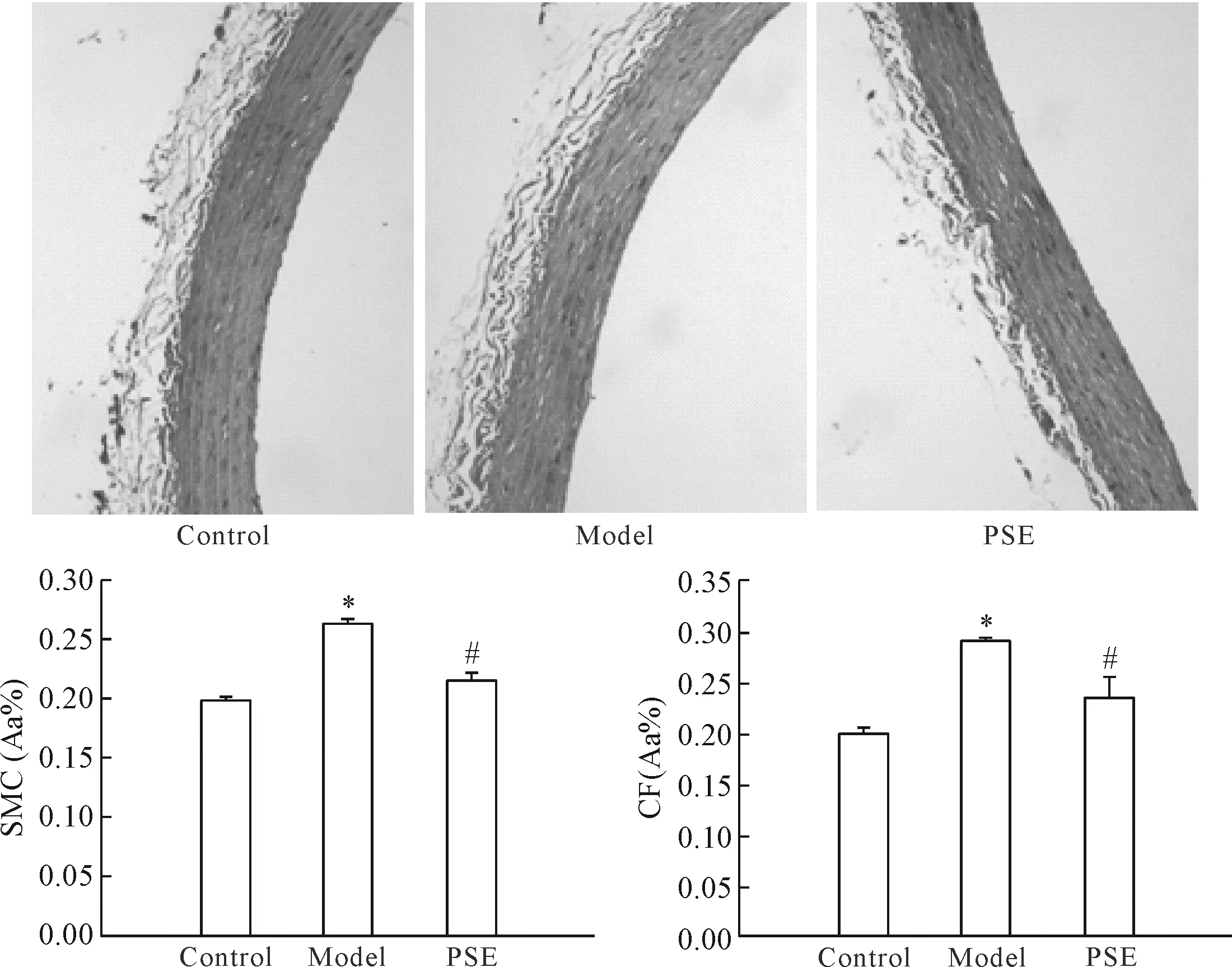
Figure 2.The effect of PSE on the SMC and CF contents of aorta in high-fat diet-fed rats (Masson staining, ×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图2 PSE对衰老大鼠主动脉平滑肌细胞和胶原纤维的影响
3 PSE对血浆AGEs含量的影响
与对照组相比,模型组大鼠血浆的AGEs含量增多,差异具有统计学意义(P<0.05);与模型组相比,PSE干预呈现出降低血浆AGEs的作用,且差异具有统计学意义(P<0.05);PSE干预组与对照组之间的差异无统计学显著性,见表3。
4 PSE对血浆SOD、CAT活性及MDA含量的影响
由表3可知,在血浆SOD的活性方面,PSE干预组大鼠和模型组大鼠与对照组相比下降均不明显,PSE干预组大鼠高于模型组,差异具有统计学显著性;在血浆CAT的活性方面,3组大鼠之间的差异均没有统计学显著性(P>0.05);在血浆MDA的含量方面,模型组大鼠与对照组相比含量增加,PSE干预组大鼠与模型组相比含量减少,差异均具有统计学显著性(P<0.05),PSE干预组大鼠与对照组之间的差异没有统计学显著性。
表3 PSE对AGEs、MDA含量和SOD、CAT活性的影响
Table 3.The effect of PSE on the contents of AGEs and MDA and the activity of SOD and CAT in the plasma of high-fat diet-induced aging rats (Mean±SD.n=6)

GroupAGEs(mmol/L)SOD(×103U/L)CAT(×103U/L)MDA(μmol/g)Control170.61±55.3912.34±3.450.80±0.556.95±0.68Model252.60±42.26∗10.08±2.831.37±0.49∗8.24±0.96∗PSE182.41±34.74#15.13±3.95#0.44±0.27#6.84±1.36#
*P<0.05vscontrol;#P<0.05vsmodel.
5 PSE对主动脉PPARγ和SIRT1 mRNA及蛋白表达的影响
各组大鼠主动脉组织PPARγ和SIRT1的mRNA及蛋白表达水平见图3。与对照组相比,模型组大鼠主动脉组织的PPARγ的mRNA和蛋白表达水平显著增加(P<0.05);与模型组相比,PSE的摄入降低了主动脉组织PPARγ的mRNA和蛋白表达水平(P<0.05);PSE干预组与对照组相比PPARγ的mRNA和蛋白表达水平的差异均没有统计学显著性。模型组大鼠SIRT1的mRNA和蛋白表达水平显著低于对照组(P<0.05);PSE干预组大鼠SIRT1的mRNA的表达水平与模型组相比差异没有统计学显著性,但在蛋白的表达上PSE干预组显著高于模型组(P<0.05)。
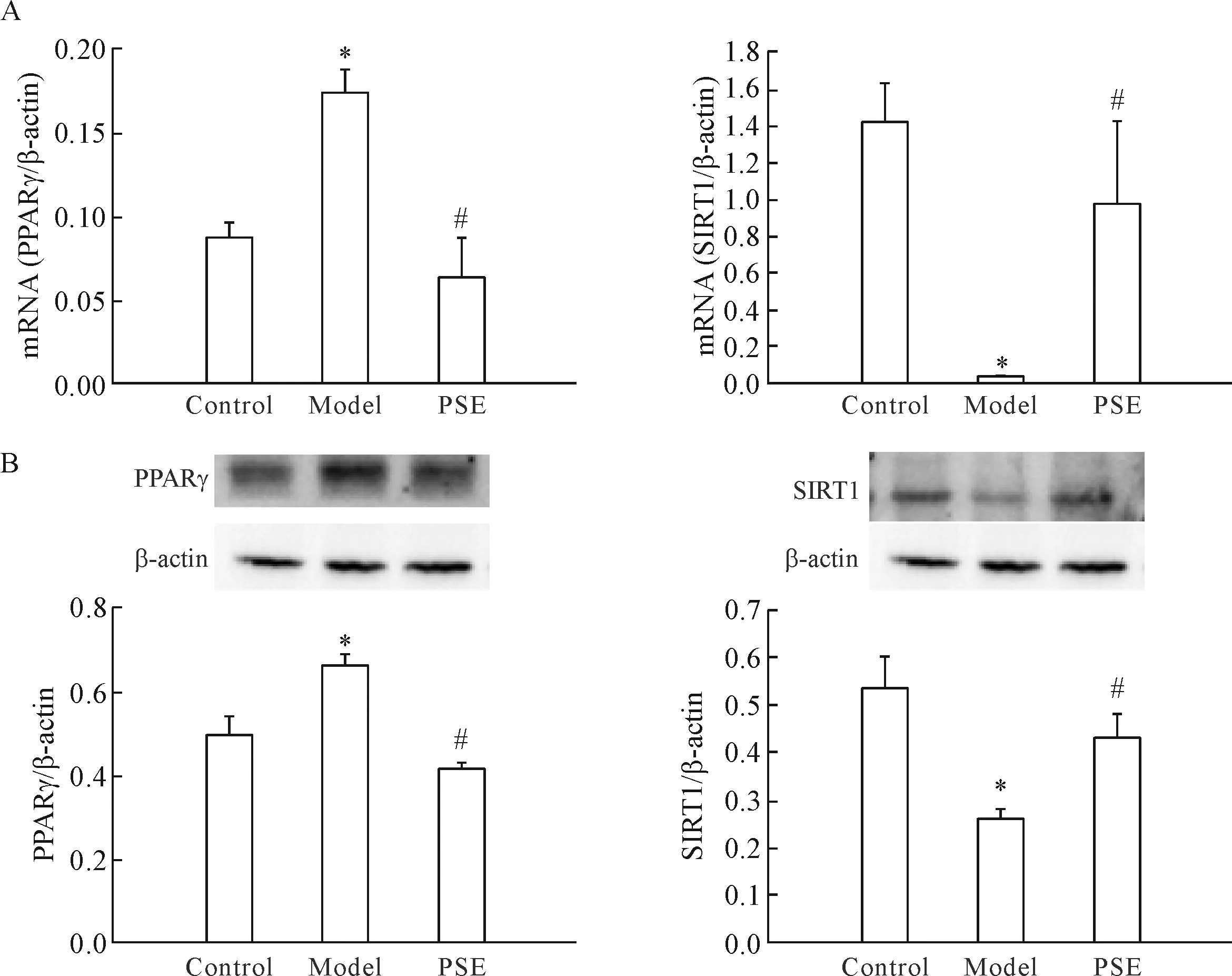
Figure 3.The effect of PSE on the expression of PPARγ and SIRT1 in the aorta in high-fat diet-fed rats. The mRNA (A) and protein (B) of PPARγ and SIRT1 in the aortas of the rats were detected by real-time PCR and Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group.
图3 PSE对衰老大鼠主动脉PPARγ和SIRT1表达的影响
讨 论
本研究以高脂膳食诱导的主动脉衰老的大鼠为模型,采用PSE膳食干预,观察PSE是否能减轻血管衰老,并对其作用机制进行了探索,发现PSE显著降低血浆TC和LDL-C的水平,增加HDL-C的水平。观察主动脉形态的HE染色结果显示,模型组大鼠的主动脉壁呈现明显的老化现象:内膜和中膜明显增厚,平滑肌增生,SMC排列紊乱,并发生迁移,表明成功建立了衰老模型。给予PSE膳食干预的大鼠主动脉内膜和中膜未见明显增厚,SMC排列比较整齐。分析Masson染色结果发现,模型组大鼠主动脉的SMC和CF含量显著增加,PSE的干预改善了这一变化,且改善至与对照组相近的水平。这些结果证明,高脂膳食能够促进大鼠主动脉的衰老,PSE具有缓解这一进程的作用。
研究表明,AGEs 随增龄在体内不断的积累,与胶原蛋白发生交联,难以水解产物造成血管壁硬度增加[10],并通过一系列的反应,加剧衰老[11]。对血浆AGEs含量的检测结果表明,高脂膳食显著增加了AGEs的含量,而PSE的摄入逆转了这一改变,进一步证实了PSE具有减缓血管衰老的作用。
在作用机制方面,本研究首先对大鼠的抗氧化功能进行了评估。结果显示,PSE减少高脂膳食诱导的MDA含量增加,即PSE呈现出良好的抗氧化能力,这可能是其缓解衰老的机制之一。其次,基因表达的调控在延缓主动脉衰老的进程中也发挥着重要作用。已知低能量状态如营养或热量不足能诱导SIRT1的表达[12],而能量过剩如高脂饮食会抑制其表达[13]。分析主动脉组织SIRT1的表达水平发现,模型组大鼠的表达水平显著低于对照组,这与之前的报道一致;PSE干预后,大鼠主动脉SIRT1的表达水平得到显著提高,这与一项小鼠的实验研究结果一致,其认为SIRT1能够缓解快速老化小鼠血管的衰老[14]。在主动脉组织PPARγ的表达方面,PSE显著下调了PPARγ的mRNA和蛋白表达水平。近年来发现PPARγ在血管内皮细胞中有表达,影响内皮功能及血管平滑肌细胞的增殖和迁移,激活巨噬细胞[15-16],也有报道认为PPARγ信号通路的激活具有延缓衰老的作用[17-18]。关于PPARγ在血管衰老进程中扮演的角色,目前没有确切的结论,值得进一步的探讨。
综上所诉,PSE具有延缓主动脉衰老的作用,可能是通过增强机体的抗氧化功能、调节SIRT1或PPARγ的表达来发挥作用的。
[1] Lakatta EG, Levy D. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part I: aging arteries: a "set up" for vascular disease[J]. Circulation, 2003, 107(1):139-146.
[2] Romano AD, Serviddio G, de Matthaeis A, et al. Oxidative stress and aging[J]. J Nephrol, 2010, 23(Suppl 15):S29-S36.
[3] Zhang C, Yang J, Jennings LK. Leukocyte-derived myeloperoxidase amplifies high-glucose-induced endothelial dysfunction through interaction with high-glucose-stimulated, vascular non-leukocyte-derived reactive oxygen species[J]. Diabetes, 2004, 53(11):2950-2959.
[4] Balakumar P, Kathuria S. Submaximal PPARγ activation and endothelial dysfunction: new perspectives for the ma-nagement of cardiovascular disorders[J]. Br J Pharmacol, 2012, 166(7):1981-1992.
[5] Ahmadian M, Suh JM, Hah N, et al. PPARγ signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013, 99(5):557-566.
[6] Picard F, Kurtev M, Chung N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-γ[J]. Nature, 2004, 429(6993):771-776.
[7] Potente M, Ghaeni L, Baldessari D, et al. SIRT1 controls endothelial angiogenic functions during vascular growth[J]. Genes Dev, 2007, 21(20):2644-2658.
[8] 崔 鸣, 陈凤荣, 宋清华, 等. 氨氯地平抑制氧化型胆固醇诱导的血管内皮细胞凋亡[J]. 中国病理生理杂志, 2001, 17(2):104-107.
[9] 王先酉, 赵秀华, 王 峰, 等. 高脂饮食引起大鼠动脉血管内皮细胞衰老[J]. 国际病理科学与临床杂志, 2010, 30(2):118-122.
[10]Mirea O, Donoiu I, Pleea IE. Arterial aging: a brief review[J]. Rom J Morphol Embryol, 2012, 53(3):473-477.
[11]Baraibar MA, Liu L, Ahmed EK, et al. Protein oxidative damage at the crossroads of cellular senescence, aging, and age-related diseases[J]. Oxid Med Cell Longev, 2012, 2012:919832.
[12]Nemoto S. Nutrient availability regulates sirt1 through a forkhead-dependent pathway[J]. Science, 2004, 306(5704):2105-2108.
[13]Coste A, Louet JF, Lagouge M, et al. The genetic ablation of SRC-3 protects against obesity and improves insulin sensitivity by reducing the acetylation of PGC-1[J]. Proc Natl Acad Sci U S A, 2008, 105(44):17187-17192.
[14]Ota H, Akishita M, Akiyoshi T, et al. Testosterone deficiency accelerates neuronal and vascular aging of SAMP8 mice: protective role of eNOS and SIRT1[J]. PLoS One, 2012, 7(1):e29598
[15]Zhao J, Li L, Pei Z, et al. Peroxisome proliferator activated receptor (PPAR)-γ co-activator 1-α and hypoxia induced factor-1α mediate neuro- and vascular protection by hypoxic preconditioninginvitro[J]. Brain Res, 2012, 1447:1-8.
[16]Komatsu A, Node K. Effects of PPARγ agonist on dyslipidemia and atherosclerosis[J]. Nihon Rinsho, 2010, 68(2):294-298.
[17]Duan SZ, Usher MG, Mortensen RM. Peroxisome proliferator-activated receptor-mediated effects in the vasculature[J]. Circ Res, 2008, 102(3):283-294.
[18]Werner C, Gensch C, Pöss J, et al. Pioglitazone activates aortic telomerase and prevents stress-induced endothelial apoptosis[J]. Atherosclerosis, 2011, 216(1):23-34.
(责任编辑: 陈妙玲, 罗 森)
Effects of phytosterol ester on aortic aging and expression of related genes in rats
DING Cheng-cheng, LI Wen-fang, ZHOU Jin, RAN Ke, WU Xiao-qing, RONG Shuang
(SchoolofPublicHealth,MedicalCollege,WuhanUniversityofScienceandTechnology;InstituteofNutritionandChronicDiseases,WuhanUniversityofScienceandTechnology,Wuhan430065,China.E-mail:moment-88@163.com)
AIM: To explore the protective effect of phytosterol ester (PSE) on aortic aging in rats. ME-THODS: The female SD rats (12 months old,n=42) were randomly divided into control group, model group and PSE group. During the experiment, the rats in control group, model group and PSE group were treated with basic feed, high-fat diet (HFD) and HFD with 2% PSE (W/W) for 6 months, respectively. The morphological changes of the aorta were observed by HE staining and Masson staining, and the absolute area of smooth muscle cells and collagen fiber in the vascular wall were measured by image analysis. The levels of advanced glycosylation end products (AGEs), malondialdehyde (MDA), superoxide dismutase (SOD) and catalase (CAT) in the plasma were detected. The expression of silent information regulator 1 (SIRT1) and peroxisome proliferator-activated receptor γ (PPARγ) at mRNA and protein levels in the vascular tissue was determined by real time PCR and Western blot, respectively. RESULTS: PSE significantly lowered plasma TC and LDL-C, and increased plasma HDL-C level (P<0.05), but had no effect on plasma TG level. PSE significantly attenuated the thickening of intima and media of aging aortic, and decreased the migration of vascular smooth muscle cells (VSMC) and the amount of VSMC and collagen fiber in the aorta (P<0.05). PSE significantly reduced the contents of AGEs and MDA (P<0.05), but had no effect on the activity of SOD and CAT in the plasma. PSE also down-regulated the expression of PPARγ and up-regulated the expression of SIRT1 (P<0.05). CONCLUSION: PSE is able to attenuate the senescence process in the aorta by reducing the production of reactive oxygen species in plasma, and activating SIRT1, or inhibiting the expression of PPARγ in vascular tissues.
Phytosterol ester; Aortic aging; Silent information regulator 1; Peroxisome proliferator-activated receptor γ
1000- 4718(2017)08- 1365- 06
2016- 12- 27
2017- 03- 21
2013年BASF国际健康研究基金项目课题(亚洲)
R339.3+8; R965; R363
A
10.3969/j.issn.1000- 4718.2017.08.004
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 18571727264; E-mail: moment-88@163.com

