柴油液相加氢过程中化学氢耗的研究
程 杰,相春娥,刘 宾,柴永明,赵秀文,王德会,刘晨光
(1.中国石油大学 重质油国家重点实验室, 山东 青岛 266580; 2.中国寰球工程有限公司 北京分公司, 北京 100020;3.中国石油工程建设公司 华东设计分公司, 山东 青岛 266071)
柴油液相加氢过程中化学氢耗的研究
程 杰1,2,相春娥3,刘 宾1,柴永明1,赵秀文3,王德会3,刘晨光1
(1.中国石油大学 重质油国家重点实验室, 山东 青岛 266580; 2.中国寰球工程有限公司 北京分公司, 北京 100020;3.中国石油工程建设公司 华东设计分公司, 山东 青岛 266071)
在上流式固定床加氢中试实验装置上对柴油液相加氢过程中的化学氢耗进行研究,根据不同反应物的加氢反应方程推导出不同加氢反应的氢耗计算式,并建立了氢耗动力学模型。研究发现,在上流式柴油液相加氢过程中,前段催化剂床层的化学氢耗远远大于后段催化剂床层,70%的化学氢耗集中在前20%的催化剂床层上,从而导致后段床层H2浓度过低而影响加氢反应的进行;在进料量200 mL/h、氢/油质量比4.244×10-3、反应温度350℃和反应压力8 MPa条件下,化学氢耗计算值与实测值的平均相对误差为2.11%,表明推导的氢耗计算式准确、可靠;建立的氢耗动力学模型在预测化学氢耗时的相对误差小于2.0%,表明所建模型合理。
柴油;液相加氢;化学氢耗
柴油液相加氢是针对常规滴流床加氢存在的问题开发出的一种新型柴油加氢技术,该技术取消了循环氢系统,H2预先溶解在原料油中来满足加氢反应的需求,从而节省设备投资和降低装置运行能耗[1-3]。但是,由于液相加氢过程采用较小的氢/油比,反应器内氢分压低,H2在原料油中的溶解度低和化学氢耗高是制约液相加氢的关键因素。因此,研究柴油液相加氢过程中化学氢耗的变化规律对于柴油液相加氢装置的改进和放大都具有重要指导意义。
化学氢耗是柴油加氢过程中化学反应所消耗的H2量,包括加氢脱硫、加氢脱氮、烯烃和芳烃加氢饱和以及裂化反应等多个过程的氢耗。化学氢耗大小受进料组成、加氢深度以及催化剂性质等因素影响,化学氢耗通常由中小型实验中的物料平衡和氢平衡数据求得[4]。当缺少这方面的数据时,可以根据进料和反应生成油的分析数据进行估算[5-7]。
笔者根据柴油馏分加氢过程中的化学反应推导出化学氢耗计算的理论方程式,并以柴油液相加氢中试实验结果对计算方程进行验证,同时建立柴油液相加氢过程的化学氢耗动力学模型,对柴油液相加氢过程中的化学氢耗规律进行研究。
1 实验部分
1.1 实验原料及催化剂
原料为青岛炼化直馏柴油,其性质见表1。催化剂为中国石油大学(华东)CNPC催化重点实验室开发的NiMo/γ-Al2O3柴油加氢精制催化剂(FDS-1),性质见表2。

表1 原料柴油性质Table 1 Properties of the diesel feed
MA—Monoaromatics; DiA—Diaromatics; TriA+—Triaromatics and residue aromatics

表2 柴油加氢精制催化剂FDS-1的物化性质Table 2 Characteristics of the FDS-1 hydrotreating catalyst
1.2 评价方法
1.2.1 加氢反应器
采用中国石油大学(华东)重质油国家重点实验室100 mL上流式固定床加氢反应器,如图1所示。加氢反应器规格:长1400 mm,内径24 mm。催化剂床层两端装填催化剂保护剂,入口保护剂床层可以起到混氢作用,催化剂床层的上、中、下3个位置各插入一热电偶,测定反应温度。
1.2.2 评价方法
催化剂预硫化:配制含2%(质量分数)二甲基二硫醚(DMDS)的航空煤油作为预硫化油。预硫化条件:液体空速1.0 h-1、氢/油质量比5.3×10-2、反应压力8 MPa。预硫化温度控制如下:200℃恒温1 h,240℃恒温6 h,280℃恒温1 h,340℃恒温12 h。预硫化结束,切换青岛炼化直馏柴油进行催化剂活性稳定。反应条件:进料空速1.5 h-1、氢/油质量比5.3×10-2、反应压力8 MPa、反应温度340℃、处理时间24 h。
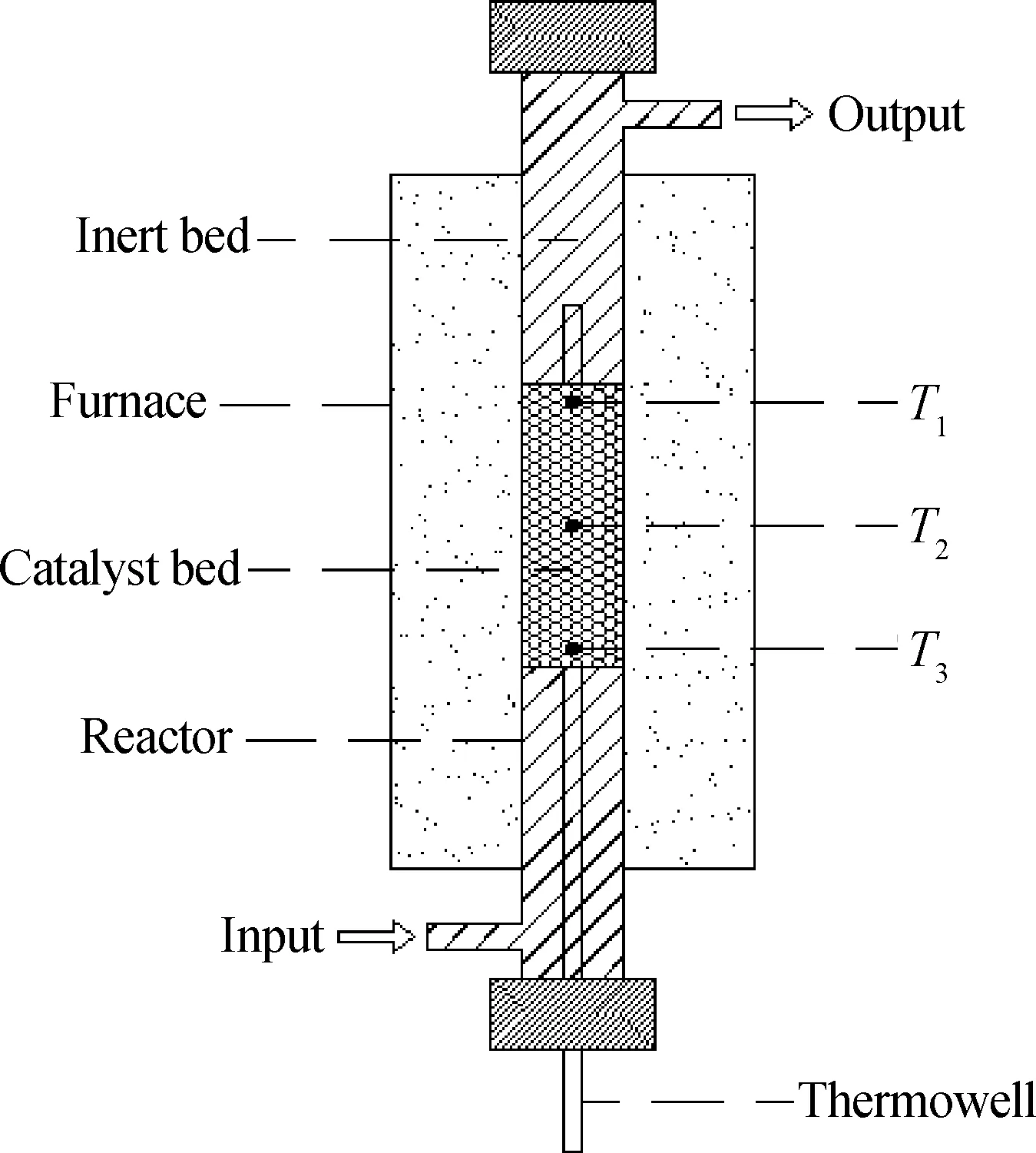
图1 上流式固定床加氢反应器示意图Fig.1 Schematic diagram of the upflow fixed-bed hydrogenation reactor
加氢实验:青岛炼化直馏柴油作为原料进行加氢实验,反应条件:进料量200 mL/h、氢/油质量比4.244×10-3、反应温度350℃和反应压力8 MPa,催化剂装填量分别为10、20、30、50、70、80和100 mL。
1.3 油品性质分析
采用CHNS/O元素分析仪(Elementar公司 Vario EL Ⅲ型)测定油品中的C、H、S、N含量;根据SH/T 0806-2008标准,采用高效液相色谱仪(Waters公司 E2695型)测定油品中的单环芳烃、双环芳烃和三环及以上芳烃的含量;采用自动密度仪(Anton Paar 公司DMA 4500型)测定油品密度;用模拟蒸馏的方法测定油品的馏程,采用的仪器为气相色谱仪(Agilen 公司7890A型),测定方法为ASTM-D2882。
2 柴油馏分加氢过程中化学氢耗的计算方法
2.1 物料平衡法计算化学氢耗
采用物料平衡法测定化学氢耗的方式有2种:一是对气相中H2做物料衡算,二是对液相中H做物料衡算。式(1)为全装置H2平衡,式(2)为液相物料H平衡计算化学氢耗的公式,式(3)为气相物料H2平衡计算化学氢耗的公式。
Mf×w(H)f+Mmg×w(H2)mg=Mp×w(H)p+
Mog×w(H)og+Mog×w(H2)og
(1)
FH2=(Mp×w(H)p+Mog×w(H)og-
Mf×w(H)f)/100
(2)
FH2=(Mmg×w(H2)mg-Mog×w(H2)og)/100
(3)
当没有气相物料数据时,近似认为气相中除H2之外的H只来自于H2S和NH3,反应脱除1molS需要1molH2,脱除1molN需要1.5molH2。将式(2)变形为式(4)。
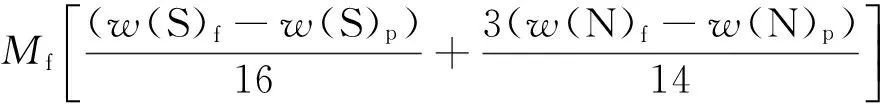
(4)
2.2 反应方程法计算化学氢耗
柴油馏分加氢精制过程中主要发生的加氢反应有加氢脱硫、加氢脱氮、烯烃和芳烃加氢饱和等反应。分别计算各类加氢反应的氢耗量,继而求得整个加氢过程的总化学氢耗[8-9]。
总化学氢耗:
Hcons=HHDS+HHDN+HHDO+HHGO+HHDA
(5)
2.2.1 加氢脱硫(HDS)
柴油馏分主要的硫化物是苯并噻吩类硫化物(BTs)和二苯并噻吩类硫化物(DBTs),还含有少量的硫醇、硫醚和噻吩。
BTs和DBTs加氢反应方程式如下所示:
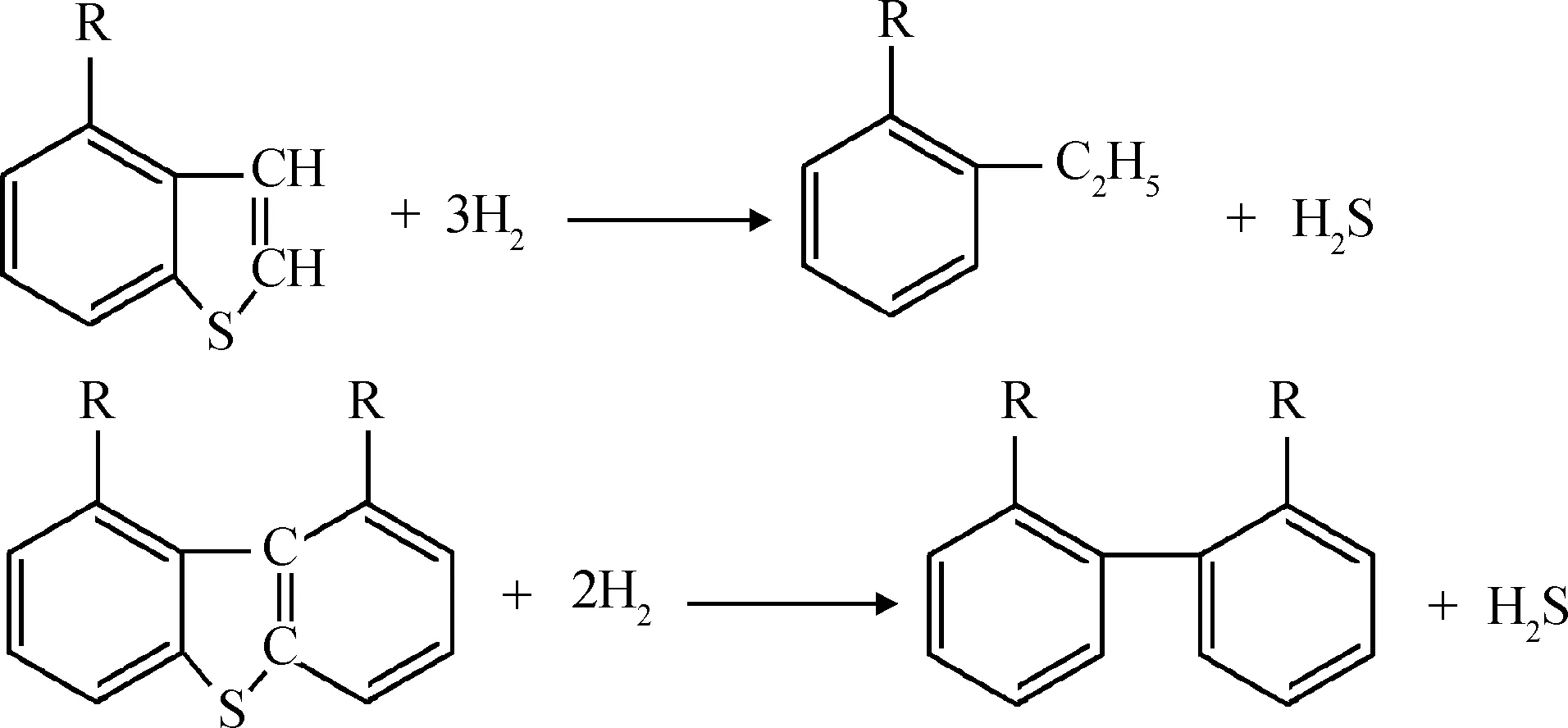
为了方便HDS氢耗的计算,将原料油中少量的硫醇、硫醚和噻吩归为BTs。因此,根据BTs和DBTs HDS方程,得HDS氢耗方程,如式(6)所示。
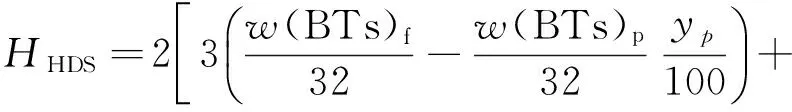
(6)
2.2.2 加氢脱氮(HDN)
柴油馏分中的氮化物主要是喹啉、吲哚和咔唑等杂环氮化物,HDN反应需先将杂环加氢饱和后才能将N脱除。喹啉、吲哚和咔唑加氢反应方程如下所示:
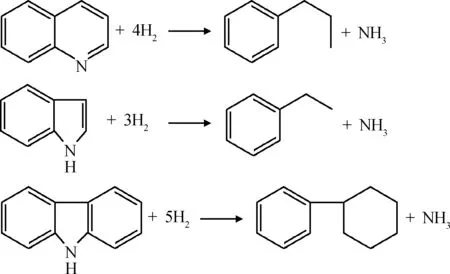
柴油馏分中咔唑类氮化物占总氮化物的质量分数一般为60%~90%,可以近似认为1 mol氮化物HDN消耗5 mol H2,得HDN氢耗方程,如式(7)所示。
(7)
2.2.3 加氢脱氧(HDO)
柴油中的氧化物含量很少,主要是环烷酸,二次加工产品中还含有酚类。环烷酸和酚类加氢反应方程式如下所示:
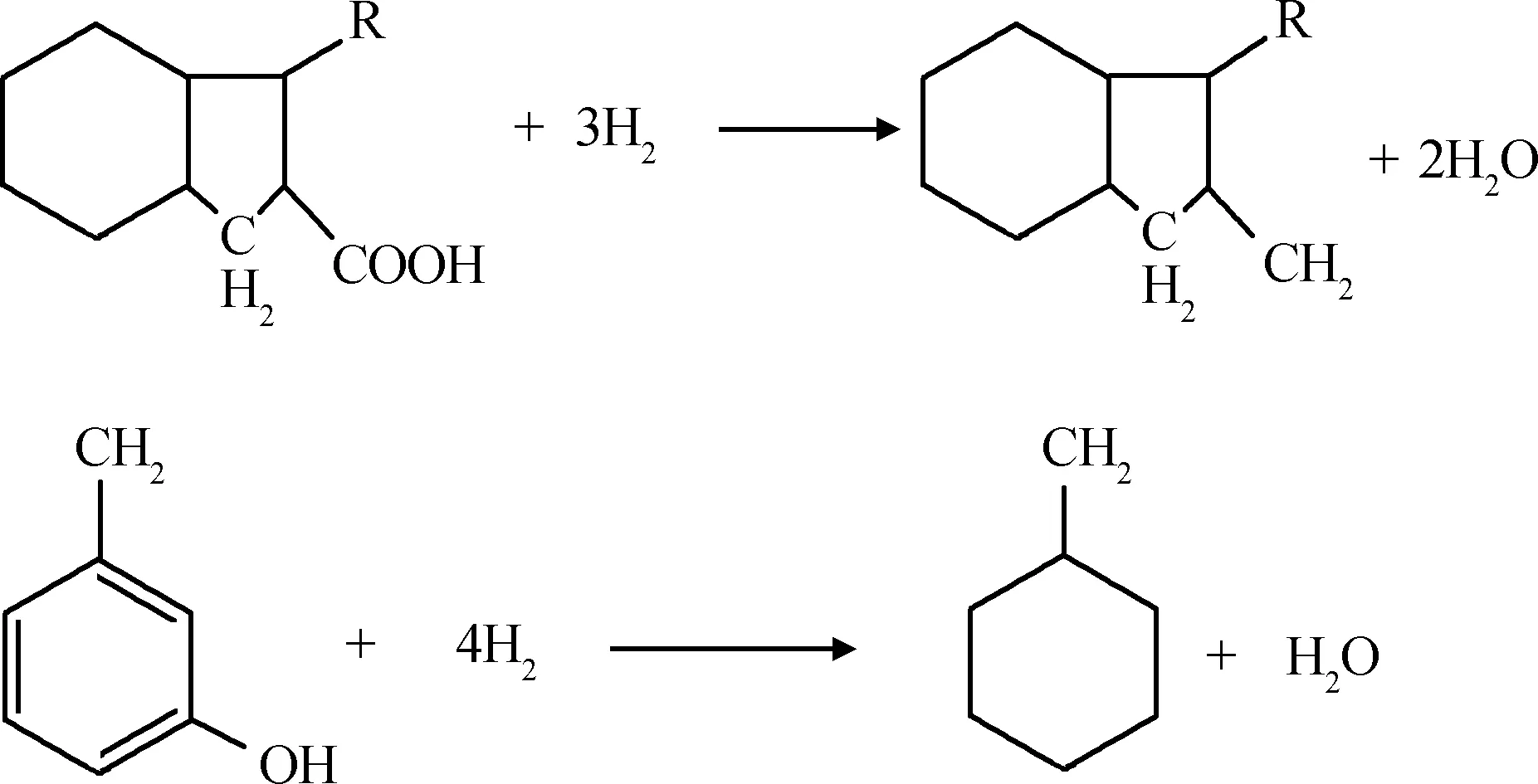
柴油馏分中氧化物含量很少,在计算HDO氢耗时假设1 mol氧化物HDO消耗4 mol H2,得HDO氢耗方程,如式(8)所示。
(8)
2.2.4 烯烃加氢饱和(HGO)
柴油馏分中烯烃含量的多少通常用溴值来表示,H2和Br以等分子比和烯烃发生反应,因此可以用溴值计算HGO的化学氢耗,HGO氢耗方程如式(9)所示。
(9)
2.2.5 芳烃加氢饱和和环烷烃开环(HDA)
柴油馏分中芳烃组分主要有单环芳烃、双环芳烃和三环芳烃,三环以上的芳烃含量很少。芳烃加氢饱和反应都是逐环进行的,多环芳烃首先加氢变为单环芳烃,单环芳烃再加氢变为环烷烃,反应方程式如下所示:
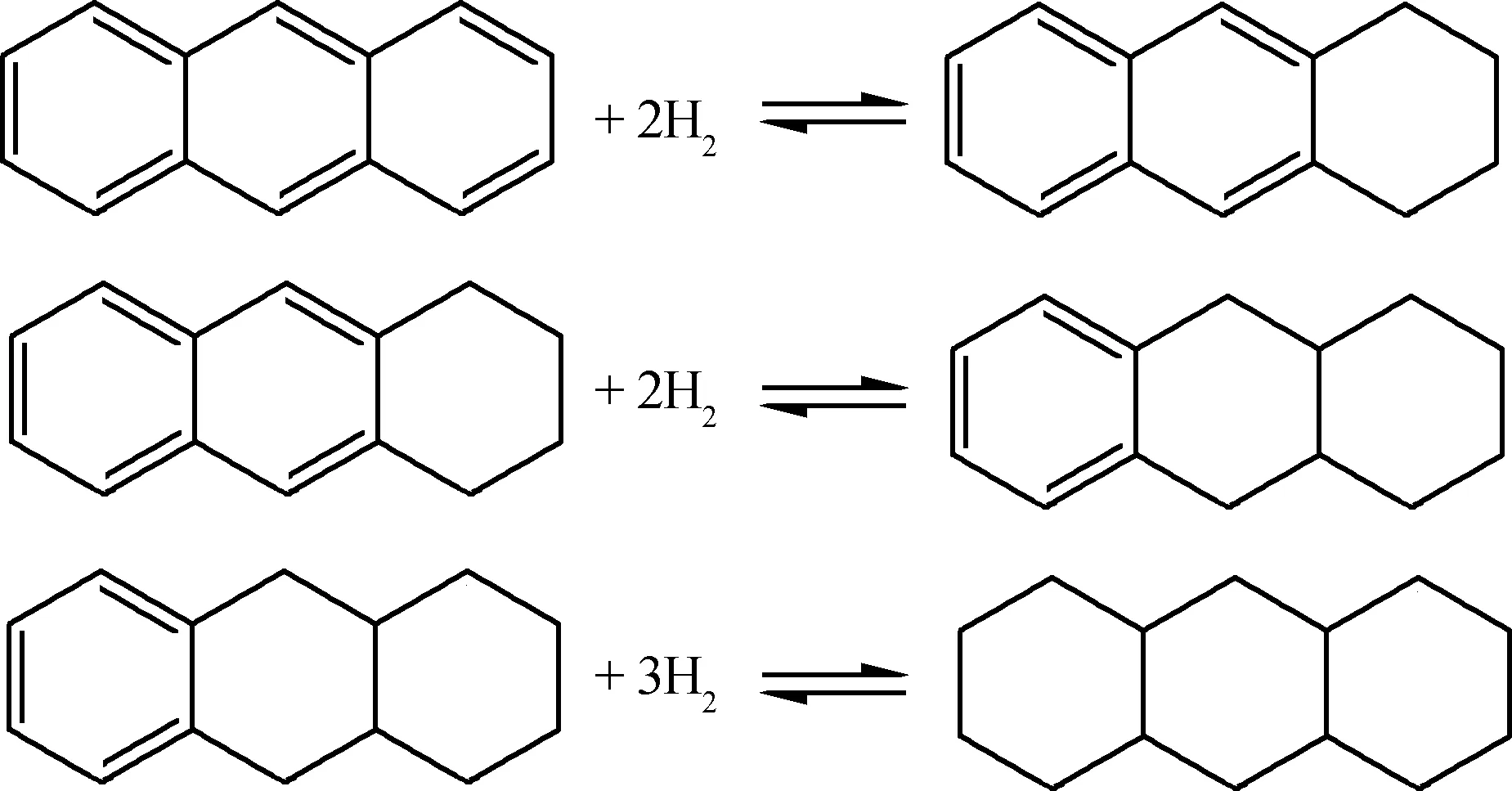
单环芳烃有一部分是由多环芳烃转化而来,因此,单环芳烃含量应包括由进料中多环芳烃转化而来的单环芳烃量(可认为1个多环芳烃加氢变为1个单环芳烃)。在柴油馏分加氢过程中,环烷烃含量变化很小,为便于计算,假设芳烃加氢变为环烷烃的量与环烷烃开环的量相等,每1个环烷烃分子上只有1个环烷环。
根据芳烃加氢反应方程式得HDA氢耗方程如式(10)所示,芳烃平均相对分子质量近似用油品相对分子质量代替。
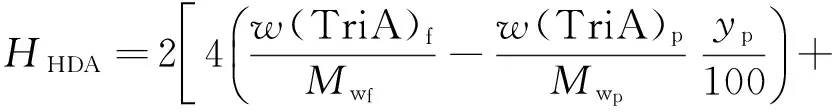
(10)
平均相对分子质量由式(11)计算:
(11)
2.3 氢耗动力学模型
柴油加氢过程中存在HDS、HDN、HGO和HDA等多种加氢反应,氢耗动力学模型中包含的加氢反应越多,模型越精确,但同时给氢耗动力学方程的求取带来一定难度。为了便于建立柴油馏分加氢的氢耗动力学模型,将原料中的反应物归为2个集总:反应部分和不反应部分,氢耗动力学方程中只考虑反应部分。反应部分完全反应所需要的H2量代表反应物的总量,化学氢耗量代表反应物转化的量,剩余反应物的量由剩余反应物加氢所需要的H2的量表示,大小等于反应部分完全反应所需H2量与氢耗量的差值。
实验采用的加氢反应器为等温固定床上流式反应器,近似认为整个催化剂床层温度均一;在液相加氢过程中,催化剂床层完全浸泡在油相中,如果不考虑内扩散的影响,假设反应器为理想平推流反应器,氢耗动力学方程如式(12)所示[10]。
(12)
由于,CH=CT-cons-Hcons;因此,式(12)可变形为式(13):
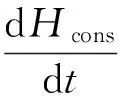
(13)
3 结果与讨论
油品分析数据如表3所示。由于液相加氢过程均采用较小的氢/油质量比,进入反应器的H2大部分参加了加氢反应,尾气流量非常小,因此对于加氢装置尾气的测定和分析变得比较困难。在无法获取气相数据的条件下,不能对全装置做物料衡算。液相H平衡法式(4)是根据液相物料H平衡推导出的计算化学氢耗的方法,该法准确度高,并且不需要气体数据,计算结果可以作为化学氢耗的实测值。
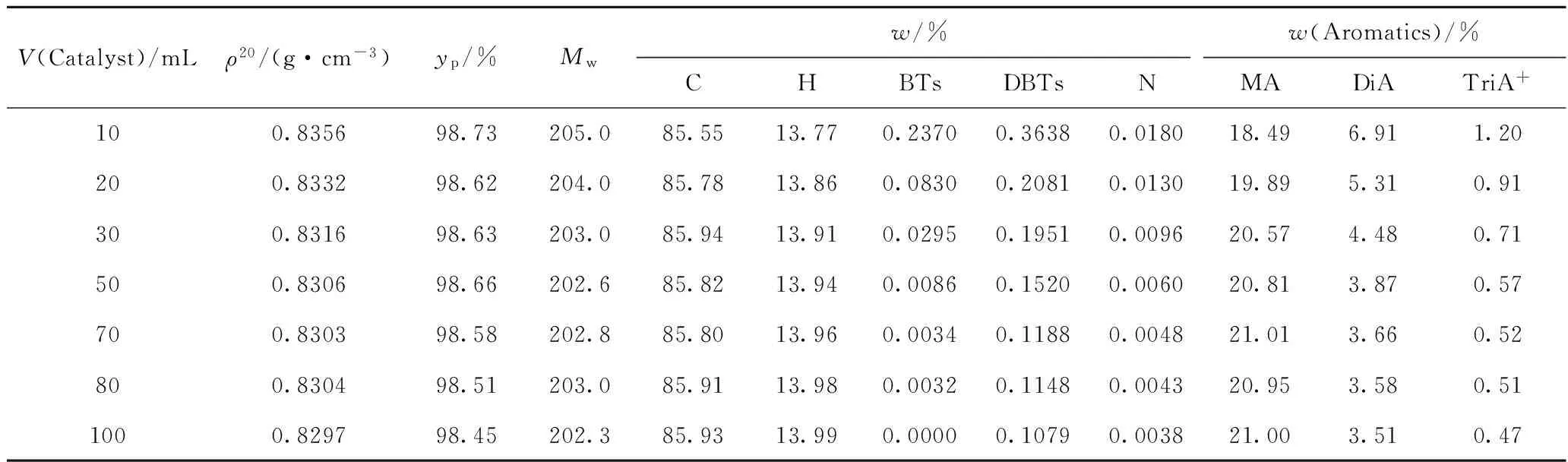
表3 加氢产品性质Table 3 Properties of hydrogenation products
MA—Monoaromatics; DiA—Diaromatics; TriA+—Triaromatics and residue aromatics
q=200 mL/h;m(H2)/m(Oil)=4.244×10-3;T=350℃;p=8 MPa
本实验所用原料中烯烃和氧(元素)质量分数小于0.1%,加氢过程中主要发生HDS、HDN和HDA反应。因此,对于本实验采用的原料,总化学氢耗Hcons=HHDS+HHDN+HHDA。
分别采用液相H平衡法和反应方程法求取原料柴油加氢过程中的化学氢耗,结果见表4。
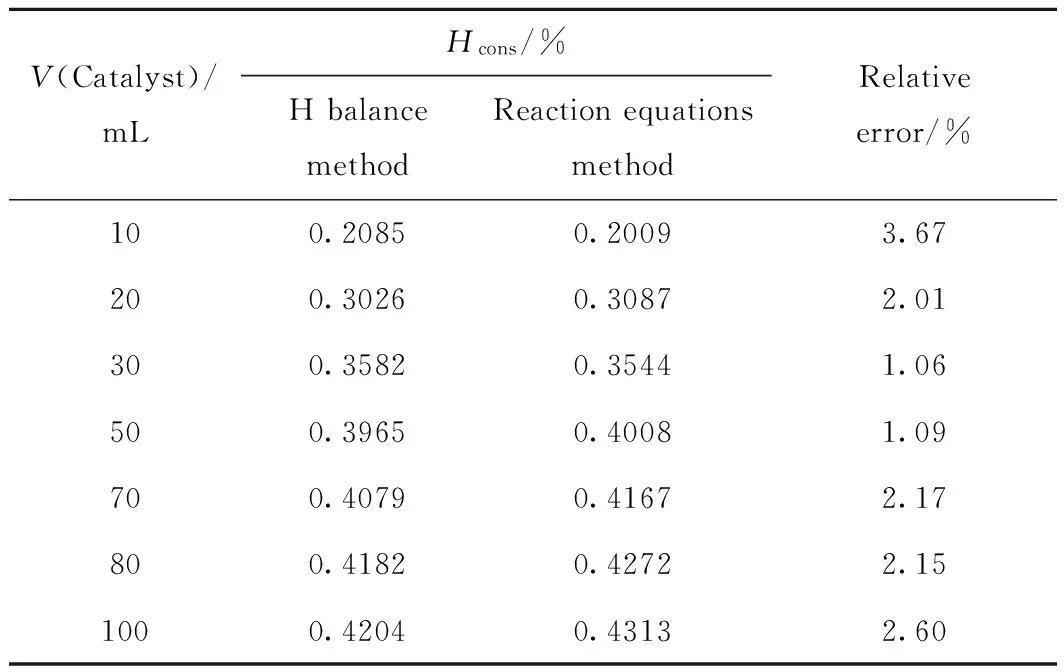
表4 H平衡法和反应方程法测得化学氢耗Table 4 Chemical hydrogen consumption measured by the H balance and reaction equations
Hcons—Chemical hydrogen consumption(mass ratio of H2/Oil), %; Relative error—The relative error of chemical hydrogen consumption calculated by reaction equations compared with the values measured by H balance, %
q=200 mL/h;m(H2)/m(Oil)=4.244×10-3;T=350℃;p=8 MPa
由表4可以看出,根据加氢反应方程计算出的化学氢耗与通过H平衡法测定的化学氢耗相近,平均相对误差2.11%,说明根据加氢反应方程推导出的氢耗计算式准确度高,能够用来求取柴油加氢过程中的化学氢耗。
为了更直观地反映化学氢耗沿催化剂床层的分布规律,针对化学氢耗随催化剂装填体积变化作图,如图2所示。
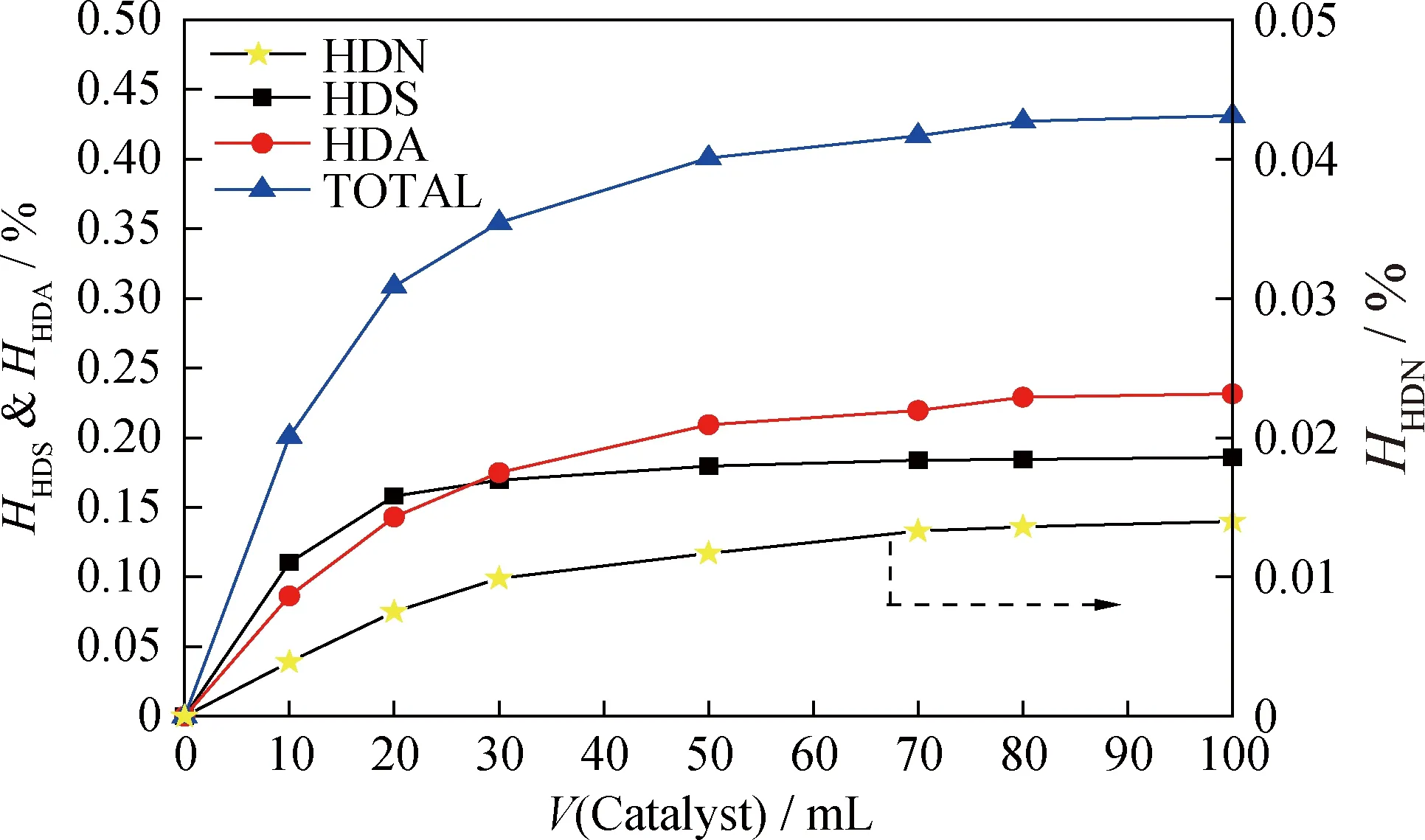
图2 化学氢耗沿催化剂床层的分布Fig.2 Distributions of chemical hydrogen consumption along the catalyst bedq=200 mL/h; m(H2)/m(Oil)=4.244×10-3; T=350℃; p=8 MPa
由图2可知,化学氢耗在催化剂床层上分布不均匀,催化剂床层前段的化学氢耗远远高于催化剂床层后段,50%的氢耗集中在前10%催化剂床层上,70%的氢耗集中在前20%催化剂床层上,表明在上流式柴油液相加氢过程中,加氢反应主要集中在催化剂床层前段。
为了直观反映柴油液相加氢过程中反应器内H2质量分数的变化,针对反应器内H2质量分数随催化剂装填体积变化作图,如图3所示。
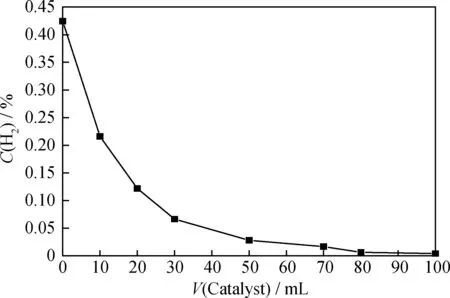
图3 反应器内H2质量分数沿催化剂床层的变化Fig.3 Change of hydrogen mass fraction along the catalyst bedq=200 mL/h; m(H2)/m(Oil)=4.244×10-3; T=350℃; p=8 MPa
由图3可知,在反应器入口注氢量不变的情况下,沿着催化剂床层,反应器内的H2质量分数不断下降,且前段床层耗氢量远远大于后段床层。催化剂装填量为10 mL时,反应器出口H2氢/油质量比为2.159×10-3;催化剂装填量为30 mL时,反应器出口H2氢/油质量比为6.62×10-4;催化剂装填量为50 mL时,反应器出口H2氢/油质量比为2.79×10-4。液相加氢过程中随着反应的进行,反应器内H2质量分数迅速降低,造成后段床层贫氢。
为了进一步研究柴油液相加氢过程中的氢耗规律,下面根据实验数据建立氢耗动力学方程。在反应条件下,认为所有的硫化物、氮化物都能够参加加氢反应,但芳烃化合物并不能完全反应。假设能够参加加氢反应的芳烃组分量与催化剂装填量为100 mL时转化的芳烃量相同,得CT-cons=0.4280%。将CT-cons和注氢量带入式(13),得:
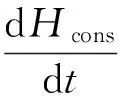
(14)
采用催化剂装填量为10、30、50、80和100mL下的实验数据用于计算氢耗动力学模型方程参数,催化剂装填量为20mL和70mL的实验数据用于模型验证。采用Matlab软件求取模型参数,得模型参数kH=20.46,n=0.95,m=0.33。模型如下所示:
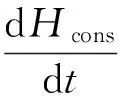
(15)
模型拟合值与实验值比较如表5所示,可以看出模型拟合值与实验值间相对误差均小于1.0%,模型拟合效果较好。
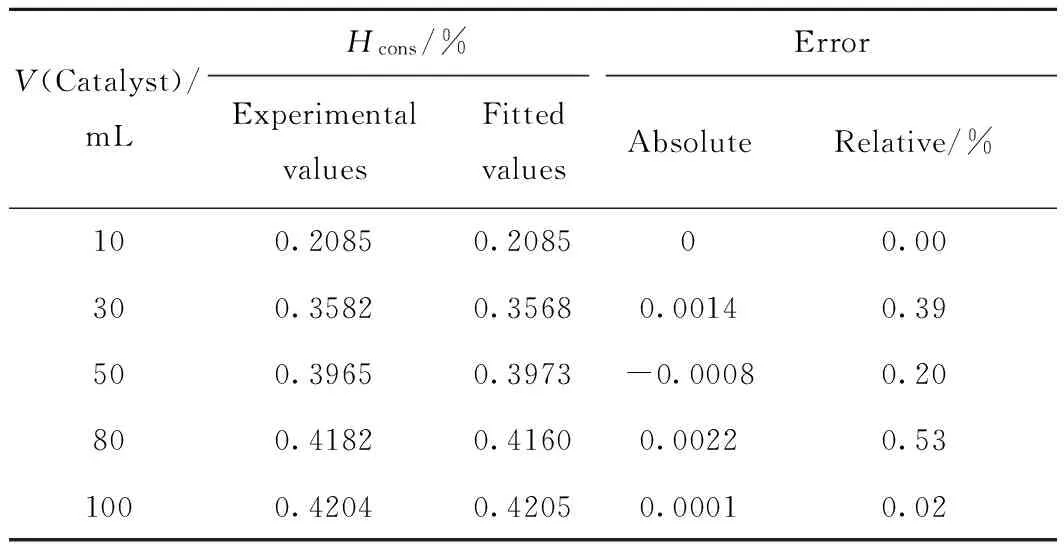
表5 实验值与模型拟合值Table 5 Comparison of experimental values and fitted values from the kinetic model
模型验证结果见表6,可以看出模型计算值和实验值之间相对误差均小于2.0%,说明所建模型合理,模型参数可靠。
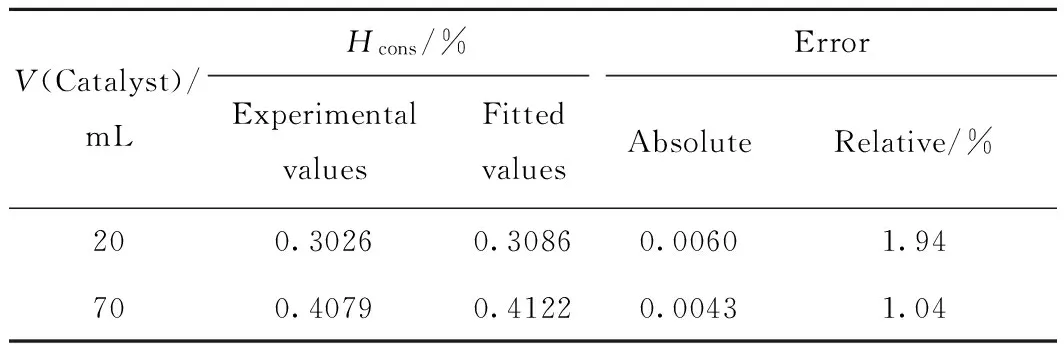
表6 模型验证Table 6 Model validation
4 结 论
(1)由柴油馏分加氢精制过程的化学反应方程推导出的化学氢耗计算式能够用来计算柴油液相加氢过程的化学氢耗,平均相对误差为2.11%,准确度高。
(2)采用NiMo/γ-Al2O3加氢催化剂,在进料量200 mL/h、氢/油质量比4.244×10-3、反应温度350℃和反应压力8 MPa下,建立了直馏柴油加氢的化学氢耗动力学模型,模型预测值与实验值的相对误差小于2.0%,表明该模型是可靠的。
(3)在上流式柴油液相加氢过程中,前段催化剂床层的化学氢耗远高于后段催化剂床层,大量H2在前段催化剂床层消耗,导致后段床层出现贫氢现象,为保证后段床层加氢反应的进行需及时补入H2。
符号说明:
CH——剩余反应物完全加氢所需要H2的量(氢/油质量比),%;
CT-cons——反应部分完全反应所需H2的量,%;
C(H2)——反应器内H2的量,%;
C(H2)0——反应器入口注H2量,%。
FH2——化学氢耗量,kg/h;
Hcons、HHDS、HHDN、HHDO、HHGO和HHDA——分别对应总化学氢耗、加氢脱硫、加氢脱氮、加氢脱氧、烯烃加氢和芳烃加氢饱和的化学氢耗,%。
kH——氢耗速率常数;
M——液体的质量流率,kg/h;
Mw——平均相对分子质量;
N(Br)——溴值,g/(100 g);
t——停留时间,大小等于催化剂体积与进料量之比,h。
Tb——常压沸点或实沸点蒸馏(TBP)50%(质量分数)馏出温度,当没有实沸点蒸馏数据时,用恩氏蒸馏(D86)50%(体积分数)馏出温度+4.5,K;
w——质量分数,%;
w(H)og——出反应器气体(不包括H2)中H的质量分数,%;
yp——液体质量收率,%;
ρ20——密度(20℃),g/mL;
下标:
f——进料;
p——产品;
mg——进入反应器的气体;
og——出反应器的气体。
[1] 王萌, 金月昶, 王铁刚, 等. 液相加氢技术现状及发展前景[J].当代化工, 2013, 42(4): 436-438. (WANG Meng, JIN Yuechang, WANG Tiegang, et al. Development prospect and present situation of the liquid phase hydrogenation technology[J].Contemporary Chemical Industry, 2013, 42(4): 436-438.)
[2] KEY R D, ACKERSON M D, LAURENT J, et al. Isotherming——A new technology for ultra low sulfur fuels[C]//NPRA Annual Meeting(AM-03-11), San Antonio, TX, USA, 2003.
[3] 李哲, 康久常, 孟庆巍. 液相加氢技术进展[J].当代化工, 2012, 41(3): 292-294. (LI Zhe, KANG Jiuchang, MENG Qingwei. Research progress in the liquid phase hydrogenation technology[J].Contemporary Chemical Industry, 2012, 41(3): 292-294.)
[4] 侯震, 齐艳华. 加氢装置氢耗量模型的研究[J].计算机与应用化学, 2004, 21(1): 31-34. (HOU Zhen, QI Yanhua. Investigation on modeling the hydrogen-consumption in hydro-cracking/hydro-treating process[J].Computers and Applied Chemistry, 2004, 21(1): 31-34.)
[5] 李毅中. 馏分油加氢精制化学氢耗量的分类计算[J].齐鲁石油化工, 1980, 8(2): 20-28. (LI Yizhong. Classification calculation of distillate hydrotreating chemical hydrogen consumption[J].Qilu Petrochemical Technology, 1980, 8(2): 20-28.)
[6] 滕家辉, 李冬, 李稳宏, 等. 煤焦油加氢氢耗的研究[J].化学反应工程与工艺, 2011, 27(5): 443-449. (TENG Jiahui, LI Dong, LI Wenhong, et al. Study on hydrogen consumption of coal tar hydrogenation[J].Chemical Reaction Engineering and Technology, 2011, 27(5): 443-449.)
[7] CASTANEDA L C, MUNOZ J A D, ANCHEYTA J. Comparison of approaches to determine hydrogen consumption during catalytic hydrotreating of oil fractions[J].Fuel, 2011, 90(12): 3593-3601.
[8] STRATIEV D, TZINGOV T, SHISHKOVA I, et al. Hydrotreating units chemical hydrogen consumption analysis a tool for improving refinery hydrogen management[C]//44th International Petroleum Conference. Bratislava, Slovak Republic. 2009.
[9] LEE K C, MCGOVERN J S E, SILVAL M C D, et al. Study compares methods that measure hydrogen use in diesel hydrotreaters[J].Oil & Gas Journal, 2008, 106(38): 58-63.
[10] PAPAYANNAKOS N, GEORGIOU G. Kinetics of hydrogen consumption during catalytic hydrodesulphurization of a residue in a trickle-bed reactor[J].Journal of Chemical Engineering of Japan, 1988, 21(3): 244-249.
Study on the Chemical Hydrogen Consumption of Diesel Liquid-Phase Hydrogenation
CHENG Jie1,2, XIANG Chun’e3, LIU Bin1, CHAI Yongming1,ZHAO Xiuwen3, WANG Dehui3, LIU Chenguang1
(1.StateKeyLaboratoryofHeavyOilProcessing,ChinaUniversityofPetroleum,Qingdao266580,China;2.ChinaHuanqiuContracting&EngineeringCo.,Ltd.BeijingHuanqiuCorporation,Beijing100020,China;3.ChinaPetroleumEngineering&ConstructionCorporationEastChinaDesignBranch,Qingdao266071,China)
The chemical hydrogen consumption of diesel liquid-phase hydrogenation was studied in an up-flow fixed-bed hydrogenation pilot plant. The calculating equations of chemical hydrogen consumption were deduced based on various chemical reactions, and the kinetic model of hydrogen consumption was built. We reached the conclusion that chemical hydrogen consumption in the front catalyst bed is much higher than that in the back catalyst bed, because there is 70% of hydrogen consumption in the top 20% of catalyst bed, resulting in the bad reaction performance in the back catalyst bed due to the lack of sufficient hydrogen. Under the hydrogenation conditions of the feed rate of 200 mL/h, hydrogen to oil mass ratio of 4.244×10-3, reaction temperature of 350℃ and reaction pressure of 8 MPa, the average relative error of calculated chemical hydrogen consumption is 2.11%, as compared to actual value. The calculating equations we deduced were accurate and reliable. The relative error of chemical hydrogen consumption predicted by the hydrogen consumption kinetic model is less than 2.0%, indicating that the model established in this paper is reasonable.
diesel; liquid-phase hydrogenation; chemical hydrogen consumption
2016-06-17
中国石油工程建设公司项目(2014GJTC-04-01)资助
程杰,男,硕士,主要从事炼油设计工作
刘晨光,男,教授,博士,主要从事加氢领域研究工作;E-mail:cgliu@upc.edu.cn
1001-8719(2017)04-0626-07
TE624
A
10.3969/j.issn.1001-8719.2017.04.004

