糖肾宁含药血清对高糖刺激肾小管上皮细胞增殖作用及RhoA/ROCK信号通路影响的实验研究*
王婷,赵宗江,张新雪,苗永辉,杨冠男
糖肾宁含药血清对高糖刺激肾小管上皮细胞增殖作用及RhoA/ROCK信号通路影响的实验研究*
王婷,赵宗江**,张新雪,苗永辉,杨冠男
(北京中医药大学中医学院北京100029)
目的:探讨糖肾宁含药血清对高糖刺激肾小管上皮细胞增殖作用及RhoA/ROCK信号通路的影响。方法:10%FBS的RPMI 1640培养细胞,培养细胞分为正常组、模型组、厄贝沙坦组和糖肾宁组,按每孔3 000个细胞接种于96孔板中。每组8个复孔,加入6%的各组含药血清培养,分别于12、24、48、60 h观察细胞形态并应用MTT法检测细胞增殖情况;Western blotting检测RhoA、ROCK1、α-SMA和E-Cadherin蛋白的表达。结果:正常组细胞呈扁平不规则多角形,高糖刺激下,细胞呈梭型,加入含药血清后呈扁平不规则多角形。MTT:24、48 h,正常组与模型组比较,有极显著性差异(P<0.01),60 h,正常组与模型组比较,有显著性差异(P<0.05);24 h,糖肾宁组与厄贝沙坦组比较,有显著性差异(P<0.05);48 h,糖肾宁组与厄贝沙坦组、Y27632组比较,有极显著性差异(P<0.01);60 h,糖肾宁组与厄贝沙坦组、Y27632组比较,有显著性差异(P<0.05)。Western blotting:正常组与模型组、Y27632组比较RhoA蛋白表达减少,有极显著性差异(P<0.01);糖肾宁组与模型组比较,有极显著性差异(P<0.01);糖肾宁组与Y27632组比较,有显著性差异(P<0.05)。正常组与模型组比较ROCK1蛋白表达减少,有极显著性差异(P<0.01);Y27632组、各治疗组和模型组比较,有显著性差异(P<0.05)。正常组与模型组比较α-SMA蛋白表达减少,有极显著性差异(P<0.01);Y27632组、各治疗组和模型组比较,有显著性差异(P<0.05)。正常组与模型组组比较E-Cadherin蛋白表达增加,有显著性差异(P<0.05);Y27632组与糖肾宁组比较,有显著性差异(P<0.05);模型组与Y27632组、各治疗组比较,有显著性差异(P<0.05)。结论:糖肾宁可抑制高糖培养肾小管上皮细胞增殖和RhoA/ROCK信号通路相关分子的表达,逆转肾小管上皮细胞转分化、减轻肾间质纤维化、延缓DKD进程。
糖肾宁肾痿肾小管上皮细胞株KKay小鼠细胞增殖MTT EMT RhoA/ROCK信号通路
由于人口老龄化情况加剧,饮食结构以及生活方式的不断改变,使众多发展中国家及部分发达国家中罹患糖尿病(Diabetes Mellitus,DM)的人数急剧上升。我国在过去30年中DM发病率急剧攀升,据统计中国约0.92亿人罹患DM[1~3]。此外,DM其微血管并发症糖尿病肾病(Diabetic Kidney Disease,DKD)严重威胁着人类的生命健康。DKD已成为终末期肾病(End stage renal disease,ESRD)的主要原因[4,5]。现研究表明DKD发病机制与肾小球及肾小管的病理改变密切相关,抑制肾小管上皮细胞转分化在延缓糖尿病肾病进程中具有重要作用。目前多应用ACEI及ARB类药物,可降低尿蛋白水平、减少并发心血管疾病的风险及控制血压[6]。因此如何有效防治本病的发生发展是亟需解决的重要问题。
近年来,中医药在防治本病方面取得了一定的进展,并初步显示出独特优势。导师赵宗江教授发掘传统医学“痿症”相关理论,并结合现代医学对DKD的认识,提出了DKD“肾痿”假说,并在此理论指导下组方糖肾宁,前期研究表明以“肾痿”假说组方的糖肾宁具有消除水肿、降低蛋白尿等的作用;糖肾宁可通过下调肾组织TGF-β1、NF-ĸB蛋白表达,上调smad7蛋白的表达来改善STZ诱导DKD大鼠肾功能及氧化应激状态,起到延缓DKD进程的重要作用,此外,应用高糖培养足细胞中证实糖肾宁可以下调TGF-β1、NF-ĸB表达,上调smad7表达[7,8]。而且糖肾宁通过调控TGF-β1-smad2/3-ILK信号通路,抑制足细胞转分化,保护肾小球结构与功能,从而减轻DKD肾脏损害,延缓病程进展[9]。本研究拟通过给予高糖环境刺激小鼠肾小管上皮细胞,观察糖肾宁含药血清对高糖培养小鼠肾小管上皮细胞增殖及RhoA/ROCK信号通路的影响,以期阐述其对肾小管上皮细胞增殖与上皮细胞转分化的影响,为糖尿病肾病“肾痿”科学假说提供新的实验依据。
1 实验材料
1.1 实验细胞
小鼠近端肾小管上皮细胞株(购买自美国ATCC公司,4100-57)。
1.2 实验药物
糖肾宁(熟地黄6 g、山萸肉3 g、怀山药3 g、杜仲2 g、炒白芍2 g、淫羊藿2 g、水蛭2 g、酒大黄2 g,北京中医药大学中药学院制剂室制备,批号:2016019);厄贝沙坦片(赛诺菲安博维,进口药品注册证号:H20140006,国药准字J20130049)。
1.3 主要试剂
RPMI 1640培养基(Gibco,批号:1786043);胰蛋白酶(Amresco,批号:1554C333);胎牛血清(HyClone,批号:NZE1145);MTT(Amresco,批号:20120308418);DMSO(Amresco,批号:2075C127);青链霉素混合液(Solarbio,货号:P1400);右旋葡萄糖(D-GLU,Amresco,批号1056C459);蛋白抽提试剂(MERCK,71009-3CN);通用型蛋白酶抑制剂(MERCK,539134);BCA法蛋白定量试剂盒(普利莱,批号:20151511052003);一抗β-actin(CST,批号:0011);RhoA(Novus Biologicals,批号:Rb0322-200308-WS);ROCK1(Abcam,批号:GR149410-2);α-SMA(Abcam,批号:GR32377-41);E-Cadherin(Abcam,批号:GR216035-1);二抗山羊抗兔(Abcam,批号:GR231489-1);山羊抗鼠(Abcam,批号:GR215715-5);ECL超敏发光液(Millipore,批号:1316802)。
1.4 实验仪器
倒置显微镜(Olympus),超净工作台(北京市昌平长城空气净化设备公司),B5060EK/CO2恒温CO2培养箱(德国),450型自动酶标仪(MuLtiskan Aseentvl 24345-00627T);凝胶成像系统(Bio-Rad)。
2 实验方法
2.1 含药血清的制备
9只Wistar大鼠,雄性,SPF级,体重(300±20)g,按照体重随机分层,分为正常组、厄贝沙坦组、糖肾宁组3组,每组各3只,给药组每天灌胃给药1次,灌胃剂量1 mL·100 g-1,正常组灌等量去离子水,依据人临床用药剂量,糖肾宁按人临床用药剂量7倍(1.05 g·kg-1)灌胃给药;厄贝沙坦组按人临床用药剂量7倍(17.5 mg·kg-1)灌胃给药,每日1次,连续灌胃7天,末次给药2 h后,股动脉取血,离心分离血清,-20℃保存
2.2 细胞处理及分组
镜下观察细胞生长至80%左右时,0.25%胰蛋白酶消化2 min,10%胎牛血清的1640培养基终止消化后离心,1 000 rpm离心2 min,弃上清;加含10%胎牛血清的1640培养基入T25细胞培养瓶,置37℃,5%CO2恒温培养箱培养。
2.3 实验分组
实验分为正常组、模型组、抑制剂(Y27632)组、厄贝沙坦组、糖肾宁组。正常组:6%正常大鼠血清-RPMI 1640;模型组:6%正常大鼠血清-RPMI 1640+DGLU(30 mmol/L);Y27632组:6%FBS-RPMI 1640+DGLU(终浓度30 mmol/L)+Y27632(10 umol/L);厄贝沙坦组:6%厄贝沙坦含药血清-RPMI 1640+D-GLU(30 mmol/L);糖肾宁组:6%糖肾宁含药血清-RPMI 1640+D-GLU(30mmol/L);
2.4 倒置相差显微镜下观察小鼠肾小管上皮细胞形态的改变
选择合适亮度及瞳距,先以目镜为10×,物镜为4×观察,粗微调焦后使镜下肾小管上皮细胞清晰,切换到10×物镜统一选取培养瓶中央拍照。

图1 各组小鼠肾小管上皮细胞形态及增殖情况(×100)
2.5 MTT法检测细胞增殖
细胞生长至80%左右,0.25%的胰酶1 mL消化,等体积6%FBS的RPMI 1640培养基终止消化;按每孔300 0个细胞种植于96孔培养板上,每组设8个复孔,置培养箱中孵育24 h,无血清RPMI 1640液每孔200 μL培养,细胞同步24 h,使细胞静止于Go期;吸弃旧的培养基,加入相应组别含药血清;继续培养12、24、48、60h甩去96孔板内培养基,各孔加入10 μL终浓度为5 mg·ml-1的MTT溶液及190 μL无血清1640培养基;37℃、CO2恒温培养箱继续培养4 h;甩去各孔培养基,室温避光条件下加入200 μL DMSO(二甲基亚砜,Dimethylsulfoxide),置于摇床上轻轻震荡10 min,450型自动酶标仪检测并记录各孔吸收波OD值(波长492 nm)。
2.6 Western blotting检测各组肾小管上皮细胞中RhoA、ROCK1、α-SMA、E-Cadherin蛋白的表达
取小鼠肾组织匀浆后加1 mL预冷的RIPA裂解液,取上清液。BCA法测蛋白浓度,加上样缓冲液沸水浴5 min进行蛋白变性,制备SDS-PAGE胶、蛋白上样,凝胶电泳80 V,30 min左右,蓝色指示剂到达浓缩胶下缘时,调节电压为120 V继续电泳1.5 h左右终止电泳。恒压转膜60 V 2 h,5%脱脂奶粉室温封闭1 h,TBS(TBS-T)冲洗,分别加β-actin(1∶200 0)、RhoA(1∶500)、ROCK1(1∶500)、α-SMA(1∶200 0)、E-Cadherin(1∶100 0),4℃过夜。加二抗(稀释1∶200 0),置于摇床室温反应1小时,ECL化学发光液显影,应用BIO-RAD曝光成像系统拍照,Image J图像分析进行图像分析;各靶蛋白均与内参β-actin蛋白对照,计算靶蛋白条带与β-actin蛋白条带灰度值的比值作为靶蛋白表达的相对水平。
2.7 统计学方法
用SPSS22.0系统进行数据统计分析,数据用(xˉ±s)表示,组间比较用One-Way ANOVA,P<0.05有统计学差异,P<0.01有显著统计学差异。
3 结果
3.1 肾小管上皮细胞形态
正常培养下小鼠肾小管上皮细胞呈扁平不规则多角形,中央圆形核,细胞融合呈鹅卵石状;高糖刺激后,细胞呈梭形,生长时呈放射状;相应含药血清干预后,胞体由拉长的梭形向扁平不规则多角形发展,见图1。
3.2 糖肾宁对小鼠肾小管上皮细胞增殖的影响
如表1所示,24、48 h时,正常组与模型组比较,有极显著性差异(P<0.01),60 h,正常组与模型组比较,有显著性差异(P<0.05);24 h,糖肾宁组与厄贝沙坦组比较,有显著性差异(P<0.05);48 h,糖肾宁组与厄贝沙坦组、Y27632组比较,有极显著性差异(P<0.01);糖肾宁组与厄贝沙坦组、Y27632组比较,有显著性差异(P<0.05)。
3.3 糖肾宁对高糖培养肾小管上皮细胞RhoA、
ROCK1、E-cadherin、α-SMA蛋白表达的影响
3.3.1 RhoA、ROCK1表达
正常组与模型组、Y27632组比较RhoA蛋白表达减少,有极显著性差异(P<0.01);糖肾宁组与模型组比较,有极显著性差异(P<0.01);糖肾宁组与Y27632组比较,有显著性差异(P<0.05)。正常组与模型组比较ROCK1蛋白表达减少,有极显著性差异(P<0.01);Y27632组、各治疗组和模型组比较,有显著性差异(P<0.05)。

表1 糖肾宁对高糖刺激肾小管上皮细胞增殖的影响(xˉ±s,n=7,OD值)
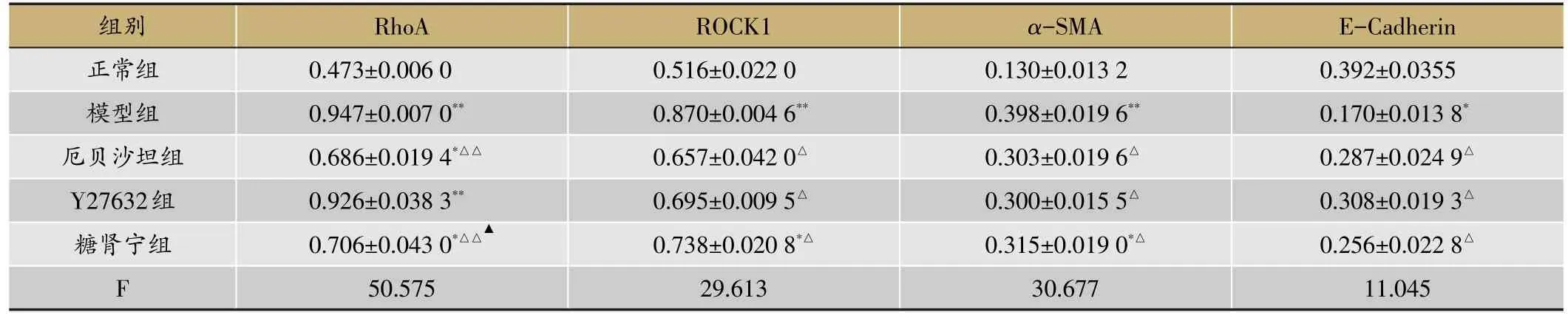
表2 糖肾宁对高糖刺激小鼠肾小管上皮细胞RhoA/ROCK通路蛋白表达的影响(xˉ±s,n=3)
3.3.2 α-SMA、E-Cadherin表达
正常组与模型组比较α-SMA蛋白表达减少,有极显著性差异(P<0.01);Y27632组、各治疗组和模型组比较,有显著性差异(P<0.05)。正常组与模型组比较E-Cadherin蛋白表达增加,有显著性差异(P<0.05);Y27632组与糖肾宁组比较,有显著性差异(P<0.05);模型组与Y27632组、各治疗组比较,有显著性差异(P<0.05)。见表2,图2。
4 讨论

图2 糖肾宁对高糖刺激小鼠肾小管上皮细胞RhoA、ROCK1、α-SMA、E-CAD蛋白表达的影响
DKD是糖尿病常见的严重微血管并发症,其发病机制与血流动力学异常、糖代谢紊乱和遗传等因素有关,其病理改变主要包括肾小球硬化和肾间质纤维化[10,11]。肾小管上皮细胞作为形成肾小管-间质结构的主要细胞之一,其表型转化在肾小管-间质纤维化进展过程中起重要作用。肾小管上皮细胞EMT是 DKD功能丧失的关键因素,糖尿病肾病时,高糖刺激下会加重肾小管间质的损伤。糖尿病肾病时发生肾小管上皮细胞损伤,机体通过细胞增殖起到保护作用,也可以在增殖后进一步转分化为成纤维细胞,分泌致纤维化生长因子加重DKD肾纤维化的进程[6]。因此,通过抑制细胞增殖可以在一定程度上抑制肾小管上皮细胞转分化。研究高糖培养下肾小管上皮细胞增殖与转分化之间的关系变得尤为重要。
中医学中将糖尿病肾病归属于“水肿”、“消渴肾病”、“肾风”等范畴。导师赵宗江教授在整理古代文献的基础上,结合临床实践,提出糖尿病肾病“肾痿”假说:DKD的发生发展,实质上是DM迁延不愈,伤阴耗气,痰郁热瘀互相胶结,积聚于肾脏,损伤“肾体”,结构是功能的基础,导致“肾用”发生改变,肾脏痿废不用,发为“肾痿”[7]。在“肾痿”假说指导下组方的糖肾宁,其药物组成有熟地黄、山萸肉、怀山药、杜仲、炒白芍、淫羊藿、水蛭、酒大黄,其中熟地黄、山萸肉、怀山药滋肾阴补血;淫羊藿、杜仲温肾助阳;炒白芍健脾补虚柔肝;水蛭、酒军活血化瘀解毒,诸药合用可温肾健脾,化瘀解毒,适用于阴阳两虚证、瘀毒内阻证,对DKD具有良好的效果[8]。
糖肾宁不仅在临床上取得了较好的疗效,本课题组前期实验研究也肯定了糖肾宁的疗效[8,9]。前期研究表明糖肾宁可通过提高Smad7、抑制TGF-β1和NF-κB表达来改善DN大鼠糖尿病肾病症状,同时,糖肾宁可通过调控TGF-β1-smad2/3-ILK信号通路抑制足细胞转分化,保障肾小球滤过屏障功能,延缓DKD进程。本次细胞实验是在前期研究基础上,探讨糖肾宁对高糖培养肾小管上皮细胞增殖及转分化的影响,结果表明糖肾宁可以抑制高糖培养下的肾小管上皮细胞的增殖与转分化,降低RhoA、ROCK1和α-SMA蛋白表达水平,升高E-Cadherin蛋白表达水平,逆转肾小管上皮细胞转分化,抑制DKD肾间质纤维化,延缓疾病进程,其具体作用机制有待进一步研究。
1Zhu B,Wu X,Bi Y,et al.Effect of bilirubin concentration on the risk of diabetic complications:A meta-analysis of epidemiologic studies.Sci Rep-UK,2017,7:41681.
2Liu Y,Song Y,Tao L,et al.Prevalence of diabetic retinopathy among 13 473 patients with diabetes mellitus in China:a cross-sectional epidemiological survey in six provinces.Bmj Open,2017,7(1): e013199.
3Jia W,Tong N.Diabetes prevention and continuing health-care reform in China.Lancet Diabetes&Endocrinology,2015,3(11):840-842.
4Zuo H,Shi Z,Hussain A.Prevalence trends and risk factors for the diabetes epidemic in China:a systematic review and meta-analysis. Diabetes Res Clin Pract.2014,104(3):63–72.
5Mansour I,Thajudeen B.Overview of Diabetic Nephropathy.Managing Diabetic Nephropathies in Clinical Practice.New York:Springer International Publishing,2017:1-21.
6Huang S,Susztak K.Epithelial plasticity versus EMT in kidney fibrosis. Trends Mol Med,2016,22(1):4-6.
7赵宗江,豆小妮,张新雪.糖尿病肾病“肾痿”假说探讨.中医杂志, 2011,52(S1):8-10.
8冯丽园.糖肾宁胶囊对糖尿病肾病大鼠肾脏保护作用及其对TGF-β1/ Smad7信号通路影响的实验研究.北京:北京中医药大学硕士学位论文,2010:27-67.
9赵宗江.糖肾宁对DN大鼠TGF-β1-Smad2/3-ILK信号转导通路影响的研究.[C]中西医结合实验医学专业委员会第十二次全国中西医结合实验医学专业委员会暨第七次湖南省中西医结合神经科专业委员会学术年会论文集,中西医结合实验医学专业委员会:2015: 31-32.
10 Gross J L,De Azevedo M J,Silveiro S P,et al.Diabetic nephropathy: diagnosis,prevention,and treatment.Diabetes care,2005,28(1):164-176.
11 Huang L,Khardori R.Pathogenesis of Diabetic Nephropathy.Managing Diabetic Nephropathies in Clinical Practice.New York:Springer International Publishing,2017:23-45.
Effect of Compound Tangshenning on Proliferation and RhoA/ROCK Signaling Pathway of High Glucose-induced Epithelial Cells of Renal Tubules
Wang Ting,Zhao Zongjiang,Zhang Xinxue,Miao Yonghui,Yang Guannan
(College of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100029)
Objective:To study the effect of the prescription Tangshenning on the proliferation of the high glucoseinduced cells of near-end kidney tubules.Method:To prepare durg-contained serum from mice to enter into in vitor reaction system,the cells were randomly divided into 4 groups:the normal group,the model group,the,the irbesartan group,the tangshenning group and then detect the effects of all serum sections on the proliferation of high glucose-induced epithelial cells of kidney tubules by the MTT colorimetric method,and the expression of RhoA,ROCK1,E-cadherin and α-SMA in each group were detected by Western blotting.Result:The high glucose group of renal tubular epithelial cells form from the flat irregular polygon into long fusiform;After adding the drug-containing serum corresponding intervention into the cells into a flat in irregular polygon.The high glucose group of renal tubular epithelial cells show obvious proliferation condition,In the condition of 24 h,48 h,The high glucose group proliferation is better than the normal group(P<0.01),in 60 h,The high glucose group proliferation is better than the normal group(P<0.05);In 24 h,compared with the irbesartan,Tangshenning has better effect of inhibiting the cell proliferation(P<0.05); In 48 h,Tangshenning has the better effect than irbesartan and Y27632(P<0.01);In 60 h,Tangshenning has the better effect than irbesartan and Y27632(P<0.05);Western blotting:Western blotting analysis showed that compared with the normal group,the expression of RhoA protein in high glucose group and Y27632 decreased(P<0.01);The high glucose group and Tangshenning have significant difference(P<0.01);Y27632 and Tangshenning have difference(P<0.05). compared with the normal group,the expression of ROCK1 protein in high glucose group decreased(P<0.01);The high glucose group,Tangshenning,the irbesartan and Y27632 have difference(P<0.05).Compared with the normal group,the expression of α-SMA protein in high glucose group decreased(P<0.01);The high glucose group,Tangshenning,the irbesartan and Y27632 have difference(P<0.05).Compared with the normal group,the expression of E-Cadherin protein in high glucose group increased(P<0.05).Y27632 and Tangshenning have difference(P<0.05).The high glucose group, Tangshenning,the irbesartan and Y27632 have difference(P<0.05).Conclusion:The prescription Tangshenning is able to inhibit the proliferation of high glucose-induced epithelial cells of kidney tubules and and can reverse renal tubularepithelial cell transdifferentiation via regulating RhoA/ROCK signaling pathway,and restrain renal interstitial fibrosis, thereby delaying the pathogenesis of diabetic kidney disease.
Tangshenning;consumptive kidney disease;Renal Tubular Epithelial Cell Line;KKAy Mouse;Cell Proliferation;MTT;EMT;RhoA/ROCK signaling pathway
10.11842/wst.2017.06.028
000
A
2017-04-28
修回日期:2017-06-18
*国家自然科学基金委面上项目(81373831):基于“肾痿”组方的糖肾平干预糖尿病肾病肾小管上皮细胞转分化的分子机制研究,负责人:赵宗江。
**赵宗江,教授,博士生导师,主要研究方向:中医药防治糖尿病肾病的机制研究。

