再议新形势下中药创新药物的发现与研发思路*
姜勇,李军,屠鹏飞,**
再议新形势下中药创新药物的发现与研发思路*
姜勇1,李军2,屠鹏飞1,2**
(1.北京大学药学院天然药物及仿生药物国家重点实验室北京100191;2.北京中医药大学中药学院中药现代研究中心北京100029)
本文根据近年来中国药监管理和审评部门对中药创新药物的认识和审批要求的变化,结合生命科学的快速发展,归纳并提出中药创新药物发现的5种途径:中药有效成分及其创新药物的发现、中药有效部位新药及其复方制剂的发现、基于经典名方的创新药物的发现、基于临床有效方剂的创新药物的发现和基于名优中成药的创新药物发现,并对以上途径的研究思路进行详细阐述;对中药创新药物的药学研究,包括生产工艺、化学成分、质量研究、质量标准、稳定性等研究内容提出一些新的思路,以供业内人士参考和批评指正。
中药创新药物有效成分新药有效部位新药经典名方研究思路药学研究
中医药为中华民族数千年来与疾病斗争的智慧结晶,具有丰富的临床实践经验和完整的理论体系,是世界传统医药中最璀璨的一颗明珠。随着《中华人民共和国中医药法》的颁布与实施,中医药将迎来前所未有的发展机遇。在中医药理论指导下组方或以中药为资源发现和研发创新药物,一直是中国新药创制的重要途径,中国原创并得到国际认可的创新药物如青蒿素、石杉碱甲、丁苯酞等都来源于中药。中国自1985年实施《药品管理法》至今已有30多年,批准上市了一大批确有疗效、安全性高的中药创新药物,产生了一批中成药大品种,为临床用药和产业发展做出了巨大贡献。但随着经济和科技的不断发展,以及人民健康需求的不断提升,中国对中药新药的注册要求也在不断提升,特别是国家食品药品监督管理总局药品审评中心最近提出“以临床价值为导向的药物创新”的理念和实施药物临床优效性评价,一方面将药物回归到治疗疾病的本质,另一方面,也给中药新药的研发提出了新的要求和挑战。同时,近20年来生命科学的飞速发展,很多疾病的发病机制和相关基因都逐渐得到阐明,为药物的发现提供了一批新的靶点和筛选模型。因此,中药创新药物的发现和研发也将发生重大的改变。为了促进中国中药创新药物的发展,我们曾于2015年撰文对新形势下中药创新药物的发现与研发进行了讨论[1],随着近2年相关形势和政策的变化,本文再次对中药创新药物的发现和研发思路进行讨论,并重点对新形势下中药创新药物的药学研究提出我们的研究思路,以供业内人士参考和批评指正。
1 新形势下中药创新药物发现的途径与思路
1.1 中药创新药物发现途径
根据国家食品药品监督管理总局颁布的《药品注册管理办法》(局令第28号)和《中药注册管理补充规定》(国食药监注[2008]3号)以及此后发布的中药新药注册相关的文件规定,中药新药发现的途径可以归纳为5个途径(图1):中药有效成分及其创新药物、中药有效部位及其复方制剂、基于经典名方的创新药物、基于临床有效方剂的创新药物、基于名优中成药的创新药物。
1.2 中药创新药物发现思路
根据各类中药创新药物的来源、特点和发现过程,下面对各类中药创新药物的发现过程及其研究思路进行详述。
1.2.1 中药有效成分及其创新药物的发现
中药有效成分新药系指对中药(包括文献古籍记载的单味中药及其复方、民族民间药物、临床名方和名优中成药)进行系统的活性成分研究,发现具有临床使用价值的活性化合物,再进行系统的药效、药代、安全性和临床评价,研发而成的单体化合物新药。根据法规规定,单体化合物的含量必须大于90%。其研究过程一般是收集样品后,根据传统使用方法结合其所含化学成分的性质,选择合适的溶剂进行提取,得到提取物,采用整体动物模型或体外活性筛选进行药效或活性评价(以整体动物试验为主)。确证具有确切的药效作用或生物活性后,再在活性追踪下(以体外活性筛选为主),结合LC-MS和NMR等高效化学成分分析,对活性成分进行追踪分离和结构鉴定,发现活性成分。采用整体动物试验,对活性成分进行药效确证和药代动力学、安全性初步评价,确定活性成分是否具有临床使用价值和开发前景。对于具有临床使用价值和开发前景的有效成分,按照中药有效成分新药的有关要求进行系统的药学、药理毒理和临床研究,将其研发成为有效成分创新药物。
中药活性成分研究发现的多数活性化合物尽管具有确切的药效作用,但由于药效作用不够强,或药代、安全性等方面存在的问题,没有临床应用价值,不能直接开发成为新药,这类化合物被称为“活性先导化合物”。对于活性先导化合物,我们应对其进行结构改造和构效关系研究,根据构效关系研究结果,设计并合成出药效强、药代行为好、安全性高的理想化合物,再将其研发成为新药。目前临床一线使用的小分子药物,近30%都是以天然活性化合物为先导结构,通过结构优化得到的药物,因此,这一途径是原创药物发现的重要途径。另外,有些活性化合物,其本身药效不强,甚至没有药效作用,或药代行为不理想,但其代谢产物可能药效作用很强或药代行为很好,对这类化合物可以进行体内代谢研究,对代谢产物进行活性筛选,发现具有临床使用价值的代谢产物,再将其研发成为新药。这两类新药在法规上都属于“化学药”,但他们本质上都是来源于中药的创新药物。中药有效成分及其创新药物发现思路见图2。
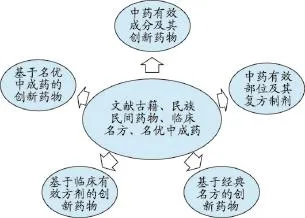
图1 中药创新药物发现途径
由于中药所含成分非常复杂,每种药材所含成分都在数百种,甚至上千种,中药复方的成分就更加复杂;多数活性成分含量很低,数十公斤甚至上百公斤原料最后分离得到的微量化合物往往只有几十毫克、几毫克,甚至微克级。因此,中药活性成分或有效成分的发现,当前急需解决两个方面主要关键技术:中药微量成分的快速识别与高效分离技术、微量天然产物活性高效筛选技术。当前快速发展的LC-MS和NMR等分析技术,给中药微量成分的快速分析、识别和鉴定提供了有效的方法;快速发展的色谱技术和色谱填料,尤其是多维色谱技术,有效提升了中药微量成分的分离和制备效率。但是,如何高效去除常量成分,发现和分离微量成分,仍然制约着中药微量成分的快速识别和高效分离;同时,针对中药性质差别很大的各类成分的色谱填料仍然缺乏,如强极性和水溶性成分、生物碱类成分等,仍然缺乏高效的分离填料,即使中等极性的成分,当前色谱填料的分离效率仍需进一步提升。中药成分的活性筛选,当前主要采用细胞水平和靶酶水平的高通量筛选,由于中药成分的微量性,一方面不能进行广泛的活性筛选,另一方面,发现体外具有活性的成分,无法进行体内活性确证,导致大部分中药成分只能停留在体外简单的活性筛选水平,造成大量的资源浪费。因此,建立适合于微量天然产物的活性高效筛选技术,特别是能够代替整体动物试验的微量成分药效确证技术,是中药和天然产物活性成分发现的关键。当前快速发展的微流控芯片技术,具有化合物用量少、高通量、高内涵、速度快等特点,尤其是通过多种细胞的立体培养能够仿真动物各种器官,已显示出微量天然产物活性筛选的优势,但这项技术目前仍然处于起步阶段,尚需进一步的提高与完善。

图2 中药有效成分及其创新药物发现思路
尽管中药有长期的临床实践基础,与天然产物相比,发现有效成分的几率大大提升,但对于中药有效成分的发现,仍然需要进行大规模的筛选,因此,规模化的中药成分和天然产物库构建,也是中药活性成分发现的关键。国际上大型制药企业都有数量数十万、上百万的化合物库,一旦有新模型、新靶点,就能够很快从库里筛选出活性成分,而中国的制药企业基本不重视化合物库的建立,各个研究单位也只有数量非常有限的化合物,严重制约了中国原创药物的发现。根据中国当前的实际情况,应该从国家层面建立化合物库,这样才能切实解决化合物的来源问题。
生物活性筛选是活性化合物或创新药物发现的眼睛,种类丰富的生物活性筛选体系和规范化筛选平台是原创药物发现的最重要技术体系。国际上大型制药企业都建立了完善的药物筛选平台,美国NIH也专门建立了服务于全球的药物筛选平台。而中国制药企业极少有建立药物筛选体系的,一些科研单位或实验室尽管建立了生物活性筛选体系,但由于缺乏实力和人才队伍,其筛选模型很少,筛选工作很不规范,筛选结果可靠性差。因此,根据中国目前的实际情况,国家应该发挥举国体制的优势,与前述的“国家化合物库”一起,统一建立“国家药物筛选中心”,为全国提供筛选服务,这样既节约筛选成本,又能提高筛选效率和筛选质量。近20年来,中国的化学和生物学研究水平提升很快,如果国家能够集中全国的优势资源,建立“国家化合物库和筛选中心”,静下心来进行脚踏实地的大规模筛选,而不是做文章,相信中国的原创药物就会源源不断地产出。
1.2.2 中药有效部位新药及其复方制剂的发现
中药有效部位是指对单味中药或中药复方提取物进行活性筛选,发现某一部位或某类成分、或数类成分的组合具有明显的药效作用,经整体动物药效评价和初步安全性评价,确定具有临床使用价值和开发前景,再按照新药研发的技术要求研发而成的创新药物,如丹参总酚酸、三七总皂苷、苁蓉总苷、龙血竭酚类提取物等。中药有效部位的复方制剂是指根据中医药配伍理论合理组方,结合现代药理试验的配伍筛选得到的有效部位复方制剂。
中药有效部位仍然是某类或某几类成分的混合物,具备中药特有的多成分、多靶点作用特点,只是除去了无效或低效成分,使中药疗效更强、作用更加专一,尤其是根据中医药理论进行组方的中药有效部位的复方制剂,既体现中药复方配伍的特点,又体现中药现代化优势,是中药创新药物发现的重要方向。中药有效部位新药及其复方制剂发现思路见图3。
中药有效部位新药的发现和研发,关键在于有效部位的筛选和确认,也就是“立题的依据”。以前申报的很多有效部位新药,其有效部位的确认多数来源于文献,或该中药主要含什么成分,就分离什么成分,未进行系统的有效部位筛选,在“立题依据”中不能提供有效部位确认的研究资料,导致新药申报失败。因此,对于有效部位新药,必须进行系统的有效部位筛选和确认。最简单的办法是将有效部位和认为的无效部位进行药效比较,确认除去的无效部位确实没有药效或没有明显的药效。另外,以前对于有效部位的新药,对有效部位的含量是有要求的,在新药审评中,要求有效部位提取物中结构明确的成分含量达到50%以上,这也是导致一些有效部位新药申报失败的重要因素。但国家食品药品监督管理总局正在修订的有关中药新药注册管理办法有可能不再要求单味中药研发的新药,其结构明确成分的含量一定要大于50%,这将给单味中药新药的研发提供广阔的前景,也避免以前为了提高几个百分点的含量,而增加了多步复杂的纯化工艺,提高了生产成本和原料消耗。
对于有效部位的复方制剂,要求处方中各单味药的有效部位都必须进行制备工艺、质量标准、稳定性等药学研究,这样导致不同复方制剂处方中用到的同一单味药,在每个有效部位复方制剂申报中都必须进行相关的药学研究,造成大量的重复工作和人力、物力的浪费。为此,建议国家立项组织对常用中药的有效部位进行研究,建立常用中药有效部位的制备工艺和质量标准,并收入《中国药典》,这样就可以直接利用有效部位的提取物进行组方。如果我们能够将200种常用中药有效部位提取物收入药典,采用这些有效成分含量高、化学成分基本明确、质量易于控制的有效部位提取物直接进行组方,这将大大提升中国中药新药的研发水平、制剂水平和质量控制水平。
1.2.3 基于经典名方的创新药物的发现与研发

图3 中药有效部位新药及其复方制剂发现思路
中医药具有数千年临床使用历史,我们的祖先在与疾病斗争的过程中,形成了数以万计的临床方剂,仅《普济方》就收载了六万余首方剂,为中药创新药物的研发提供了丰富的资源。从中药经古方中筛选有效方剂进行开发,长期以来一直是新药研发的重要方向。但由于时代的变迁、人类基本体质、生存环境和饮食结构的变化,以及疾病本身的变化,古代的方剂不一定完全适合于现代疾病的治疗,因此,利用经古方进行新药研发,必须对处方进行筛选,选择针对中医药优势病种、目前临床仍大量使用的处方,必要时根据病证状况,对原方进行加减化裁。
为了促进中医药的继承与创新,更好地发挥中医药在健康事业和产业发展中的作用,《中药注册管理补充规定》(国食药监注[2008]3号)将中药经古方的开发分为二类,一类是符合“处方中不含毒性药材或配伍禁忌;处方中药味均有法定标准;生产工艺与传统工艺基本一致;给药途径与古代医籍记载一致,日用饮片量与古代医籍记载相当;功能主治与古代医籍记载一致;适用范围不包括危重症,不涉及孕妇、婴幼儿等特殊用药人群。”等六条规定的清朝以前的处方,可仅提供非临床安全性研究资料,并直接申报生产。不需要进行药效学和临床试验,但其处方目录由国家中医药管理局统一制定。2017年7月1日开始实施的《中华人民共和国中医药法》也对相应的内容进行了规定,可见国家对中医药事业的重视。第二类是按照正常的中药复方制剂要求进行研发的新药。由于第一类属于特殊情况,本文不作讨论。本文仅对第二类来源于经典名方的中药新药的研发思路进行讨论,总体研究思路见图4。

图4 基于经典名方的创新药物的发现与研发思路
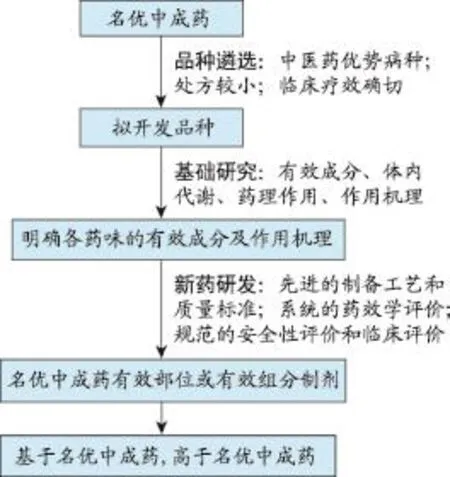
图5 基于名优中成药的创新药物发现与研发思路
对于来源于经典名方的中药新药的研发,可以按照一般中药复方制剂新药研发的有关要求进行研发。但我们认为既然是经典名方,好事就应该做好,一步到位,避免上市后又进行二次研究、二次开发,结果想提升也没法提升,就像现在的“名优中成药二次开发”,只能在不改变工艺的前提下做简单的修补和提升。因此,提出中药经典名方研发“基于六类,高于六类”的研究思路,即,首先对经典名方进行系统的基础研究,阐明其物质基础、体内过程和作用机制,在此基础上,提取处方中的有效物质,将其研制成为工艺和剂型先进、服用剂量小、疗效确切、安全性高、物质基础明确、作用机理清楚、质量稳定可控的现代中药。
1.2.4 基于临床有效方剂的创新药物的发现与研发
中药不同于化学药,很多中药是在临床通过汤剂直接应用过程中发现其疗效的。中国有大量的中医临床医院和诊所,他们在长期临床实践中积累了丰富的有效方剂,包括大量处方固定的医院制剂,为中药新药的研发提供一大批疗效确切的临床方剂。因此,基于临床有效方剂的创新药物研发一直是中药新药研发的主要方向之一,清开灵注射液、复方丹参系列、尪痹系列、脑心通胶囊、通心络胶囊等一大批名优中成药均来源于临床方剂。对于临床有效方剂的新药研发,按照中药复方制剂新药研发的一般要求进行规范化研发就可以,大家都非常熟悉,在此不再详述。但对于这类方剂的筛选和研发,必须注意二点:①处方药味不能太多,主治病证应明确;②应该提供一定数量的规范化的临床试验数据,为立题依据提供有力的支撑。
1.2.5 基于名优中成药的创新药物发现与研发
名优中成药为临床长期使用确有疗效、安全性高、已具有较大的知名度和市场份额的中成药,对名优中成药进行系统的药效物质、体内代谢、药理作用与作用机理研究,阐明其主要药效物质和作用机理,再采用现代提取纯化技术,提取其有效部位或有效组分,将其研制成为工艺和剂型先进、服用剂量小、疗效确切、安全性高、药效物质明确、作用机理清楚、质量稳定可控的现代中药。基于名优中成药的创新药物发现与研发,具有疗效确切、研发风险小、市场容易开拓等优势,是中药新药创制的一个新的方向,其发现与研发思路见图5。
2 新形势下中药创新药物药学研究思路
新药药学研究主要包括生产工艺研究、化学成分研究、质量研究、质量标准研究和稳定性研究等内容。新药的药学研究不同于其他研究,如药理毒理研究、临床研究,治疗相同疾病的不同新药,其研究(实验)方法、检测指标基本相同,容易对这些研究进行规范,制定规范的技术指导原则,而且新药批准上市后,这些研究内容不再有人去重复。而药学研究则完全不同,不仅每个新药的研究内容和检测指标不同,而且新药批准上市后,企业只要生产,生产工艺必须天天重复;质量标准也必须用于每批产品的检验,且新药销到什么地方,什么地方的药品检验机构也都要检验;稳定性研究是考察药品包装和贮藏条件、确定药品有效期的依据,其研究结果也会影响药品的整个生命。因此,药学研究不能仅仅考虑新药是否能够获得批准,更要考虑新药上市后生产工艺的工业化、规模化和生产成本,质量标准的重现性和可控性,药品包装、贮藏条件和有效期制定的合理性。以前多数新药研究没有考虑这些问题,想着尽快完成研究资料、批准上市,造成很多新药批准后无法进行正常生产,质量标准也难以达到。大部分新药标准转正时,都提出修改工艺和质量标准,有些新药尽管没有提出,实际上生产工艺也发生了改变。随着CFDA对药品生产GMP检查越来越严,今后这些药品将面临着无法生产的艰难局面。因此,今后研发新药,必须认清形势、改变思路,在新药批准上市前完善生产工艺和质量标准,制定合理的有效期,实现注册的新药能够顺利生产销售。
2.1 中药新药生产工艺研究
中药新药生产工艺包括原料前处理、提取、纯化、浓缩、干燥、制剂处方及其成型、包装等过程。生产工艺研究的目的是在保障目标提取物和制剂质量的前提下,建立一套工艺过程相对简单、生产成本相对较低、能够实现工业化生产的稳定的工艺。作为药品,建立的生产工艺应该满足三大要求:①工艺能够实现工业化大生产;②能够实现终产品的质量一致性;③合理的生产成本。因此,我们将新药的生产工艺研究分为三个阶段。
第一阶段:生产工艺的初步建立阶段。在实验室,对原料的前处理、提取、纯化、浓缩、干燥、制剂处方和制剂成型工艺进行研究,中药复方制剂以各单味药主要成分含量和指纹图谱为考察指标,中药有效部位制剂以有效部位中主要成分含量和指纹图谱为考察指标,有效成分新药以有效成分含量为考察指标,重点考察不同工艺条件下各成分的提取率、转移率和指纹图谱的变化状况,优化生产工艺参数,明确工艺过程中主要成分的转移和质量传递情况,明确主要影响因素和关键的质量控制点,初步建立生产工艺。
第二阶段:中试与生产工艺建立阶段。在初步建立实验室水平的生产工艺的基础上,进行多批的中试生产,根据中试生产的设备和条件,以主要成分含量测定结合指纹图谱检测,对工艺参数进行调整,进一步明确生产过程中主要成分和质量传递情况以及主要影响因素,建立生产工艺。连续生产三批样品,供药效学、毒理学和质量标准研究。值得注意的是,中试生产所用的设备和生产条件与实验室完全不同,其工艺参数必然会发生明显的变化,应该根据中试生产的实际情况调整工艺参数。以往药品审评中过分强调中试与实验室工艺参数的一致性,导致很多新药申报的工艺参数造假。
第三阶段:大生产与工艺完善阶段。在申报临床的过程中,或批准临床后,必须进行大生产,根据企业工业化生产设备和生产条件,进行多批生产试验,以主要成分含量测定结合指纹图谱检测,明确工业化生产过程中主要成分和质量传递情况以及主要影响因素,最终确定工业化生产工艺参数,明确质量控制关键环节和控制指标,建立工业化生产工艺。连续生产三批样品,供临床研究。
在生产工艺研究和工艺完善中需要注意以下问题:
(1)目前工艺研究常采用正交试验或均衡设计等方法进行工艺过程中影响因素和水平的考察,这无疑是更加科学、全面的考察方法,但这些方法是告诉我们哪些因素发挥主要作用,各因素在水平上的变化趋势,而不是直接选取最大值,否则正交试验和均衡设计就失去意义。因此,我们还要根据变化趋势设计多个水平进行进一步的验证,同时结合经济学评价,最终确定工艺参数。不能为了仅仅提高几个百分点的提取率或含量,而大大提高生产成本,或浪费大量溶剂、能源。
(2)中药复方传统多数采用混合提取或共煎,主要原因是大家认为共煎与单煎提取出来的成分不同,且共煎可能会发生化学反应。20多年的研究表明,共煎与单煎相比,确实对提取的成分有影响,但主要是互溶作用对有些成分增加了溶解度。只有少数酸性、碱性成分,如小檗碱与甘草酸,能够发生化学反应,但这些简单的反应,口服后在胃酸环境下,很容易游离出来。这些互溶作用通过提取溶剂、提取方法的选择完全可以解决这些问题。而对于工业化大生产,单独提取,不管从提取效益、后续的精制纯化和提取过程控制,都比混合提取或共煎更加容易控制,因此,我们建议中药复方的提取尽可能采取单独提取。
(3)作为药品,制备工艺研究和工艺过程控制的目的是将质量不一致原料生产出质量一致的产品。为此,我们必须采取一些工艺措施,实现终产品的质量一致性。实现质量一致,首先必须对原料的质量进行控制,固定基源、固定产地、固定采收加工方法,必要时对原料进行调配投料;然后对生产过程各项工艺参数进行严格的控制;最后,采用提取物调配投料。因此,对于中药复方新药,其处方组成最好是提取物,而不是饮片。现在药品审评中心已明确表示可以采用提取物组方。
(4)长期以来,中药制剂研究和制剂水平一直非常落后,申报的大部分中药新药的制剂研究,基本上是只有成型研究,没有制剂学研究,导致很多中成药的疗效不能很好地发挥。因此,我们必须重视中药新药的制剂学研究,固体制剂研究过程中,应该考察溶出度,必要时考察生物利用度。目前分析技术的发展,已经为复杂体系的溶出度研究和生物利用度研究提供了有效的方法。
2.2 中药新药的化学成分研究
长期以来,中药新药的化学成分研究一直未能引起重视,除有效成分新药和部分有效部位新药外,大部分新药都没有开展化学成分研究,而此项内容仅仅根据文献报道的单味药材中的化学成分进行综述,与新药终产品实际上含有的成分可能完全不同。因此,现有的化学成分研究资料几乎形同虚设。
在科学技术如此发达的今天,我们研制的新药仍然对其物质基础几乎所知甚少,这无论如何是说不过去的。因此,建议新药研究过程中,应该对制剂成型前的提取物进行化学成分研究,阐明其主要化学成分,最起码也采用LC-MS方法对其进行化学成分分析,为后期质量标准的建立、药代动力学研究和作用机制研究奠定物质基础。
2.3 中药新药的质量研究
中药质量研究包括单味药和复方制剂的质量相关的分析研究及其文献资料的综述。长期以来,此项内容基本上都是文献资料的综述,很少进行研究。随着中药质量控制水平和标准的提升,全面开展中药新药的质量分析研究,在此基础上,建立科学、合理、可控的质量标准是中药发展的必然趋势,因此,中药新药的质量研究将会逐步得到重视。作为新形势下高水平的新药,应该开展系统的质量研究,包括处方药味中每味药的定性鉴别和主要成分的含量测定,指纹图谱检测,重金属及有害元素、农残、真菌毒素、有机溶剂残留(如果生产工艺中涉及有机溶剂)、原料本身含有的有毒有害成分等的检测,这些研究将为标准的制定提供科学依据。
2.4 中药新药的质量标准研究
目前中成药质量标准内容包括性状、鉴别、检查、指纹图谱(仅注射剂要求)、含量测定等。对于复方中成药,其鉴别一般仅为处方药味的1/3以下,还有2/3以上的药味没有鉴别;含量测定也仅有针对1-2味药的少数指标,大部分药味的质量不能得到控制。这样的质量标准能够控制的水平很低,远远达不到有效控制药品质量的目标,也与现代科技发展不相适应。
为了有效控制药品质量,建议对处方药味中的每味药进行鉴别研究,条件成熟的尽可能收入标准,保证人民能够“吃真药”的起码要求。对处方中主要药味进行含量测定研究,尽可能建立多成分含量测定。自1998年国家药监局提出中药注射剂建立指纹图谱检测标准,并于2000年发布《中药注射剂指纹图谱研究技术指导原则(试行)》以来,已经有近20年的时间,长期的研究和实践表明,指纹图谱对于中药质量控制确实非常有效,而且现代先进的色谱仪器,也使指纹图谱检测变得简单易行,因此,建议推广指纹图谱在中药新药质量标准中的应用,实现多成分含量测定加指纹图谱整体质量控制的目标,逐步实现人民“吃好药”的目标,同时也能通过标准有效地保护药品的知识产权。
与中药生产工艺研究相配合,中药新药质量标准研究可以分为二个阶段。第一阶段为标准的建立阶段,按照中成药质量标准的要求建立新药质量标准,包括性状、鉴别、检查、指纹图谱、含量测定等内容,申报临床。第二阶段为标准的完善阶段,临床期间,一方面继续对标准的检测方法和检测指标进行补充和完善,同时根据多批大生产的成品数据,对标准中的各项指标进行进一步完善,包括检查和含量测定中的限幅度、指纹图谱的相似度等指标,使制定的标准既能有效控制药品质量,也能切实可行,避免出现新药上市后马上又提出修订标准的不良现象。
2.5 中药新药的稳定性研究
新药稳定性研究是考察药品包装、贮藏条件和制定有效期的一项工作,对药品的上市非常重要。由于中国地域广阔,气候条件相差很大,药品稳定性研究除了按照技术指导原则进行研究外,应重点考察温度和湿度对药品稳定性的影响,并重点以多成分含量测定和指纹图谱为考察指标进行考察,深入了解温度和湿度对药品内在成分的影响,为药品包装、贮藏条件和有效期的制定提供科学依据。
参考文献
1屠鹏飞,姜勇,郭晓宇.新形势下中药创新药物的发现与研发.中国中药杂志,2015,40(17):3423-3428.
ResearchApproaches on Discovery R&D of Innovative Drug of Chinese Materia Medica under New Situations
Jiang Yong1,Li Jun2,Tu Pengfei1,2
(1.State Key Laboratory of Natural and Biomimetic Drugs,School of Pharmaceutical Sciences, Peking University,Beijing 100191,China;2.Modern Research Center for Traditional Chinese Medicine, School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100029,China)
In recent years,with the rapid development of life sciences,changes on the understanding and requirements for innovative drugs of Chinese materia medica(CMM)from the drug approval authorities have been made.In this paper, the discovery,research and development(R&D)approaches for innovative drugs of CMM under new situations were summarized and introduced in details from five aspects as follows.The discovery of innovative drugs from active components of CMMs,active fractions of CMMs and their compound preparations,famous classic prescription,clinically effective prescriptions as well as the famous Chinese patent drugs.This paper puts forward some new ideas for the pharmaceutical researches of innovative drugs of CMM,including the production process,chemical components,quality study,quality standard and stability.This paper provided references for the discovery,R&D of CMM.
Innovative drug of Chinese materia medica,new drug of active component,new drug of effective fraction, famous classic prescription,research approach,pharmaceutical research
10.11842/wst.2017.06.002
R2-03
A
(责任编辑:马雅静,责任译审:王晶)
2017-03-20
修回日期:2017-05-20
*科学技术部国家“重大新药创制”科技重大专项(2017ZX09101003-008-003);天然药物活性组份的快速发现技术-基于分子生物色谱和仿生微流控芯片的天然活性组分的发现技术,负责人:屠鹏飞。
**通讯作者:屠鹏飞,本刊编委,教授,博士生导师,主要研究方向:天然药物活性成分与新药研究,中药质量分析。

