糖肾宁对糖尿病肾病KKAy小鼠的肾脏保护作用及其对Notch/Snail1信号转导通路的影响*
杨冠男,赵宗江,张新雪,杨美娟
糖肾宁对糖尿病肾病KKAy小鼠的肾脏保护作用及其对Notch/Snail1信号转导通路的影响*
杨冠男,赵宗江**,张新雪,杨美娟
(北京中医药大学中医学院北京100029)
目的:明确糖肾宁是否通过干预Notch/snail1通路抑制KKAy小鼠糖尿病肾病肾小管上皮细胞转分化肾间质纤维化。方法:KKAy小鼠30只,经过10周专用鼠料饲养,血糖>16.7 mmol·L-1,24 h尿蛋白>0.4 mg为糖尿病肾病动物模型。造模成功小鼠按血糖和体质量分层随机分为模型组、厄贝沙坦组与糖肾宁组,灌胃给药,雌性C57BL/6J小鼠10只作为正常对照组。检测小鼠一般状况,称体重、测24 h尿蛋白定量。干预16周后取材,检测血糖、尿素氮(Blood Urea Nitrogen,BUN)、血清肌酐(Serum creatinine,Scr);肾组织行HE、Mallory染色。原位杂交及Western blotting法检测小鼠肾组织中Notch/snail1通路、α-SMA、E-Cadherin蛋白及mRNA表达。SPSS20.0软件进行统计学处理。结果:与模型组比较,糖肾宁组小鼠一般状态改善,体质量、24 h尿蛋白定量显著减少(P<0.01),血清BUN及Scr含量降低(P<0.01,P<0.05),病理染色显示肾间质纤维化明显减轻,糖肾宁组肾组织Notch/snail1通路和α-SMA蛋白及mRNA表达明显降低,有显著统计学差异(P<0.01),E-Cad蛋白及mRNA表达显著升高(P<0.01)。结论:糖肾宁可以保护糖尿病肾病肾功能,延缓糖尿病肾病进展,抑制糖尿病肾病肾小管上皮细胞转分化肾间质纤维化,改善糖尿病肾病EMT的机制可能是通过抑制Notch/snail1通路表达实现。
糖尿病肾病糖肾宁肾痿KKAy小鼠肾小管上皮细胞转分化Notch/snail1信号转导通路
糖尿病已成为继心脑血管疾病、恶性肿瘤后的第三大威胁人类健康的慢性非传染性疾病,它所带来的多种并发症尤其是糖尿病肾病严重影响了人们的生活质量[1],糖尿病肾病的最终结局为终末期肾病,而肾间质纤维化是各种慢性肾脏疾病进展到终末期肾衰时的共同途径和主要的病理改变[2];超过1/3的间质成纤维细胞是由局部肾小管上皮细胞发生的上皮-间质转分化(Epithelial Mesenchymal Transition,EMT)而来,所以EMT可能是导致肾间质纤维化发生的最重要的机制之一[3]。EMT是一个非常复杂的过程,有大量的基因、分子、蛋白、通路参与其中。形成了互相联通影响的复杂的网络调控系统,Notch通路及核转录因子snail1被证实是糖尿病肾病中介导上皮细胞转分化和体内其他细胞纤维化的重要分子[4,5]。就目前治疗手段及药物来看,现代医学治疗糖尿病肾病主要降糖、降压、降脂类及抗炎症角度进行治疗,疗效多一般,不良反应众多,作用机制也不是很明确,并且药物多是作用于糖尿病肾病早期,对糖尿病肾病后期肾小管上皮转分化及肾间质纤维化研究甚少。大量的研究表明,中医药治疗糖尿病肾病的临床应用十分广泛,中医学在辨证论治、个体化治疗方面有相当优势。导师赵宗江教授研究总结大量文献资料,并结合其多年丰富的临床经验,提出糖尿病肾病“肾痿”假说,发现气阴两虚、痰瘀互结为糖尿病肾病的主要证型,并由理论指导临床,糖肾宁既是根据“肾痿”假说组方遣药,临床治疗糖尿病肾病疗效显著[6]。本实验应用类似于人2型糖尿病病理过程最为类似的KKAy小鼠作为模型,研究糖肾宁对DN KKAy小鼠肾脏保护作用及对Notch/snail1信号转导通路的调控作用,以期为研究糖肾宁防治DN的机制及“肾痿”假说提供新的实验依据。
1 实验材料
1.1 实验动物
30只SPF级8-10周龄健康雌性KKAy小鼠和10只SPF级8-10周龄健康雌性C57BL/6J小鼠均购自北京华阜康生物科技有限公司,许可证编号:SCXK京2014-0004;KK鼠专用配合饲料(北京华阜康生物科技有限公司,专利号:CN102648734A,11003800003551);普通鼠饲料(北京华阜康生物科技有限公司,11003800004265)。实验小鼠置于洁净动物橱(北京文慧净化设备厂制造,专利号:EJ932041477)中饲养,适应性喂养1周,普通饲料进食,自由饮水。
1.2 主要试剂
糖肾宁(熟地黄6 g、山萸肉3 g、怀山药3 g、杜仲2 g、炒白芍2 g、淫羊藿2 g、水蛭2 g、酒大黄2 g,北京中医药大学中药学院制剂室制备,批号:2016019);厄贝沙坦片(赛诺菲制药有限公司,国药准字J20130049)。免疫组化及Western Blotting一抗:Jagged1(美国Novus公司,批号:NB600-1161);Notch1(英国Abcam公司,批号:ab52627);Hes1(美国Cell Signaling公司,批号:11988);Snail1(美国Novus公司,批号:NBP1-80022);α-SMA(英国Abcam公司,批号:ab32575);E-Cadherin(英国Abcam公司,批号:ab76055);山羊血清封闭液(北京中杉金桥生物技术有限公司,批号:WK153325);Triton(美国Sigma公司,批号:9002-93-1);二抗:山羊抗兔(英国Abcam公司,批号:ab6721);山羊抗鼠(英国Abcam公司,批号:ab6789);Jagged1、Notch1、Hes1、snail1、E-Cad、α-SMA原位杂交试剂盒(武汉博士德生物工程有限公司)。通用型蛋白酶抑制剂混合物-浓缩液型(德国Merck公司,批号:539134);蛋白抽提试剂(德国Merck公司,71009-3CN);5×SDS-PAGE蛋白上样缓冲液(北京普利莱基因技术有限公司,批号:B1012);甲叉丙烯酰胺(美国Ameresco公司,批号:2890B065);4×浓缩胶buffer(北京普利莱基因技术有限公司,批号:B1003);TEMED(美国Ameresco公司,批号:0761-50 mL);4×分离胶缓冲液(北京普利莱基因技术有限公司,批号:B1004);甘氨酸(美国Ameresco公司,批号:0903C253);过硫酸铵(北京普利莱基因技术有限公司,批号:A1004);甲丙烯酰胺(美国Ameresco公司,批号:1209B082);SDS(美国Ameresco公司,批号:1380B247);Tris(美国Ameresco公司,批号:2044C520);厚滤纸(美国Bio-rad公司,批号:1703932);Millipore-PVDF膜(德国Merck公司,批号:IPVH00010);封闭专用脱脂奶粉(北京普利莱基因技术有限公司,批号:P1622);杂交袋Western blotting专用(北京普利莱基因技术有限公司,批号:E1205);预染色蛋白Marker(北京普利莱基因技术有限公司,批号:P1103);MilliporeECL超敏发光液(德国Merck公司,批号:WBKLS0100)。
2 实验方法
2.1 DN KKAy小鼠模型的建立与分组
所有小鼠适应性喂养1周,自由进食饮水,KKAy小鼠进食KK鼠专用配合饲料;C57BL/6J小鼠进食普通饲料。诱导喂养10周后,尾静脉采血测血糖,代谢笼收集小鼠24 h尿液,当随机血糖>16.7 mmol·L-1,24 h尿蛋白>0.4 mg时确认为DN动物模型建立。造模成功的小鼠分层随机分为模型组、厄贝沙坦组(每天25 mg·kg-1)与糖肾宁组(1.05 g·kg-1),正常对照组、模型组小鼠用等体积去离子水灌胃,灌胃剂量按10 mL·kg-1体重系数,用药16周。
2.2 观察指标
2.2.1 一般状态
观察小鼠的皮毛外观、精神状态、进食饮水情况、活动量等,每4周称量体质量。
2.2.2 24 h尿蛋白定量测定
小鼠24 h尿液使用代谢笼收集,用BCA法检测尿蛋白浓度,计算24 h尿蛋白含量,每4周检测一次。
2.2.3 血液生化指标的检测
股动脉取血,检测血尿素氮(BUN)、血清肌酐(Scr)的含量。
2.2.4 肾组织病理学分析
干预16周后取材,无菌摘取肾脏,肾组织常规固定、石蜡包埋、切片,分别进行HE、Mallory染色。
2.2.5 原位杂交
取-20℃保存石蜡切片,复温,Triton,H2O2-CH3OH,分别孵育10 min;复合消化液,6 min;37℃预杂交,2 h,37℃杂交5 h,SSC梯度冲洗,封闭液,37℃,30 min。生物素标记Digoxin,4℃过夜;高敏过氧化物酶亲和素37℃,20 min,生物素化过氧化酶,37℃,20 min,DAB显色15 min,苏木素复染,返蓝l0 min,树胶封片。
2.2.6 原位杂交图像分析
应用Image-Pro Plus 6.0图像分析软件,棕黄色颗粒为阳性表达,每组随机选取8-12个视野,测定OD值。
2.2.7 Western blotting
小鼠肾组织匀浆后加如RIPA裂解液裂解组织,取上清蛋白。BCA法测蛋白浓度,加上样缓冲液沸水浴5 min进行蛋白变性,制胶、蛋白上样,凝胶电泳、恒压电转,5%脱脂奶粉室温封闭1 h,TBS(TBS-T)冲洗后,分别加Jagged(1∶1000)、Notch1(1∶2000)、Hes1(1∶500)、snail1(1∶1000),α-SMA(1∶2000);E-Cad(1∶1000),4℃过夜。加1∶3000羊抗兔及1∶6000羊抗鼠二抗,室温摇床反应1 h,滴加ECL化学发光液显影。应用BIO-RAD曝光成像系统拍照,用Image J图像分析软件,进行图像分析,与内参β-actin蛋白条带进行对照,计算靶蛋白条带与β-actin蛋白条带灰度的比值作为靶蛋白表达的相对水平。
2.2.8 统计分析
SPSS 20.0统计软件进行数据分析,数据用(xˉ±s)表示,采用单因素方差分析进行比较,P<0.05认为有统计学差异,P<0.01认为有显著性统计学差异。
3 实验结果
3.1 一般状态
通过连续无间断的喂养KKAy小鼠KK专用饲料后,糖尿病肾病KKAy小鼠出现精神萎靡,活动量明显减少,皮毛失去光泽,毛色暗淡,进食饮水量较C57/6J小鼠明显增大,同时增多的也包括24 h尿量。饲养大约10周时,皮肤溃疡和尿路感染等糖尿病并发症出现。相对于模型组小鼠,厄贝沙坦及糖肾宁组小鼠的一般状况有所改善。
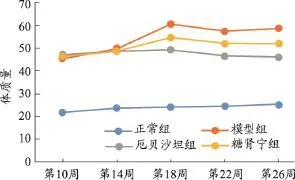
图1 糖肾宁对DN KKAy小鼠体质量的影响(xˉ±s,n=8)
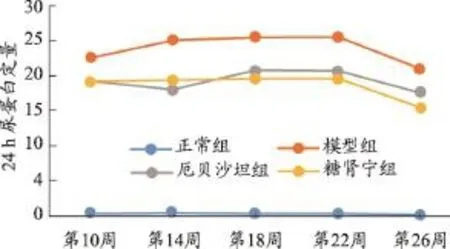
图2 糖肾宁对DN KKAy小鼠24 h尿蛋白定量的影响/mg(xˉ±s,n=7)
3.2 糖肾宁对DN小鼠体质量的影响
在本次实验中,每四周小鼠称重一次。如表1所示,随着实验进行,糖尿病肾病KKAy小鼠的体重逐渐增加,DN小鼠和C57BL/6J小鼠体重之间出现显着差异(P<0.01)。表中可以看到尽管治疗组小鼠体重也随时间延长缓慢增加,但从第14周起,各用药组小鼠体重与模型组相比体质量下降,第18周起,与模型组相比,厄贝沙坦组、糖肾宁组体重有显著统计学差异(P<0.01)。
3.3 糖肾宁对DN小鼠24 h尿蛋白定量的影响
每4周测24 h尿蛋白定量(表2)。模型组小鼠24 h尿蛋白定量随着时间的推移逐渐增加,且明显高于正常组小鼠(P<0.01),第十四周与模型组相比,糖肾宁组24 h尿蛋白明显降低(P<0.01)。虽然在第18周、第22周尿蛋白有少量增加,但糖肾宁组小鼠平均尿蛋白明显低于模型组小鼠(P<0.01),增长率与模型组相比明显下降(表2)。
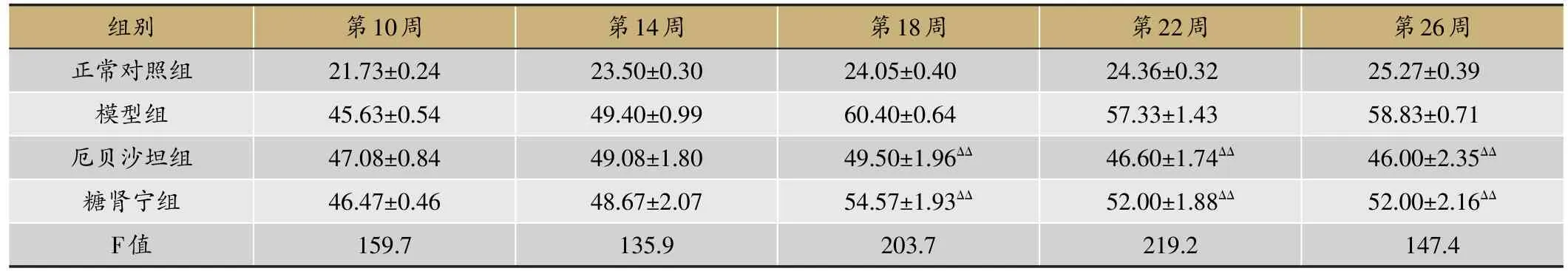
表1 糖肾宁对DN KKAy小鼠体质量的影响/g(xˉ±s,n=8)
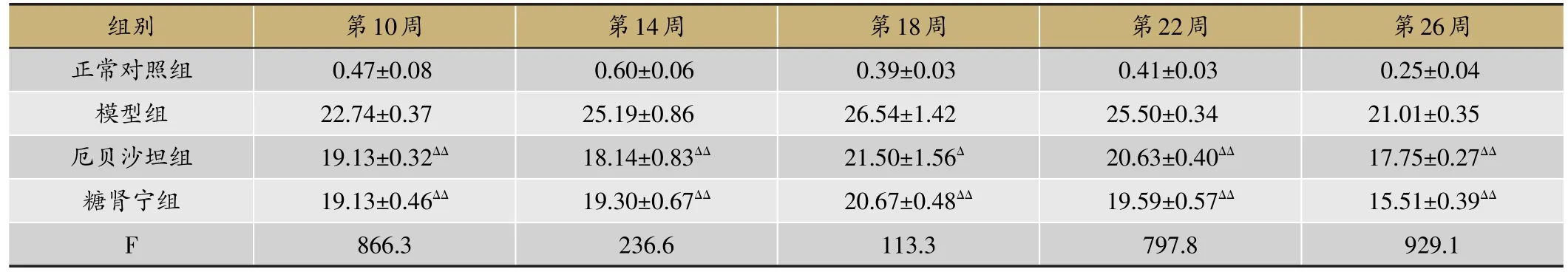
表2 糖肾宁对DN KKAy小鼠24h尿蛋白定量的影响/mg(xˉ±s,n=7)

表3 糖肾宁对DN KKAy小鼠血清BUN、Scr的影响(xˉ±s)
3.4 糖肾宁对DN小鼠血清BUN、Scr含量的影响
与正常组比较,模型组小鼠血清BUN、Scr含量显著升高(P<0.01),与模型组比较,糖肾宁组、厄贝沙坦组BUN、Scr含量显著性降低(P<0.01)。各治疗组之间比较,糖肾宁组与厄贝沙坦组比较无统计学差异(表3)。
3.5 糖肾宁对DN大鼠肾组织病理形态的影响
在实验结束时收集肾组织用于HE和Mallory染色。HE染色显示正常组肾小球和肾小管及间质结构正常。在模型组中,可以看到肾脏组织存在糖尿病肾病特征性病理改变,如肾小球肥大、肾小球系膜细胞及基质重度增生,肾小球基底膜增厚,可以看都有肾小球结节硬化,肾间质大量炎症细胞浸润,部分肾小管萎缩等,可看到透明管型。糖肾宁及厄贝沙坦组的的这些病理改变在一定程度上被逆转(图3)。
Mallory染色显示C57BL/6J小鼠中的肾小球及肾小管结构正常,无明显纤维样物质沉积,而在模型组小鼠肾组织中能明显看到到肾小球硬化和肾小管间质纤维化,肾组织中有大量的蓝色胶原纤维。然而,经过糖肾宁16周的治疗后,在一定程度上逆转了这些变化,小球硬化及小管间质纤维化明显改善,胶原纤维胶模型组明显减少(图4)。
3.6 糖肾宁对肾组织Jagged1、Notch1、hes1、snail1、α-SMA和E-Cad mRNA表达的影响
由表4、5和图5、图6、图7、图8、图9、图10可得,E-cad mRNA在正常组中可见大量表达,Jagged1、Notch1、hes1、snail1、α-SMA mRNA指标表达较少,与正常组相比,模型组小鼠Jagged1、Notch1、hes1、snail1、α-SMA指标原位杂交图片中能看到明显的大量棕黄色颗粒在肾组织中沉积,Jagged1、Notch1、hes1、snail1、α-SMA的mRNA表达增加(P<0.01),E-cad沉积明显减少,E-cad指标的mRNA表达是明显降低(P<0.01),与模型组相比,厄贝沙坦组及糖肾宁组KKAy小鼠Jagged1、Notch1、hes1、snail1、α-SMA的mRNA表达显著降低(P<0.01)。E-cad mRNA的表达水平明显升高(P<0.01)。
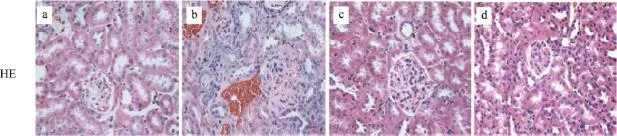
图3 各组小鼠肾组织HE染色(HE×400)
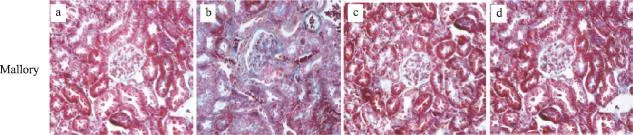
图4 各组小鼠肾组织Mallory染色(Mallory×400)
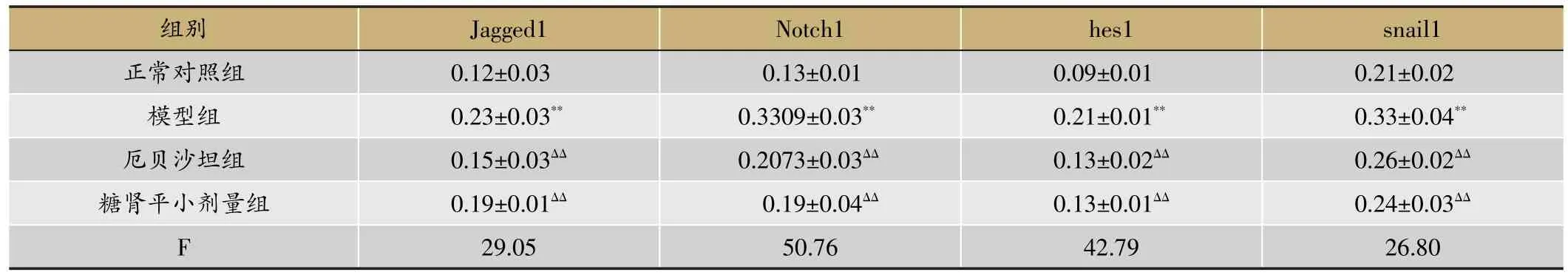
表4 原位杂交检测糖肾平对DN KKAy小鼠肾组织Jagged1、Notch1、hes1、snail1 mRNA表达的影响(OD,xˉ±s,n=3)
3.7 糖肾宁对肾组织Jagged1、Notch1、hes1、snail1、α-SMA和E-Cad蛋白表达的影响
Western blotting显示与正常组相比,DN KKAy小鼠肾组织中E-cad的蛋白表达是明显降低的(P<0.01),而Jagged1、Notch1、hes1、snail1、α-SMA蛋白表达增加(P<0.01)。与模型组相比,经过16周灌胃治疗,厄贝沙坦组、糖肾宁组KKAy小鼠肾组织中Jagged1、Notch1、hes1、snail1、α-SMA蛋白表达显著降低(P<0.01),E-cad蛋白表达明显升高(图5),提示糖肾宁能抑制糖尿病KKAy小鼠肾组织中Notch/snail1信号通路以及肾小管上皮细胞转分化(表6、表7和图11)。
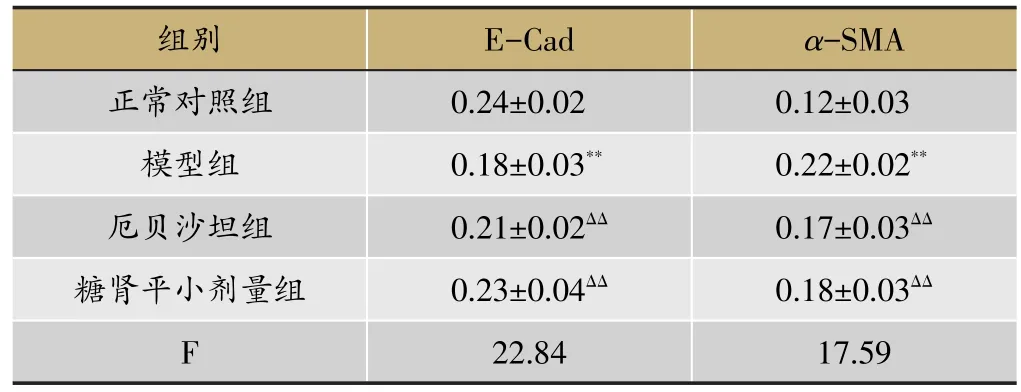
表5 原位杂交检测糖肾平对DN KKAy小鼠肾组织E-Cad、α-SMA mRNA表达的影响(OD,xˉ±s,n=3)
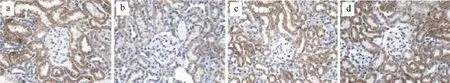
图5 糖肾宁对E-Cad指标mRNA表达的影响
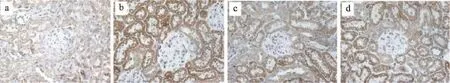
图6 糖肾宁对α-SMA指标mRNA表达的影响
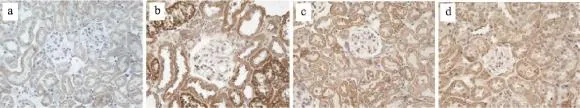
图7 糖肾宁对Jagged1指标mRNA表达的影响
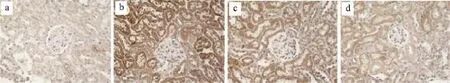
图8 糖肾宁对Notch1指标mRNA表达的影响
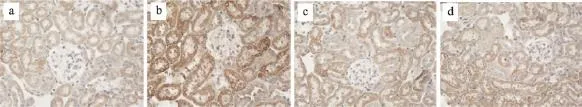
图9 糖肾宁对hes1指标mRNA表达的影响
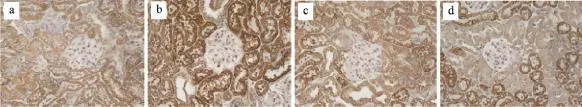
图10 糖肾宁对snail1指标mRNA表达的影响
表6 Western blotting检测糖肾平对DN KKAy小鼠肾组织Jagged1、Notch1、hes1、snail1、蛋白表达的影响(灰度值,xˉ±s,n=3)
3 讨论
由于生活方式和饮食结构的变化,DM的发病率逐年上升。目前,约7%的中国成年人是DM患者,数量高达92亿[7]。10-20年糖尿病患者中,约1/3患者发生DN[8]。中国DN患病率上升,中老年人占绝大部分,患者组有倾向成为年轻人。DN仍然是慢性肾功能衰竭的主要原因之一,其治疗比一般肾脏疾病复杂得多,预后差。肾间质性纤维化是慢性肾病进展为终末期肾功能衰竭的主要病理变化。有研究发现,超过1/3的间质成纤维细胞源自肾小管上皮细胞的上皮间质转化(EMT),这可能是导致肾间质发生纤维化的最重要机制之一。因此抑制肾小管上皮细胞分化是延缓DN进展的重要作用靶点。肾小管上皮细胞EMT是DN的肾纤维化过程中独特的事件,是DN肾损伤的关键因素,肾小管上皮EMT在一定条件下是可逆的,近年来已成为DN研究的热点,具有较高的研究价值[9]。
在本实验中,将KKay小鼠用作动物模型,通过用KK小鼠饲料连续喂养KKAy小鼠建立DN模型。该模型有很多优点,包括个体差异小,成型时间短,可操作性强,重复性好。导致其发病机制的多种因素与人类2型DM相似,并能模拟人类饮食和生活方式。国内外研究表明,高脂肪饮食8周后,KKAy小鼠血糖和24h尿蛋白排泄率均升高,肾脏重量和体重明显大于对照组[10]。在此基础上我们延长了KKAy小鼠的DM过程,使得该模型更加类似于人类DN过程。与正常组相比,模型组小鼠体重,肾重体重比,血清肌酐(Scr)和血尿素氮(BUN)显着升高,24 h尿蛋白排泄随时间逐渐增加。HE染色显示,模型组病理结果检测到肾脏形态变化,包括肾小球肥大,肾小球膜细胞增殖,肾小管上皮细胞液泡变性,肾间质炎症细胞浸润。Mallory染色显示模型组有肾小球硬化和肾间质纤维化。在肾小球和肾小管间质中可以发现大量的胶原纤维。综上所述,DN KKAy小鼠模型完全成功,本实验成功复制了DN肾间质纤维化模型。
目前,现代医学对DN及其并发症治疗方式基本为对症治疗,主要手段调节血糖,血脂和血压,改善微循环以控制疾病。疗效并不理想。在中国,中医药长期以来广泛应用于糖尿病及其并发症的治疗[11]。因为其较低的毒性和副作用中医药在预防糖尿病并发症方面具有相当优势[12-14]。Xiao等[15]回顾了2 000余篇论文,证明中草药是降低DN患者尿蛋白的有效安全方法。中药治疗DN具有一定的优势,对进一步研究DN的预防和治疗机制具有重要意义。
赵宗江教授钻研大量文献古籍,结合自身多年治疗糖尿病肾病临床经验,提出糖尿病肾病“肾痿”假说,假说的核心病机概念是糖尿病日久迁延不愈,耗伤正气,阴精亏虚,正虚则邪恋,痰、郁、热、瘀等实邪互相胶结,积聚于肾脏。在肾脏功能上痰热灼伤肾之络脉,络脉不通,血溢于脉外,可见血尿;湿热之邪瘀于体内,阻碍气血运行,日久气虚更甚,失去固摄精微能力,便出现蛋白尿。毒与虚并存于肾,最终导致肾痿废不用;病理形态上早期邪气稽留,肾脏瘀阻或瘀塞,瘀血与浊毒凝聚癥瘕聚集,症瘕积聚肾脏增大,中晚期症瘕日久,肾功能丧失荒废,痿缩废用,肾小球硬化肾间质纤维化。不难看出其中核心的核心是久病迁延不愈,过程是有害物质积累,发展结果是慢性肾功能不全,肾小球硬化,肾间质纤维化。糖肾宁既是在“肾痿”假说指导下诞生的治疗糖尿病肾病的复方,糖肾宁胶囊由熟地黄、山萸肉、怀山药、杜仲、炒白芍、淫羊霍、水蛭、酒军组成,方中熟地黄、山萸肉、怀山药滋阴补肾,淫羊霍、杜仲温肾助阳,炒白芍健脾补虚柔肝,水蛭、酒军活血化瘀解毒利水。糖尿病肾病久病,病位在脾、在肾,糖肾宁补肾同时不忘固脾,补虚同时不弃攻实,全方一方面补阳滋阴,另一方面活血化瘀,利水解毒,攻补兼施,标本兼治,适用于阴阳两虚证、淤毒内阻糖尿病肾病。糖肾宁不仅在临床上取得了较好疗效,前期实验研究也证实[16],糖肾宁对DN大鼠有肾脏保护功能,通过抑制TGF-β1和NF-κB表达、提高Smad7表达改善DN大鼠糖尿病肾病症状,延缓进展。并通过调控TGF-β1-smad2/3-ILK信号转导通路,干预足细胞转分化,维持足细胞形态功能的稳定性,从而保障肾小球滤过屏障的功能,减轻糖尿病肾病肾小球硬化和肾间质纤维化,保护DN肾功能,延缓其病程进展[17]。在本研究中,从代谢生化参数和形态学变化证据表明,糖肾宁有利于DN KKAy小鼠肾功能的恢复。减少尿24 h蛋白排泄,下调尿素氮和肌酐水平也。并且证实糖肾宁能够抑制肾小管上皮EMT和肾间质纤维化。
表7 Western blotting检测糖肾平对DN KKAy小鼠肾组织ECad、α-SMA蛋白表达的影响(灰度值,xˉ±s,n=3)

图11 各组小鼠Western blotting结果
Notch信号通路广泛参与身体多种疾病,包括多数肾脏病,肾小球疾病相关疾病包括肾小球硬化,也有notch信号通路的参与。并且notch信号转导通路激活后还能参与细胞的增殖和凋亡过程。Murea等人[18]发现。Notch通路激活是蛋白尿性肾脏疾病一种常见机制广泛存在肾小球硬化与肾小管间质纤维化病理生理过程中。Walsh等发现Jagged1,Hes1在糖尿病肾病患者肾小管间质表达与对照组相比明显增加[19]。不仅如此,近年来大量的基础及临床实验Notch信号通路在EMT过程中发挥重要作用。Zhicheng Xiao等发现在上皮细胞中的Notch通路的激活可以促进成纤维细胞的增殖和分化,CKD及肾间质纤维化患者肾组织中Notch信号通路表达明显增高,Notch信号通路是独立诱导EMT的[20,21]。DN细胞外基质增生,最终促进肾小管间质纤维化发展与Notch信号通路在糖尿病肾病的重新激活有关,这个概念的进一步支持来自于应用Notch信号通路抑制剂可以改善DN肾小管间质纤维化并抑制抑制进展的事实。
Snail锌指转录基因家族是被广泛认可的E-Cad蛋白表达的抑制基因,其通过多种方式参与上皮细胞的EMT,它不仅能够抑制E-Cad的表达,其他一些上皮标志物诸如紧密连接蛋白、封闭蛋白、细胞角蛋白也能被其抑制,同时还能增强间质成纤维细胞标志物α-SMA的表达,已证实snail信号通路参与介导损伤修复所致肺泡上皮Ⅱ型EMT的过程[22,23],人肾组织活检中发现纤维化的发生与snail高表达相关,苯氧胺诱导的snail转基因小鼠高表达snail基因,会诱发Ⅱ型EMT并最终导致肾纤维化。我们实验证实Notch/ snail1信号转导通路在糖尿病肾病KKAy小鼠肾组织中是激活的,Jagged1、Notch1、hes1、snail1、α-SMA蛋白及mRNA表达均升高,糖肾宁干预后Notch信号通路的各成分蛋白及mRNA表达被被明显抑制并伴有肾小管上皮转分化肾间质纤维化的明显改善,这一结果充分说明糖肾宁可能通过干预Notch/snail1信号转导通路抑制糖尿病肾病肾小管上皮转分化肾间质纤维化。
总之,本次试验证实糖肾宁可以改善糖尿病症状,抑制糖尿病肾病肾小管上皮EMT,减少肾间质纤维化,延缓DN进展。抑制DN KKAy小鼠肾组织中Notch/snail1信号转导通路的表达。并且糖肾平对DN KKAy小鼠肾脏保护作用及延缓肾间质纤维化可能是通过干预Notch/snail1信号转导通路实现。
1Shi Y,Hu F B.The global implications of diabetes and cancer.Lancet, 2014,383(9933):1947-1948.
2赵宗江,李相辉.上皮-间质转化信号转导在肾间质纤维化中机制的研究进展.中国中西医结合肾病杂志,2007,8(2):113-115.
3马海建,巫冠中.糖尿病肾病发病分子机制.现代生物医学进展, 2014,16(14):3184-3187.
4Bonegio R,Susztak K.Notch signaling in diabetic nephropathy.Exp Cell Res,2012,318(9):986-992.
5陶光利.Snail、Slug基因RNA干扰对肾小管上皮细胞转分化的作用.第三军医大学,2011:59-63.
6赵宗江,豆小妮,张新雪.糖尿病肾病“肾痿”假说探讨.中医杂志, 2011,52(S1):8-10.
7Jia W,Tong N.Diabetes prevention and continuing health-care reform in China.LancetDiabetes Endocrinol,2015,3(11):840-842.
8Farag YM,Al Wakeel JS.Diabetic nephropathy in the Arab Gulf countries.Nephron Clin Pract,2011,119(4):c317-322.
9Powell D W,Bertram C C,Cummins T D,et al.Renal tubulointerstitial fibrosis in OVE26 type 1 diabetic mice.Nephron Exp Nephrol,2008,111 (1):e11-e19.
10 Bazhan N M,Makarova E N.The effect of the"yellow"mutation at the mouse agouti locus on the hormonal profile of pregnancy and lactation. Ross Fiziol Zh Im I M Sechenova,2009,95(11):1254-1257.
11Tong X L,Dong L,Chen L,et al.Treatment of Diabetes Using Traditional Chinese Medicine:Past,Present and Future.Amj Chin Med, 2012,40(5):877-886.
12 Shi X,Lu X G,Zhan L B,et al.The effects of the Chinese medicine ZiBu PiYin recipe on the hippocampus in a rat model of diabetesassociated cognitive decline:a proteomic analysis.Diabetologia,2011,54 (7):1888-1899.
13 Zhao H L,Sui Y,Qiao C F,et al.Sustained Antidiabetic Effects of a Berberine-Containing Chinese Herbal Medicine Through Regulation of Hepatic Gene Expression.Diabetes,2012,61(4):933-943.
14 Wen X,Zeng Y,Liu L,et al.Zhenqing recipe alleviates diabetic nephropathy in experimental type 2 diabetic rats through suppression of SREBP-1c.J Ethnopharmacol,2012,142(1):144-150.
15 Xiao Y,Liu Y,Yu K,et al.The effect of Chinese herbal medicine on albuminuria levels in patients with diabetic nephropathy:a systematic review and meta-analysis.Evid Based Complement Alternat Med,2013: 937549.
16冯丽园.糖肾宁胶囊对糖尿病肾病大鼠肾脏保护作用及其对TGF-β1/Smad7信号通路影响的实验研究.北京:北京中医药大学硕士学位论文,2010:48-55.
17赵宗江.糖肾宁对DN大鼠TGF-β1-Smad2/3-ILK信号转导通路影响的研究.中西医结合实验医学专业委员会,湖南省中西医结合神经科专业委员会.第十二次全国中西医结合实验医学专业委员会暨第七次湖南省中西医结合神经科专业委员会学术年会论文集.中西医结合实验医学专业委员会,湖南省中西医结合神经科专业委员会,2015:2.
18 Lin CL,Wang FS,Hsu YC,et al.Modulation of notch-1 signaling alleviatesvascularendothelialgrowthfactor-mediateddiabetic nephropathy.Diabetes,2010,59(8):1915-1925.
19 Walsh D W,Roxburgh S A,Mc Gettigan P,et al.Co-regulation of Gremlin and Notch signalling in diabetic nephropathy.Biochim Biophys Acta,2008,1782(1):10-21.
20 Sharma S,Sirin Y,Susztak K.The story of Notch and chronic kidney disease.Curr Opin Nephrol Hypertens,2011,20(1):56-61.
21 Pear W S.New roles for Notch in tuberous sclerosis.J Clin Invest,2010, 120(1):84-87.
22 Meeteren L A,Ten D P.Regulation of endothelial cell plasticity by TGF-β.Cell TissueRes,2012,347(1):177-186.
23Nagarajan D,Melo T,Deng Z,et al.ERK/GSK3β/Snail signaling mediates radiation-induced alveolar epithelialtomesenchymal transition.Free Radic Biol Med,2012,52(6):983-992.
Renoprotective Effect of Tang-Shen-Ning and Its Influence on Notch/Snail1 Pathway in Diabetic Nephropathy KKAy Mice
Yang Guannan,Zhao Zongjiang,Zhang Xinxue,Yang Meijuan
(School of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100029,China)
This paper was aimed to study the renal protective effect of Tang-Shen-Ning(TSN)on diabetic nephropathy (DN)KKAy mice by inhibiting the Notch/snail1 signal transduction pathway.A total of 30 KKAy mice,which were fed with mice-dedicated food for 10 weeks and with the blood glucose over 16.7 mmol·L-1,24-hour urinary albumin larger than 0.4 mg,were made into the DN model.The DN mice were randomly divided into the model group,irbesartan group and TSN group according to their blood glucose and weight.Intragastric administration of medication was given.A total of 10 female C57BL/6J mice were selected as the control group.The general condition,body weight and 24-hour urinary protein quantitation were detected.After 16-week intervention,mice were sacrificed.Levels of blood glucose,blood urea nitrogen(BUN)and serum creatinine(Scr)were detected.HE and Mallory staining were applied to renal tissues.In situ hybridization(ISH)and western blotting were used to detect the Notch/snail1 pathway,α-SMA,E-Cadherin protein and mRNA expression in renal tissues.Statistical analysis was made by SPSS20.0 software.The results showed that compared with the model group,the rats’general conditions were improved;body weight and 24-hour urinary protein quantitation were significantly decreased(P<0.01);contents of BUN and Scr were reduced(P<0.01,P<0.05).The pathological staining showed significantly reduction on renal interstitial fibrosis.The Notch/snail1 pathway,protein and mRNA expression of α-SMA were significant reduced with statistical significance(P<0.01);protein and mRNA expression of ECad protein were significant increased with statistical significance(P<0.01).It was concluded that TSN can protect the renal function of DN,delay the disease progression of DN,and inhibit epithelial-mesenchymal transdifferentiation(EMT) of renal tubular epithelial cells and renal interstitial fibrosis.Furthermore,the inhibition on EMT may be through the regulation of the Notch/snail1 pathway.
Diabetic nephropathy,Tangshenning,consumptive kidney disease,KKAy mice,epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells,Notch/snail1 pathway
10.11842/wst.2017.06.027
R285.5
A
(责任编辑:马雅静,责任译审:王晶)
2017-04-28
修回日期:2017-05-20
*国家自然科学基金面上项目(81373831):基于“肾痿”组方糖肾平干预糖尿病肾病肾小管上皮细胞转分化的分子机制研究,负责人:赵宗江。
**通讯作者:赵宗江,本刊编委,教授,博士生导师,主要研究方向:中医药防治糖尿病肾病的机制研究。

