腌菜中亚硝酸盐含量的测定
谢微,陈秋娟,何星存,罗杨合,朱东建
(1.贺州学院 食品科学与工程技术研究院,广西 贺州 542899;2.贺州学院 化学与生物工程学院,广西 贺州 542899)
腌菜中亚硝酸盐含量的测定
谢微1,陈秋娟2*,何星存1,罗杨合1,朱东建1
(1.贺州学院 食品科学与工程技术研究院,广西 贺州 542899;2.贺州学院 化学与生物工程学院,广西 贺州 542899)
以α-萘胺为显色剂,采用可见分光光度法,测定贺州市八步区几种腌菜中亚硝酸盐的含量。该方法的线性方程为A=1.4307C+0.0037,相关系数R2=0.9998,检测限为1.5 μg/L,亚硝酸盐回收率为94.78%~99.53%。结果显示:该方法线性较好,操作简便,精密度高,5个样品中亚硝酸盐的含量均没有超标。
可见分光光度法;腌菜;α-萘胺;亚硝酸盐
亚硝酸盐俗称工业用盐,是一种白色或微黄色的结晶或颗粒状粉末,无臭,味微咸涩,易潮解,并易溶于水、液氮,微溶于甲醇等有机溶剂。亚硝酸盐广泛存在于自然环境中,特别是存在于食物中,比如蔬菜、粮食、肉类、鱼类、蛋类都含有一定量的亚硝酸盐[1]。亚硝酸盐广泛应用于工业中,如可作防锈剂;在食品方面也有着广泛的应用,如在食品加工生产中,亚硝酸盐可以作为增色剂和防腐剂[2]。亚硝酸盐在工业和食品方面给人类带来了利益和方便,但亚硝酸盐也是一种强致癌的物质。长期食用含有亚硝酸盐的食物会使血液中血红蛋白携氧能力降低,从而引发组织缺氧,同时还可能会使血压降低,或者血管扩张[3]。另外,亚硝酸盐还能与胃中的含氮类物质发生作用转化成亚硝胺[4]。当体内的亚硝胺含量达到一定的量时,就可以引发胃癌、食管癌和肝癌等,对人体产生极大的危害[5]。
长期以来,由于腌菜能够长时间贮存,并且具有独特的风味而广受市民的喜爱,腌菜在市场上随处可见。研究表明:蔬菜是一种极易富集硝酸盐的食品,蔬菜在腌制过程中,由于微生物以及硝酸还原酶的作用,使得硝酸盐还原成亚硝酸盐[6]。因此,控制腌菜中的亚硝酸盐含量很有必要。
目前测定亚硝酸盐含量的方法有很多种,常用的方法是盐酸萘乙二胺分光光度法[7]、催化光度法[8]、离子色谱法[9]等,这些方法灵敏度较高,但操作复杂,并且反应条件需要严格控制,对环境因素也比较敏感。还有一些新兴的测定方法如催化动力学法[10]、胶束增效紫外分光光度法[11]、漫反射光谱法[12]等,这些方法测定亚硝酸盐精密度较高,但是操作复杂,并且仪器较大,价格高,测定时间也较长,不适合推广使用。
本次课题采用的是在弱酸的情况下,亚硝酸盐与对氨基苯磺酸发生反应产生重氮化合物,再与α-萘胺耦合,形成紫红色的偶氮化合物,测定其吸光度。本次测定广西贺州市八步区部分腌菜的亚硝酸盐含量,旨在给当地市民提供有价值的参考依据。
1 材料与方法
1.1 材料、试剂与仪器
大头菜、榨菜、梅菜、腌萝卜:购于阳光市场;凉拌菜:购于泰兴超市。
亚硝酸钠、对氨基苯磺酸、α-萘胺、四硼酸钠、亚铁氰化钾、乙酸锌、盐酸、无水乙醇、氢氧化钠:以上药品均为分析纯;实验用水为超纯水。
TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;722可见分光光度计 上海光谱仪器有限公司;FA1004电子天平 上海舜宇恒平科学仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;101-1电热恒温鼓风干燥箱 上海跃进医疗器械厂;HHS电热恒温水浴锅 上海博迅实业有限公司医疗设备厂。
1.2 试剂的配制
20% 盐酸溶液:量取54.8 mL 36.5%盐酸至100 mL烧杯中,加水至100 mL刻度线。
1 mg/mL亚硝酸钠标准储备溶液:准确称取0.5000 g 亚硝酸钠于100 mL烧杯中,先加入少量水溶解,转入500 mL容量瓶中,加水定容,摇匀,做储备液。
5 μg/mL亚硝酸钠标准工作溶液:量取5.00 mL 1 mg/mL亚硝酸钠标准溶液于1000 mL容量瓶中,加水定容,摇匀。
4 g/L对氨基苯磺酸溶液:称取2.000 g对氨基苯磺酸固体溶于500 mL 20%盐酸中,混匀,置于棕色瓶中,避光保存。
2 g/L α-萘胺溶液:准确称取0.5000 g α-萘胺固体,先用少量95%酒精溶解,转入250 mL容量瓶中,再用95% 酒精定容,摇匀。
硼砂饱和溶液:称取25 g四硼酸钠固体溶于500 mL温水中,冷却至室温。
0.25 mol/L亚铁氰化钾溶液:准确称取10.6190 g亚铁氰化钾固体,溶于水中并转入100 mL容量瓶中,加水定容,摇匀。
1 mol/L乙酸锌溶液:准确称取21.9000 g乙酸锌固体,加入3 mL冰醋酸,加水溶解,转入100 mL容量瓶中,加水定容,摇匀。
0.01 mol/L 氢氧化钠溶液:称取0.04 g 氢氧化钠固体于100 mL烧杯中,加水至100 mL刻度线,搅拌溶解。
1.3 样品处理
准确称取 2.5000 g 经粉碎均匀的腌菜样品,置于250 mL烧杯中,加入 12.5 mL硼砂饱和溶液,搅拌均匀,加入约100 mL 70 ℃左右的水,并在沸水浴中加热15 min,取出冷却到室温,转入250 mL容量瓶中,再加入5 mL亚铁氰化钾溶液和5 mL乙酸锌溶液以沉淀蛋白质,加水定容,加入1 g活性炭[13],摇匀,静置,吸走上层脂肪并进行抽滤,滤液备用[14]。
1.4 实验方法
1.4.1 实验原理
样品经蛋白质沉淀、除去脂肪后,在弱酸的情况下,亚硝酸盐与对氨基苯磺酸发生重氮化反应生成重氮盐,重氮盐再与α-萘胺试剂发生耦合反应,生成紫红色偶氮化合物,亚硝酸盐特效试剂α-萘胺溶液作显色剂,能够成功地避免实验中其他阴阳离子的影响[15]。反应式如下:
反应1:
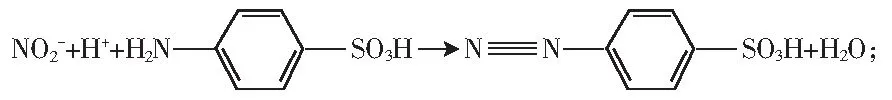
反应2:
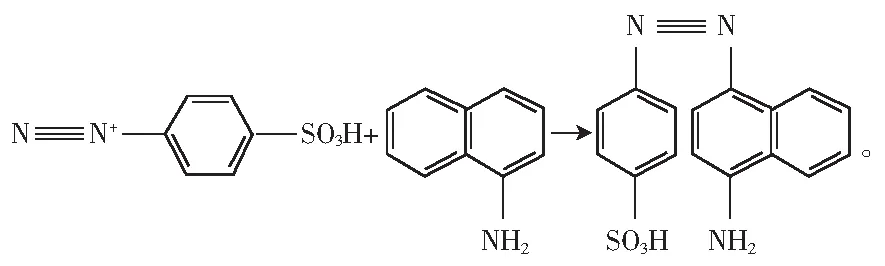
1.4.2 标准曲线的绘制方法
分别吸取一定量的5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,分别加入一定量的 4 g/L对氨基苯磺酸溶液,在一定的温度下,调节溶液的pH为5,摇匀,静置,再加入一定量的2 g/L α-萘胺溶液,加水至刻度,摇匀,静置,于1 cm比色皿中,在最大吸收波长处测定吸光度,以亚硝酸钠标准溶液浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线。
1.4.3 样品的测定
吸取40 mL滤液置于50 mL容量瓶中,加入一定量的4 g/L对氨基苯磺酸溶液,在一定的温度下,调节溶液的pH,摇匀,静置,再加入一定量的2 g/L α-萘胺溶液,加水至刻度,摇匀,静置,于1 cm比色皿中,在最大吸收波长处测定吸光度。
2 结果与讨论
2.1 最大波长的确定
反应1:吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,摇匀,静置3~5 min,加水至刻度,摇匀,于1 cm比色皿中,做光谱扫描,结果见图1。
反应2:吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,摇匀,静置3~5 min,再加入2.00 mL 2 g/L α-萘胺溶液,加水至刻度,摇匀,静置15 min,于1 cm比色皿中,做光谱扫描,结果见图1。

图1 反应1和反应2的波长Fig.1 The wavelength of reaction 1 and reaction 2
由图1可知,反应1在紫外区267 nm处吸光度达到最大,而在可见区无吸收。反应2在可见区520 nm处吸光度达到最大,故选择267 nm和520 nm分别为反应1和反应2的最适宜测定波长,为了更好考察反应条件对反应体系的影响。
2.2 反应条件的确定
2.2.1 反应1的反应条件的确定
2.2.1.1 反应时间的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,摇匀,静置时间分别是1,2,3,4,5,6 min,加水至刻度线,混匀,于1 cm比色皿中,在267 nm处测量吸光度。以反应时间t为横坐标,吸光度A为纵坐标绘制曲线,见图2。
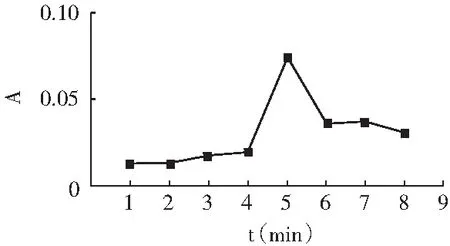
图2 反应时间的影响Fig.2 The influence of reaction time
由图2可知,随着反应时间的延长,体系的吸光度逐渐增大,当反应时间为4 min时,吸光度急剧增大;当反应到5 min时,吸光度达到最大值;当反应时间大于5 min后,吸光度急剧下降。表明在5 min时,反应已充分完成。因此,选择5 min为反应1的最佳反应时间。
2.2.1.2 反应温度的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,摇匀,温度分别控制在10,15,20,25,30,35 ℃,静置5 min,加水至刻度线,混匀,于1 cm比色皿中,在267 nm处测量吸光度。以反应温度T为横坐标,吸光度A为纵坐标绘制曲线,见图3。

图3 反应温度的影响Fig.3 The influence of reaction temperature
由图3可知,体系的吸光度随着温度的升高而增大,当温度升到25 ℃时,体系的吸光度达到最大,随后再升高温度,吸光度反而缓慢下降,而20~35 ℃之间的吸光度相差不大,较稳定。故选择25 ℃为反应1 的最佳温度。
2.2.1.3 反应pH的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,调节pH为1,2,3,4,5,6,7,摇匀,温度控制在25 ℃,静置5 min,加水至刻度线,混匀,于1 cm比色皿中,在267 nm处测量吸光度。以溶液pH为横坐标,吸光度A为纵坐标绘制曲线,见图4。
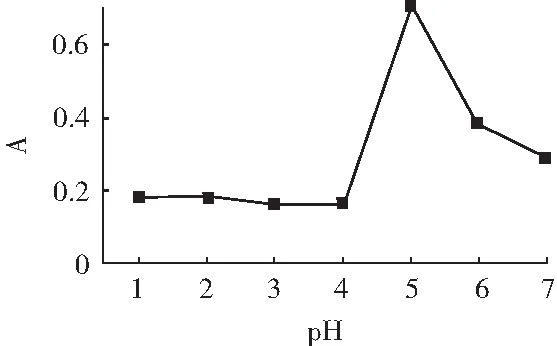
图4 反应pH的影响Fig.4 The influence of reaction pH
由图4可知,随着pH的增大,吸光度逐渐增大,当pH达到4时,吸光度急剧增大;当pH为5时,吸光度达到最大值;当反应pH>5时,吸光度急剧下降。表明pH为5时,反应已充分完成。因此,选择pH 5为反应1的最佳反应pH值。
2.2.1.4 显色剂用量的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2 mL 4 g/L对氨基苯磺酸溶液的量分别为0.5,1.0,1.5,2.0,2.5,3.0 mL,调节pH为5,温度控制在25 ℃,摇匀,静置时间为5 min,加水至刻度线,混匀,于1 cm比色皿中,在267 nm处测量吸光度。以显色剂用量V为横坐标,吸光度A为纵坐标绘制曲线,见图5。

图5 显色剂用量的影响Fig.5 The influence of chromogenic agent dosage
由图5可知,随着显色剂用量的增加,吸光度逐渐增大,当显色剂用量为2.0 mL时,吸光度达到最大值,反应能够充分完成;当显色剂用量大于2.0 mL后,吸光度没有上升反而下降。因此,选择显色剂用量2.0 mL为反应1的最佳显色剂用量。
2.2.2 反应2的反应条件的确定
2.2.2.1 反应时间的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,摇匀,温度控制在25 ℃,静置时间为5 min,再加入2.00 mL 2 g/L α-萘胺溶液,加水至刻度,摇匀,静置时间分别为5,10,15,20,25,30 min,于1 cm比色皿中,在520 nm处测量吸光度。以反应时间t为横坐标,吸光度A为纵坐标绘制曲线,见图6。
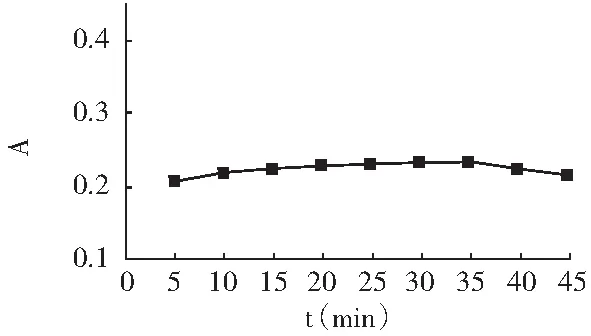
图6 反应时间的影响Fig.6 The influence of reaction time
由图6可知,随着反应时间的延长,吸光度缓慢增大,当反应时间为30 min时,吸光度达到最大值,反应能够充分完成;当反应时间继续延长时,吸光度没有上升反而下降。因此,选择30 min为反应2的最佳反应时间。
2.2.2.2 反应温度的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,摇匀,温度控制在25 ℃,静置5 min,加水至刻度,混匀,再加入2.00 mL 2 g/L α-萘胺溶液,加水至刻度,温度控制在10,15,20,25,30,35,40 ℃,摇匀,静置30 min,于1 cm比色皿中,在520 nm处测量吸光度。以温度T为横坐标,吸光度A为纵坐标绘制曲线,见图7。
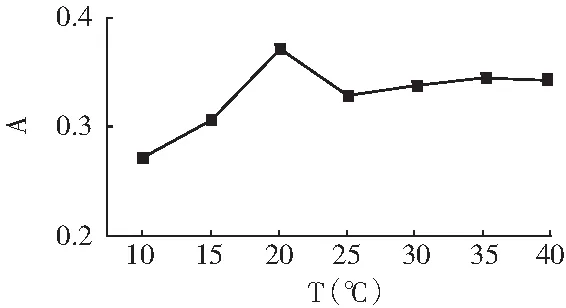
图7 反应温度的影响Fig.7 The influence of reaction temperature
由图7可知,吸光度随着温度的上升而增大,当温度达到20 ℃时,吸光度达到最大值,再升高温度,体系的吸光度反而下降,且25 ℃后的吸光度趋于稳定。故选择20 ℃为反应2 的最佳温度。
2.2.2.3 反应pH的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2.00 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,摇匀,温度控制在25 ℃,静置5 min,再加入2.00 mL 2 g/L α-萘胺溶液,加水至刻度,控制pH为1,2,3,4,5,6,7,温度控制在20 ℃,静置30 min,于1 cm比色皿中,在520 nm处测量吸光度。以反应pH为横坐标,吸光度A为纵坐标绘制曲线,见图8。

图8 反应pH的影响Fig.8 The influence of reaction pH
由图8可知,溶液的吸光度随pH的变化影响不大,且原溶液的pH值为4。因此,选择pH 4为反应2的最佳反应pH值。
2.2.2.4 显色剂用量的影响
吸取5.00 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,加入2 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,温度控制在25 ℃,摇匀,静置时间为5 min,再加入2 g/L α-萘胺溶液,用量分别为0.5,1.0,1.5,2.0,2.5,3.0 mL,加水至刻度,控制pH为4,温度控制在20 ℃,摇匀,静置30 min,于1 cm比色皿中,在520 nm处测量吸光度。以显色剂用量V为横坐标,吸光度A为纵坐标绘制曲线,见图9。
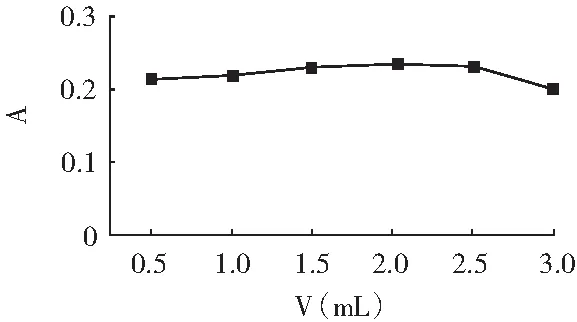
图9 显色剂用量的影响Fig.9 The influence of chromogenic agent dosage
由图9可知,随着显色剂用量的增大,吸光度缓慢增大,显色剂用量为2.0 mL时,吸光度达到最大值,反应能够充分完成;当显色剂用量大于2.0 mL后,吸光度没有上升而是缓慢下降。因此,选择显色剂用量2.0 mL为反应2的最佳显色剂用量。
2.3 标准曲线的绘制
分别吸取0,0.50,1.00,1.50,2.00,2.50,3.00 mL5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,分别加入2.0 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,温度控制在25 ℃,摇匀,静置时间为5 min,再加入2.0 mL 2 g/L α-萘胺溶液,加水至刻度,温度控制在20 ℃,摇匀,静置30 min,于1 cm比色皿中,在520 nm处测定吸光度。以亚硝酸钠标准溶液浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线,见图10。
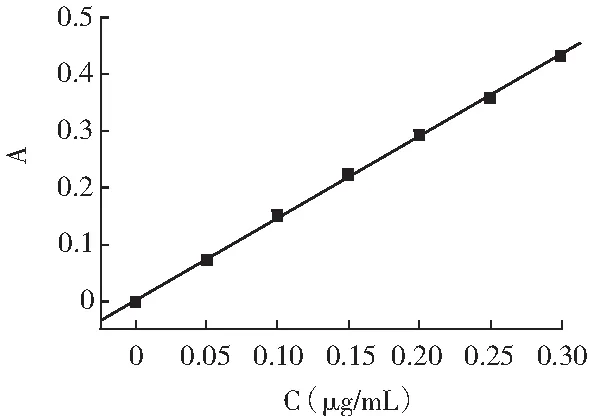
图10 标准曲线Fig.10 The standard curve
由标准曲线可知回归方程为A=1.4307C+0.0037,相关系数R2=0.9998,线性较好。
2.4 样品的测定
吸取40 mL滤液置于50 mL容量瓶中,加入2.0 mL4 g/L对氨基苯磺酸溶液,调节pH为5,温度控制在25 ℃,摇匀,静置时间为5 min,再加入2.0 mL 2 g/L α-萘胺溶液,加水至刻度,控制pH为4,温度控制在20 ℃,摇匀,静置30 min,于1 cm比色皿中,在520 nm处测定吸光度,平行5次。不同类型腌菜样品中亚硝酸盐含量测定的结果见表1。

表1 腌菜中亚硝酸盐含量测定结果Table 1 Determination results of nitrite content in pickles
由表1可知,不同的腌菜中亚硝酸盐的含量存在着较大的差异。在所测的5种腌菜中,亚硝酸盐含量最高的大头菜为4.9529 mg/kg,其次的榨菜、凉拌菜分别为4.4295,4.3082 mg/kg,含量最低的梅菜为0.6378 mg/kg。其中亚硝酸盐含量最低的梅菜和含量最高的大头菜,其含量相差8倍。腌制食品中的亚硝酸盐含量的国家标准为20 mg/kg[16],由此可知,本次测量的腌菜样品中亚硝酸盐含量均没有超标。
2.5 检测限的确定
用水代替样品滤液在相同条件下测定吸光度,平行20次。以20次测定的试剂空白标准差的3倍表示该方法的检测限,为1.5 μg/L。
2.6 精密度试验
吸取5.0 mL 5 μg/mL亚硝酸钠标准溶液,置于50 mL容量瓶中,分别加入2.0 mL 4 g/L对氨基苯磺酸溶液,调节pH为5,温度控制在25 ℃,摇匀,静置时间为5 min,再加入2.0 mL 2 g/L α-萘胺溶液,加水至刻度,调节pH为4,温度控制在20 ℃,摇匀,静置30 min,于1 cm比色皿中,在520 nm处测定吸光度,平行5次。精密度试验测定的结果见表2。

表2 精密度试验测定结果Table 2 Determination results of precision test
由表2可知,通过重复测定标样7次,计算吸光度的重复性,得亚硝酸盐的相对标准偏差RSD为0.29%,小于2%,满足分析实验的精密度要求,说明该实验精密度良好。
2.7 回收率试验
取滤液2份,分别加入2.5,5.0 mL 5 μg/mL亚硝酸钠标准溶液,测定吸光度,平行3次。根据工作曲线计算出其含量,求回收率。以榨菜为例,其回收率试验测定的结果见表3。
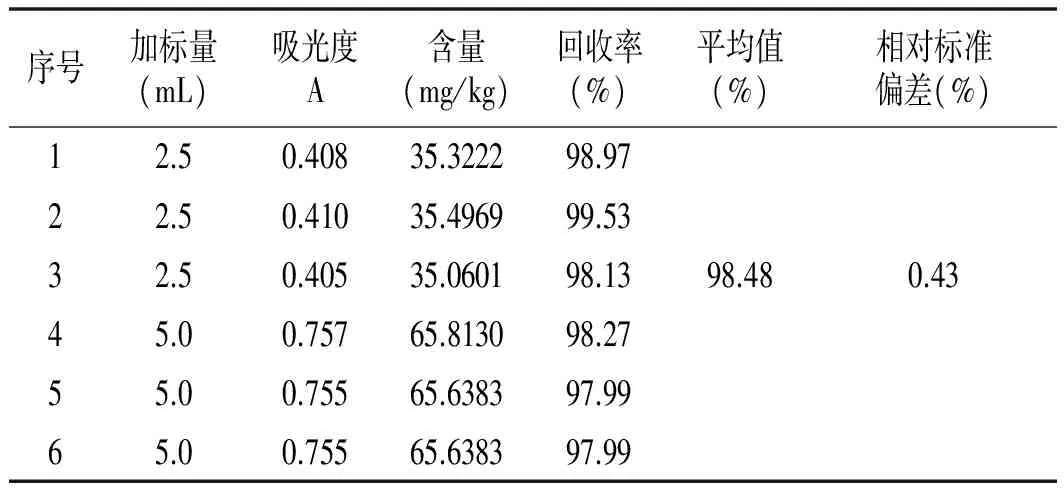
表3 回收率试验结果Table 3 Results of recovery test
由表3可知,通过对2个不同加标量的分析,测得亚硝酸盐的回收率为97.99%~99.53%,平均回收率为98.48%,相对标准偏差RSD为0.43%。故该方法有较高的准确性和可靠性。
3 结论
分光光度法测定5种腌菜中的亚硝酸盐含量在0.6378~4.9529 mg/kg。所有样品均在国家标准范围之内,均不超标。贺州市八步区阳光市场部分腌菜可以放心食用。
本次实验法测定腌制蔬菜中亚硝酸盐含量是一个不错的选择,不仅设备简单、操作快捷,而且灵敏度高、结果准确,具有推广价值。
[1]吴颖珍,黄秋蝉.食品中亚硝酸盐的风险评估[J].畜牧与饲料科学,2009,30(5):62-63.
[2]于淼.食品中亚硝酸钠快速测定的新方法研究[D].齐齐哈尔:齐齐哈尔大学,2012.
[3]周蓓莉,肖进文,刘生峰,等.传统腌腊制品中亚硝酸盐的危害及其替代物的研究进展[J].中国食品添加剂,2012(2):166-171.
[4]史小康.浅谈亚硝酸盐及其危害[J].现代妇女,2013(12):15.
[5]朱雨霏.亚硝胺类化合物的致癌作用及预防[J].环境保护与循环经济,2008(5):34-35.
[6]罗雪华,蔡秀娟.紫外分光光度法测定蔬菜硝酸盐含量[J].华南热带农业大学学报,2004,10(1):13-15.
[7]姜薇薇,王树庆,张瑞菊,等.盐酸萘乙二胺法测定食品中亚硝酸盐含量的影响因素研究[J].山东商业职业技术学院学报,2011,11(3):87-89.
[8]朱克永.催化光度法测定食品中亚硝酸盐[J].四川食品与发酵,2011(3):53-56.
[9]王勇,左跃先,宋胜利,等.离子色谱法检验血液中的亚硝酸盐[J].中国无机分析化学,2013(1):80-82.
[10]张妮.一种测定香肠中亚硝酸盐含量的催化动力学新方法[J].化学工程师,2012(3):23-26.
[11]Nahid Pourreza,Mohammad Reza Fat'hi,Ali Hatami.Indirect cloud point extraction and spectrophotometric determination of nitrite in water and meat products[J].Microchemical Journal,2012,104:22-25.
[12]Vitor Hugo Marques Luiz,Leonardo Pezza,Helena Redigolo Pezza.Determination of nitrite in meat products and water using dapsone with combined spot test/diffuse reflectance on filter paper[J].Food Chemistry,2012,134(4):2546-2551.
[13]高毓嵘.维生素C对成品泡菜中亚硝酸盐含量的影响[J].中国调味品,2010,35(5):102-104.
[14]陈雅妮,任顺成,辛亚楠.蔬菜加工保藏过程中亚硝酸盐含量的变化[J].中国瓜菜,2013,26(2):18-20.
[15]丁旭光,张捷莉,刘志强,等.几种肉制品中亚硝酸盐含量的测定[J].食品科学,2004,25(10):276-279.
[16]张宝勇.六种腌制菜中亚硝酸盐含量及食用安全性评价研究[J].中国调味品,2012,37(9):96-98.
Determination of Nitrite Content in Pickles
XIE Wei1, CHEN Qiu-juan2*, HE Xing-cun1, LUO Yang-he1, ZHU Dong-jian1
(1.Research Institute of Food Science & Engineering Technology, Hezhou University,Hezhou 542899, China;2.School of Chemical and Biological Engineering,Hezhou University, Hezhou 542899, China)
The content of nitrite in pickles from Babu District of Hezhou City is determined by visible spectrophotometry with α-naphthylamine as chromogenic agent. The linear equation is A=1.4307C+0.0037, the correlation coefficient R2=0.9998, the detection limit is 1.5 μg/L, the recovery rate of nitrite is 94.78%~99.53%. The results show that the method exhibits good linearity, easy operation and high precision. The content of nitrite in five samples doesn't exceed the standard.
visible spectrophotometry;pickles;α-naphthylamine;nitrite
2017-02-16 *通讯作者
广西高校中青年教师基础能力提升项目(KY2016LX381);广西高校科学技术研究项目(KY2015LX477);贺州学院教学质量与教学改革工程项目(hzxyjg201636,hzxyjg201541);贺州学院校级课题(2014ZC28)
谢微(1984-),女,壮族,助理研究员,硕士,研究方向:分析检测;
陈秋娟(1983-),女,讲师,研究方向:天然产物提取、纯化与分析。
TS255.53
A
10.3969/j.issn.1000-9973.2017.08.025
1000-9973(2017)08-0114-06

