桔霉素生物合成及调控的研究进展
吴申懋,于华宁*
(1.乳业生物技术国家重点实验室,上海 200436;2.上海乳业生物工程技术研究中心,上海 200436;3.食品安全与营养协同创新中心,上海 200436;4.光明乳业股份有限公司乳业研究院,上海 200436)
桔霉素生物合成及调控的研究进展
吴申懋1,2,3,4,于华宁1,2,3,4*
(1.乳业生物技术国家重点实验室,上海 200436;2.上海乳业生物工程技术研究中心,上海 200436;3.食品安全与营养协同创新中心,上海 200436;4.光明乳业股份有限公司乳业研究院,上海 200436)
桔霉素是一种聚酮类化合物,同时也是一种常见的真菌毒素,具有肾毒性和潜在的致癌致畸风险,是青霉属、曲霉属、红曲霉属等的次级代谢产物。桔霉素的存在严重影响了真菌发酵工程的安全性,对食品安全造成了严重的威胁。因此,如何减少或抑制桔霉素的产量已成为一个研究热点。近年来, 随着分子生物学技术的发展,许多研究者对真菌次级代谢产物的生物合成及其调控进行了研究。文章重点介绍了桔霉素生物合成途径及相关基因的研究进展, 为减少真菌发酵过程中桔霉素的产量,提供更优良的工业用菌株的参考和借鉴。
桔霉素;聚酮合酶;红曲霉
桔霉素(citrinin)是一种真菌毒素,由Raistrick H和Hetherington A C于1931首次在Penicilliumcitrinum中分离得到[1],并在1948年由Whalley W B鉴定了其化学结构(见图1)[2]。
桔霉素的化学名为4,6-二氢-8-羟基-3,4,5-三甲基-6-氧-3-H-2-苯吡-7-羧酸,呈黄色晶体状。作为一种真菌的次级代谢产物,桔霉素具有抑菌作用,但同时在哺乳动物中被证实对肾脏有一定毒性,摄入会导致实验动物的肾脏增大、肾小管扩张和上皮细胞坏死等症状,同时还具有潜在的致畸风险[3-8]。有研究表明目前生活中摄入桔霉素的主要来源是谷物及谷物为原料的食品,见表1[9]。
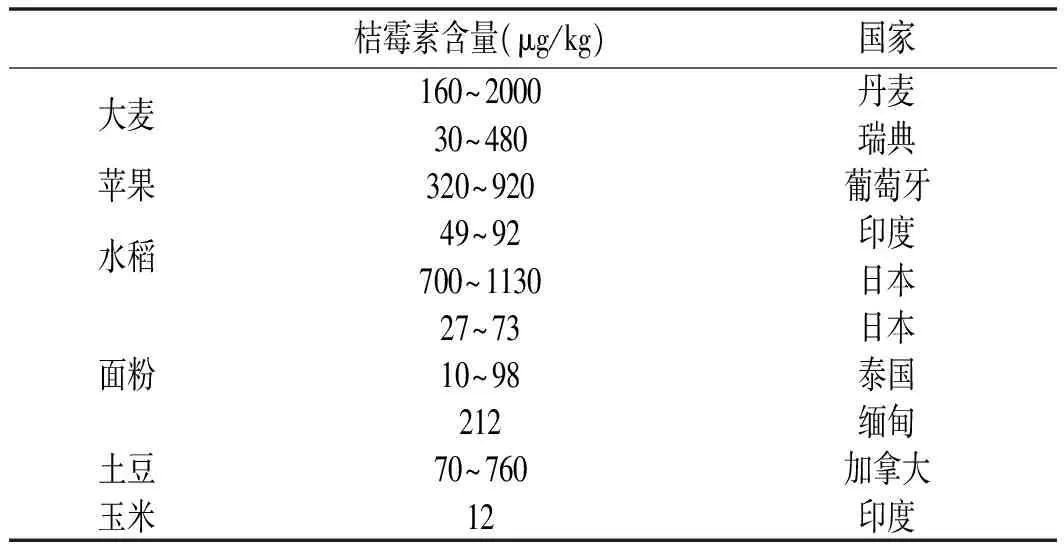
表1 桔霉素在食品原料中的污染Table 1 The contamination of citrinin in food ingredients
近年来,真菌毒素在食品中的危害正越来越受到重视,相关机构普遍重视,日本针对食品和保健食品中桔霉素的含量已做出规定,不得超过200 μg/kg。
欧盟的食品安全局(European Food Safety Authority)虽然未对食品中的桔霉素含量做出确切规定,但也对桔霉素的肾毒性及可能具有的基因毒性和致畸可能性表示了关注。
目前的研究发现桔霉素可由青霉属(Penicillium)、曲霉属(Aspergillus)、红曲霉属(Monascus)等代谢产生。这几类真菌均为重要的工业用菌种,过高的桔霉素产量会对食品的质量和安全造成严重的影响,因此如何减少或抑制桔霉素的产生成为许多研究者研究的重点方向。
近年来,随着真菌遗传转化方法的成熟、转录组学及代谢组学的兴起,越来越多的技术正在被运用于真菌次级代谢产物的分析,桔霉素的生物合成及相关功能基因的研究也取得了不少成果。本文就桔霉素生物合成及相关的调控基因的研究进展做了综述。
1 桔霉素的生物合成途径
桔霉素是一种聚酮类化合物,对于真菌聚酮体代谢产物的合成途径,目前已经有很多相关研究。与青霉属产生的其他聚酮类化合物洛伐他丁(Lovastatin)和莫那可林(Monacolin K)一样,桔霉素合成的前体是乙酰CoA和丙二酰CoA。Hajjaj等[10]的研究通过同位素示踪方法追踪标记化合物在合成过程中的积累,认为桔霉素在聚酮合酶(polyketide synthases,PKS)的作用下,1分子的乙酰CoA和4分子的丙二酰CoA缩合成四酮体(Tetraketide),然后继续与乙酰CoA缩合,通过甲基化、缩合、还原、甲氧基化、还原、氧化和脱水等步骤生成桔霉素(见图2中a)。
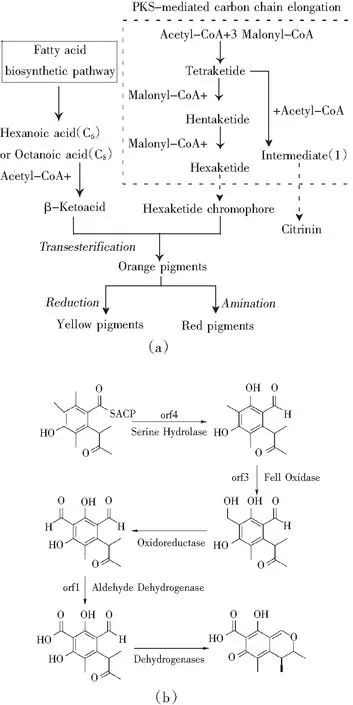
图2 红曲霉中桔霉素可能的生物合成过程Fig.2 The possible biosynthesis process of citrinin in Monascus spp.
但是最新的研究对此提出了其他解释(见图2中b):He Yi 等[11]认为乙酰CoA在PKS的作用下,生成结合酰基载体蛋白(acyl carrier protein,ACP)的起始复合物,然后在丝氨酸水解酶(Serine Hydrolase)、氧化还原酶(Oxidoreductase)、乙醛脱氢酶(Aldehyde Dehydrogenase)、短链脱氢酶(short-chain dehydrogenases,SDR)的作用下生成桔霉素。
2 桔霉素合成及调控基因的研究
在真菌的次级代谢途径中,需要很多酶的参与和调控,这些酶的编码基因常被发现紧密排列在染色体相邻的位置上,形成一个共同参与合成调控的基因[12]。在桔霉素等聚酮化合物的生物合成过程中,PKS基因簇起了一个关键作用。目前通过基因克隆等方法,对PKS基因的结构和功能已有了一个较为全面的了解。但对位于PKS基因簇的上下游,参与调控和影响桔霉素合成的其他调控基因仍有待进一步的研究。
真菌的PKS基因是一个复杂的基因簇,完整的PKS包含多个功能模块,由多个酶和蛋白构成(见图3),其中包括:酮脂酰基合酶(β-ketoacylsynthase,KAS)、酰基转移酶(acyl transferase,AT)、酰基载体蛋白(acyl carrier protein,ACP)、甲基转移酶(C-methyl transferase domain,C-Met)等[13]。

图3 聚酮合酶基因簇的功能结构Fig.3 The functional structure of polyketide synthases cluster
2005年,Shimizu等[14]对紫红曲霉(Monacuspurpureus)PKS的全长基因进行了克隆,得到了13 kb的基因片段。他们发现PKS基因的转录量与桔霉素的合成量成正比,而在利用同源重组敲除PKS基因的菌株中,桔霉素的合成被抑制。更进一步的研究发现紫红曲霉的PKS基因附近存在5个可能参与合成的开放阅读框(orf1~orf5),其中orf2(ctnA基因)的敲除会导致PKS基因表达的显著下调并严重影响桔霉素的产量[15]。
在此基础上,Wang等[16]发现培养紫红曲霉时以蓝光照射,能显著提高桔霉素的产量。用RT-qPCR分析发现,在蓝光照射下orf1,orf3,orf4基因在转录水平的表达上调,而PKS基因的表达量却没有显著变化,推测在蓝光照射条件下PKS基因并不是控制桔霉素产量的关键因素。Li等[17]以原生质体CaCl2/PEG法敲除了位于orf2和PKS之间的orf4(ctnB基因)。结果表明:3个转化子的桔霉素产量均大幅降低,但红曲霉及黄色素的产量与野生型相比并没有显著差异。随后Li等[18]克隆了(Monascusaurantiacus)PKS基因簇附近的片段,分析后发现其中一个基因(ctnG)与米曲霉(Aspergillusoryzae)中的β-碳酸酐酶具有较高的相似性。利用同源重组敲除该基因后,桔霉素的产量下降了50%,色素的产量减少了23%,推测ctnG基因可能与色素及桔霉素的前体丙二酰CoA的合成途径有关。国内的郭季冬和崔华[19,20]利用基因重组技术敲除了红曲霉PKS基因簇上游的orf3基因,结果发现突变株桔霉素产量分别降低了96%和87%,同时与野生株相比,突变株的色素产量也有了显著提高,推测是由于桔霉素合成途径的阻断导致底物向色素途径转移,从而提高色素产量。
Patrick等的研究发现在马尔尼菲青霉(Penicilliummarneffei)中,沉默PKS基因上游的4个开放阅读框(rp1~rp4)会导致PKS基因的表达下调,其中rp1可能是PKS基因的转录激活因子。研究者分别沉默了rp1~rp4和PKS基因,并使用超高效液质联用分析次级代谢产物,结果表明rp1~rp4和PKS基因的沉默均会导致色素产量的降低,但只有rp1和PKS基因被沉默时,桔霉素的产生被抑制,国内研究者也对红曲霉进行了类似的实验,但在敲除了红曲霉PKS基因后,发现其桔霉素的产量降低,但色素的产量却有提高[21]。
此外,也有研究报道G蛋白信号通路作为真菌中普遍存在的细胞跨膜转导途径可能也参与了桔霉素等次级代谢产物的合成[22,23]。李利等[24]发现在红曲霉菌株M7中,G蛋白α亚基编码基因(Mga1)被敲除后,桔霉素的产量提高了9倍,色素的产量也提高了71%。说明Mga1编码的G蛋白亚基可能与桔霉素和色素合成过程中的信号传导有关。
3 影响桔霉素产量的因素
由于桔霉素对肾脏的毒性及潜在的致畸和致癌可能,许多研究者都致力于筛选无桔霉素或桔霉素产量较低的菌株,并研究外部发酵条件对菌株桔霉素产量的影响。
许多研究者发现桔霉素的产量与培养环境中的溶氧量有关。Schmidt等[25]发现在Cu2+诱导下的氧胁迫环境中,随着Cu2+浓度的上升,青霉属Penicilliumverrucosum的次级代谢产物由赭曲霉素A逐渐向桔霉素转化。并证实了Penicilliumverrucosum与紫红曲霉相同,当cAMP的量上升时,桔霉素的产生受到抑制,这说明桔霉素的合成可能受到cAMP/PKA信号通路的调控。推测桔霉素具有抗氧化性,可应对氧胁迫及氧损伤。这一结果与Hajjaj等[26]的研究相符,他们控制了紫红曲霉(Monascusruber)发酵培养基中的溶氧量并发现当培养基中溶氧上升时,红曲色素和桔霉素的产量显著上升,且桔霉素产量上升大于色素。国内的朱宏军[27]也发现红曲中桔霉素的含量与培养基中的自由基含量成正相关,同时也观察到当超氧化物歧化酶(SOD)活性提高时,桔霉素的产量显著下降。研究者尝试在红曲培养基中人工添加抗氧化剂如β-胡萝卜素、维生素C、EDTA等,结果表明添加后桔霉素的含量均下降了90%以上,同时提高了50%的色价。推测是由于红曲色素和桔霉素合成途径部分重合,当桔霉素合成被抑制时相应的色素产量就会上升。邢淑婕等[28]也发现当红曲培养基的装液量从75 mL提升至200 mL时,桔霉素的产量下降了90%。马博雅等[29]在有氧与缺氧条件下分别培养红曲霉,并监测相关基因表达的情况,结果发现与有氧培养相比,无氧状态下的红曲霉桔霉素产量低40.16%,且orf2基因的表达量总是低于有氧条件,orf7基因的表达量总是高于有氧条件,因此推测桔霉素的合成被orf7基因的表达抑制,而与orf2基因的表达成正相关,这与之前国外Shimizu等的研究结果一致。
Hajjaj等[30]研究了培养基中不同的氨基酸对紫红红曲胞外桔霉素和色素的影响。他发现除了赖氨酸外,紫红红曲在以其他12种常见氨基酸为氮源时均能生长,当培养基中唯一氮源为甘氨酸、酪氨酸、组氨酸时,色素的产量较高,桔霉素的产量较少;当氮源为谷氨酸、丙氨酸、脯氨酸时桔霉素产量较高。其中以组氨酸为氮源时,150 h培养后红曲色素的产量可达到715 mg/L,桔霉素未检出。研究者推测桔霉素可能被组氨酸代谢过程中积累的过氧化氢所降解[31]。
康碧玉等[32,33]发现在红曲霉发酵过程中的pH受氮源的影响较大,发酵液的最终pH是影响桔霉素和色素合成的关键因素。随着发酵液的pH增大(pH 3.0~5.5),胞外的色素浓度也增高。当发酵液最终pH低于3.0时,桔霉素的生物合成被抑制。同时有研究者发现:紫红红曲的桔霉素和色素产量在pH 5.5上升至pH 8.0时,下降了90%和60%[34],说明过酸(<3.0)或过碱(>8.0)的环境均能有效抑制桔霉素的合成。岳建明等[35]的研究也发现添加0.3 mol/L NH4+的(NH4)2SO4的发酵液中桔霉素含量降为0.05 mg/L,较对照组降低88.6%,说明在培养基中添加铵盐可以通过降低pH的方式减少桔霉素的产生。
Tan等[36]在紫红红曲培养基中添加4%的乙醇后,发现红曲的桔霉素产量从38 mg/kg减少至2 mg/kg,但菌体干重却上升50%,说明聚酮类化合物的产量减少并非通过抑制菌体生长而是改变了红曲的代谢通路。此外,研究者以2D-PAGE分析加入4%乙醇后对蛋白表达的影响,发现除了聚酮合酶相关蛋白的表达下调外,乙醛脱氢酶和脂肪酸合酶的表达也有显著下调。推测乙醇对于桔霉素产量的下调不仅靠阻断聚酮合酶合成的通路,同时也降低了聚酮类化合前体(乙酰CoA)的合成。
张晓伟等[37]发现分别以蓝光和日光照射8 h后,桔霉素的保存率为64%和76%;而以紫外光照射5 min后,桔霉素的降解就会达到50%。推测由于桔霉素的最大吸收峰在330 nm波长处,可以吸收紫外和蓝光的光量子,从而导致桔霉素的降解。
4 展望
近年来,随着超高效液相色谱等分离技术的发展,对桔霉素合成过程中的步骤已有了较为全面的研究,但是桔霉素的合成调控的详细机理仍未得到阐明。许多的研究已发现桔霉素的合成并非仅依靠PKS基因簇,可能涉及到多个信号通路的协同作用,包括跨膜的G蛋白信号转导、cAMP信号通路等。这些研究说明桔霉素的合成与外界环境之间的紧密联系,为下一步通过特定的培养基成分或培养条件定向调节真菌桔霉素产量奠定了基础。
[1]Hetherington A C,Raistrick H.On the production and chemical constitution of a new yellow colouring matter, citrinin,produced from glucose byPenicilliumcitrinumThom[J].Philosophical Transactions of the Royal Society of London.Series B,Containing Papers of a Biological Character,1931,220:269-295.
[2]Brown J P,Cartwright N J,Robertson A,et al.Structure of citrinin[J].Nature,1948,162(6):72.
[3]Dubravka Flajs,Maja Peraica.Toxicological properties of citrinin[J].Archives of Industrial Hygiene and Toxicology,2009,60(4):457-464.
[4]Josef Bohm,Sarah De Saeger,Lutz Edler,et al.Scientific opinion on the risks for public and animal health related to the presence of citrinin in food and feed[J].European Food Safety Authority Journal,2012,10(3):81-82.
[5]Manoj Kumar,Prabhaker Dwivedi,Anil K Sharma,et al.Ochratoxin A and citrinin nephrotoxicity in New Zealand white rabbits: an ultrastructural assessment[J].Mycopathologia,2007,163(1):21-30.
[6]Krough P,Hasselager E,Friis P.Studies on fungal nephrotoxicity:2.Isolation of two nephrotoxic compounds fromPenicilliumviridicatumWestling: citrinin and oxalic acid[J].Acta Pathologica et Microbiologica Scandinavica Section B,1970,78: 401-413.
[7]Hood R D,Hayes A W,Scammell J G.Effects of prenatal administration of citrinin and viriditoxin to mice[J].Food and Cosmetics Toxicology,1976,14(3):175-178.
[8]Reddy R V,Maruya K,Wallace Hayes A,et al.Embryocidal teratogenic and fetotoxic effects of citrinin in rats[J].Toxicology,1982,25(2):151-160.
[9]Anne Molinié,Virginie Faucet,Marcel Castegnaro,et al.Analysis of some breakfast cereals on the French market for their contents of ochratoxin A,citrinin and fumonisin B1: development of a method for simultaneous extraction of ochratoxin A and citrinin[J].Food Chemistry,2005,92(3):391-400.
[10]Hassan Hajjaj,Alain Klaébé,Marie O Loret,et al.Biosynthetic pathway of citrinin in the filamentous fungusMonascusruberas revealed by 13 C nuclear magnetic resonance[J].Applied and Environmental Microbiology,1999,65(1):311-314.
[11]He Y,Cox R J.The molecular steps of citrinin biosynthesis in fungi[J].Chem.Sci.,2016,7(3):2119-2127.
[12]Du Liangcheng,Lou Lili.PKS and NRPS release mechanisms[J].Natural Product Reports,2010,27(2):255-278.
[13]Cox R J.Polyketides,proteins and genes in fungi:programmed nano-machines begin to reveal their secrets[J].Organic & Biomolecular Chemistry,2007,5(13):2010-2026.
[14]Shimizu T,Kinoshita H,Ishihara S,et al.Polyketide synthase gene responsible for citrinin biosynthesis inMonascuspurpureus[J].Appl Environ Microbiol,2005,71(7):3453-3457.
[15]Takeo Shimizu,Hiroshi Kinoshita,Takuya Nihira.Identification and in vivo functional analysis by gene disruption of ctnA,an activator gene involved in citrinin biosynthesis inMonascuspurpureus[J].Applied and Environmental Microbiology,2007,73(16):5097-5103.
[16]Wang C,Yang H,Chen M,et al.Real-time quantitative analysis of the influence of blue light on citrinin biosynthetic gene cluster expression inMonascus[J].Biotechnol Lett,2012,34(9):1745-1748.
[17]Li Y P,Pan Y F,Zou L H,et al.Lower citrinin production by gene disruption of ctnB involved in citrinin biosynthesis inMonascusaurantiacusLi AS3.4384[J].J Agric Food Chem,2013,61(30):7397-7402.
[18]Li Y P,Tang X,Wu W,et al.The ctnG gene encodes carbonic anhydrase involved in mycotoxin citrinin biosynthesis fromMonascusaurantiacus[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2015,32(4):577-583.
[19]郭季冬.红曲霉桔霉素合成相关基因的筛选与功能验证[D].天津:天津科技大学,2014.
[20]崔华.橙色红曲菌桔霉素合成相关基因orf3和ctnE缺失菌株的构建及其相关分析[D].南昌:南昌大学,2012.
[21]周礼红.红曲霉遗传转化系统及桔霉素 Monacolin K 生物合成相关 PKS 基因的克隆与功能鉴定[D].无锡:江南大学,2005.
[22]Tsuyoshi Miyake,Ming-Yong Zhang,Isato Kono,et al.Repression of secondary metabolite production by exogenous cAMP inMonascus[J].Bioscience,Biotechnology,and Biochemistry,2006,70(6):1521-1523.
[23]李利,陈莎,陈福生,等.红曲菌次生代谢产物生物合成途径及相关基因的研究进展[J].微生物学通报,2013,40(2):294-303.
[24]Li L,Shao Y,Li Q,et al.Identification of Mga1,a G-protein alpha-subunit gene involved in regulating citrinin and pigment production inMonascusruberM7[J].FEMS Microbiol Lett,2010,308(2):108-14.
[25]Schmidt-Heydt M,Stoll D,Schutz P,et al.Oxidative stress induces the biosynthesis of citrinin byPenicilliumverrucosumat the expense of ochratoxin[J].Int J Food Microbiol,2015,192:1-6.
[26]Hajjaj H,Blanc P J,Groussac E,et al.Improvement of red pigment/citrinin production ratio as a function of environmental conditions byMonascusruber[J].Biotechnology and Bioengineering,1999,64(4):497-501.
[27]朱宏军.安全型色素红曲的定向调节及其机理的研究[D].武汉:湖北工业大学,2013.
[28]邢淑婕,刘开华.培养条件对红曲霉产红曲红色素及桔霉素影响的研究[J].中国食品添加剂,2010(1):112-115.
[29]马博雅,张佳,王雪莲,等.缺氧对红曲霉桔霉素相关基因表达量及产量的影响[J].中国酿造,2016,35(7):143-146.
[30]Hajjaj H,Francois J M,Goma G,et al.Effect of amino acids on red pigments and citrinin production inMonascusruber[J].J Food Sci,2012,77(3):156-159.
[31]Hassan Hajjaj,Alain Klaebe,Gerard Goma,et al.Medium-chain fatty acids affect citrinin production in the filamentous fungusMonascusruber[J].Applied and Environmental Microbiology,2000,66(3):1120-1125.
[32]Kang B,Zhang X,Wu Z,et al.Production of citrinin-freeMonascuspigments by submerged culture at low pH[J].Enzyme Microb Technol,2014,55:50-57.
[33]康碧玉.红曲霉菌萃取发酵及其次级代谢产物的调控[D].广州:华南理工大学,2014.
[34]Sandra Fernanda Bilbao Orozco,Beatriz Vahan Kilikian.Effect of pH on citrinin and red pigments production byMonascuspurpureusCCT3802[J].World Journal of Microbiology and Biotechnology,2008,24(2):263-268.
[35]岳建明,杨强,肖潇,等.铵盐对紫色红曲霉合成代谢红曲色素及桔霉素的影响[J].食品科学,2016,37(5):102-107.
[36]Ya-Yun Tan,Wei-Hsuan Hsu,Tsung-Wei Shih,et al.Proteomic insight into the effect of ethanol on citrinin biosynthesis pathway inMonascuspurpureusNTU 568[J].Food Research International,2014,64:733-742.
[37]张晓伟,王昌禄,陈勉华,等.理化因子对红曲色素色价的影响及桔霉素的光降解性[J].食品科学,2013,34(15):17-21.
Research Progress on Biosynthesis and Regulation of Citrinin
WU Shen-mao1,2,3,4, YU Hua-ning1,2,3,4*
(1.State Key Laboratory of Dairy Biotechnology, Shanghai 200436, China;2.Shanghai EngineeringResearch Center of Dairy Biotechnology, Shanghai 200436, China;3.Synergetic InnovationCenter of Food Safety and Nutrition Dairy Research Institute, Shanghai 200436, China;4.Bright Dairy & Food Co., Ltd., Shanghai 200436, China)
Citrinin is one of the well-known mycotoxins and polyketides, which has been proved to be nephrotoxic and potentially embryocidal and carcinogenic. It is a secondary metabolite produced by several fungal strains belonging to the generaPenicillium,AspergillusandMonascus. The contamination of citrinin now threatens the food safety and fungus fermentation. Therefore, how to reduce and eliminate the production of citrinin has become a hot topic.In recent years, with the development of molecular biological approaches, many researchers have explored the biosynthesis and regulation of fungal secondary metabolites. The latest achievements are summarized in this paper, which has set up the foundation for reducing the production of citrinin in fungus fermentation and providing high-efficient industrial fungal strains.
citrinin;polyketide synthase;Monascus
2017-02-03 *通讯作者
上海优秀技术带头人项目(14XD1420300)
吴申懋(1989-),男,硕士,研究方向:微生物与食品安全;
于华宁(1981-),男,博士,研究方向:微生物与食品安全。
TS201.3
A
10.3969/j.issn.1000-9973.2017.08.039
1000-9973(2017)08-0175-06

