肺腺癌组织中TTF-1表达变化及其与EGFR基因突变、患者预后的关系
张旭刚,李维青,高颖,李志田,姜福胜,魏博
(首都医科大学附属北京世纪坛医院,北京 100038)
肺腺癌组织中TTF-1表达变化及其与EGFR基因突变、患者预后的关系
张旭刚,李维青,高颖,李志田,姜福胜,魏博
(首都医科大学附属北京世纪坛医院,北京 100038)
目的 观察肺腺癌组织甲状腺转录因子1(TTF-1)表达变化,并分析其与表皮生长因子受体(EGFR)基因突变、患者预后的关系。方法 肺腺癌患者192例,观察其TTF-1表达变化及EGFR基因突变情况,分析TTF-1阳性表达、EGFR基因突变与肺腺癌临床病理参数的关系,另采用Kaplan-Meier生存分析、Log Rank检验及Cox风险回归模型分析影响患者预后的因素。结果 192例患者中,TTF-1阳性表达157例(81.8%)、阴性表达35例(18.2%),EGFR基因突变型80例(41.7%)、野生型112例(58.3%)。TTF-1阳性表达与肺腺癌TNM分期相关,EGFR基因突变与肺腺癌患者性别、吸烟史相关,P均<0.05。157例TTF-1阳性患者中有79例(50.3%)发生EGFR基因突变,而35例TTF-1阴性患者中仅有1例(2.9%)发生EGFR基因突变,TTF-1阳性表达与EGFR突变有相关性(P<0.05)。单因素生存分析显示,TTF-1阳性、EGFR基因突变、年龄、PS评分、TNM分期与患者预后相关(P均<0.05)。多因素生存分析显示,TTF-1阳性、EGFR基因突变、TNM分期早期、PS评分0~2分是肺腺癌远期生存的独立影响因素(P均<0.05)。结论 检测肺腺癌组织TTF-1表达情况有助于初步预测肺腺癌EGFR基因突变状态及判断患者预后。
肺癌;非小细胞肺癌;肺腺癌;甲状腺转录因子1;表皮生长因子受体
肺癌的发病率和病死率居所有肿瘤的前列,其中非小细胞肺癌(NSCLC)占肺癌总数的80%以上,而腺癌发病率逐年升高,约占NSCLC的50%[1]。近年来,酪氨酸激酶抑制剂(TKIs)等靶向药物的应用,使肺癌患者预后及治疗反应优于细胞毒性药物,尤其是针对有表皮生长因子受体(EGFR)基因突变患者[2]。以EGFR基因为靶点治疗NSCLC是目前治疗肺癌的前沿手段,而且寻找可预测NSCLC患者EGFR基因突变及远期生存的免疫组化指标备受关注。现阶段检测EGFR基因的方法多样,主要有直接测序法、扩增阻滞突变系统、突变高效液相色谱法等,这些方法对组织标本、实验设备等要求高,且因费时、费用高而不便于推广。因此有必要寻找一种经济、便捷、准确预测EGFR基因突变的指标。甲状腺转录因子1(TTF-1)常表达于肺及甲状腺组织中,是肺腺癌特异的免疫组化诊断标志物,有助于转移性腺癌和原发性肺腺癌的鉴别[3]。既往文献[4~6]表明,TTF-1表达与EGFR基因突变之间存在一致性,且TTF-1表达影响患者远期生存。本研究观察了肺腺癌组织TTF-1表达变化,并分析其与EGFR基因突变、患者预后的关系。
1 材料与方法
1.1 材料 选取北京世纪坛医院保存的肺腺癌标本192例份,其中手术标本(切除或活检)88例份,穿刺标本47例份,支气管镜标本32例份,远处转移灶标本25例份。患者男85例,女107例;年龄27~87岁,中位年龄56.5岁;≤65岁132例,>65岁60例;吸烟史(一生中连续或累积吸烟6个月以上)80例;TNM分期参照2009年国际抗癌联盟(UICC)公布的修订后的第七版国际肺癌分期法,其中Ⅰ期19例、Ⅱ期31例、Ⅲa期46例、Ⅲb期36例、Ⅳ期60例;采用美国东部协作肿瘤组的PS评分标准,评分0~1分者165例,2分及以上者27例。
1.2 TTF-1检测方法 组织标本用10%中性甲醛固定,脱水后以石蜡包埋,4 μm连续切片,采用小鼠抗人TTF-1单克隆抗体试剂(北京中杉金桥生物技术公司,克隆号:SPT24),以En Vision免疫组化法检测TTF-1。TTF-1表达于细胞核,高倍视野下阳性细胞为染色出现棕黄色或褐色。
1.3 EGFR基因突变检测方法 采用扩增阻滞突变系法进行RT-PCR扩增,检测外显子18、19、20、21突变。EGFR基因突变检测试剂盒(共29种突变位点)购于厦门艾德生物医药科技公司,采用StrataGene MX3000P实时荧光定量PCR仪(德国)进行扩增,具体实验步骤参照试剂盒说明书进行。结果判定:样品的外控信号扩增曲线的Ct值<26则提示有突变,Ct值≥26则为野生型。
1.4 患者生存观察 总生存期定义为患者从病理确诊开始至死亡或2016年3月30日。随访截止至2016年3月30日,随访时间2~71个月,中位随访时间23.5个月。所有患者中获得随访181例(100例死亡,81例存活),失访11例。
1.5 统计学方法 采用SPSS17.0统计软件。组间比较采用χ2检验或Fisher精确检验。单因素分析使用χ2检验,多因素分析用非条件Logistic回归分析。应用Kaplan-Meier曲线进行生存分析,组间差异采用Log Rank检验。采用Cox风险回归模型分析影响患者预后因素。P<0.05为差异有统计学意义。
2 结果
192例患者中,TTF-1阳性表达157例(81.8%),阴性表达35例(18.2%);EGFR基因突变型80例(41.7%),野生型112例(58.3%)。TTF-1阳性表达、EGFR基因突变与肺腺癌临床病理参数的关系见表1,由表1可知,TTF-1阳性表达与肺腺癌TNM分期相关,EGFR基因突变与肺腺癌患者性别、吸烟史相关,P均<0.05。157例TTF-1阳性患者中有79例(50.3%)发生EGFR基因突变,而35例TTF-1阴性患者中仅有1例(2.9%)发生EGFR基因突变,TTF-1阳性表达与EGFR基因突变有明显相关性(P<0.05)。
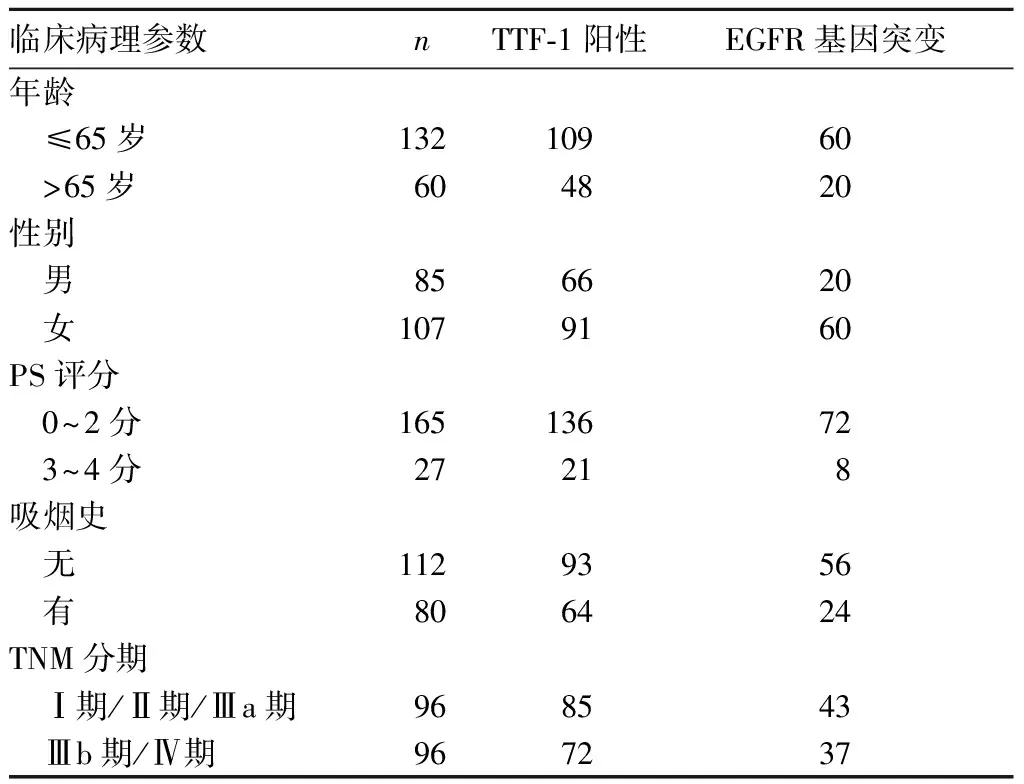
表1 TTF-1阳性表达、EGFR基因突变与肺腺癌临床病理参数的关系(例)
TTF-1阳性患者中位生存时间48个月(95%CI=35.1~60.9),阴性患者13个月(95%CI=5.1~20.9),Kaplan-Meier生存曲线显示阳性患者优于阴性患者;EGFR基因突变型患者中位生存时间58个月(95%CI=46.3~69.7),野生型患者28个月(95%CI=11.2~44.8),K-M生存曲线显示突变型患者优于野生型患者。不同因素患者中位生存期比较见表2,由表2可知TTF-1阳性、EGFR突变、年龄、PS评分级、TNM分期与患者预后相关,而性别及吸烟与患者预后无关。
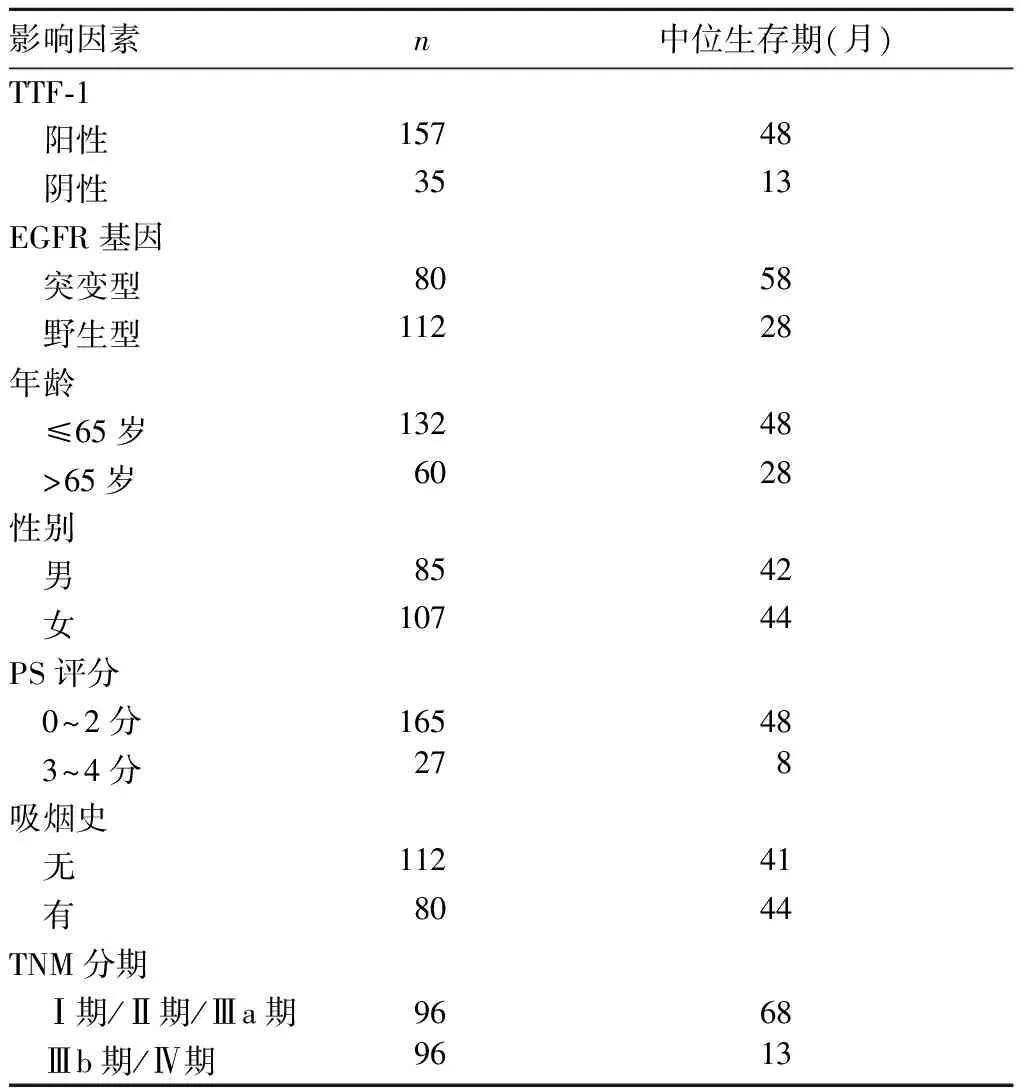
表2 不同因素患者中位生存期比较
多因素COX回归分析结果见表3,由表3可知TTF-1阳性、EGFR突变、TNM分期早期、PS评分0~2分是肺腺癌远期生存的独立影响因素,而高龄(年龄>65岁)不是其独立影响因素。
3 讨论
TTF-1是NKX2转录基因家族的成员之一,位于人类染色体14q13.3,编码的蛋白含有371~378个氨基酸,生理情况分布于甲状腺、呼吸道上皮的Ⅱ型Clara细胞及部分大脑前腹侧核等[7]。研究发现,在肺腺癌和小细胞型肺癌中TTF-1高表达;然而在大细胞性肺癌和肺鳞癌中,TTF-1多不表达,临床将TTF-1视为肺腺癌特异的免疫组化诊断标志物。
本研究显示,肺腺癌TTF-1阳性率为81.8%(157/192),此结果与亚洲人群报导相近(沙特阿拉伯人群为83.3%[8]),略高于西方人群(法国人群为66%[9],英国人群为73%[10])。
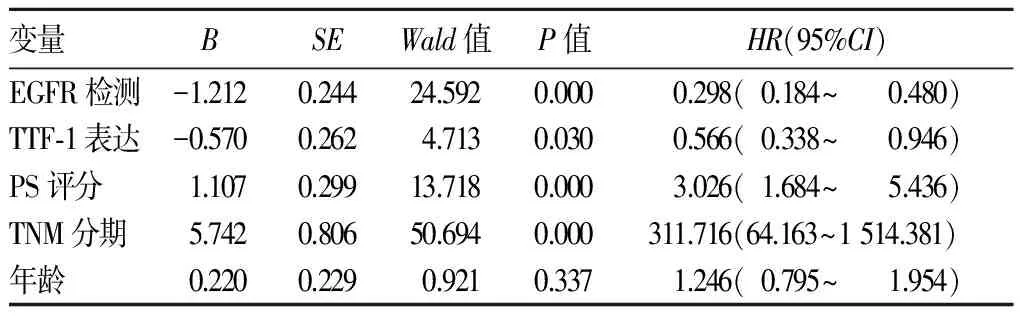
表3 多因素COX回归分析结果
进一步分析TTF-1表达与EGFR基因突变的关系,本组157例TTF-1阳性患者中有79例发生EGFR基因突变,而TTF-1阴性患者35例中仅有1例发生EGFR基因突变,提示TTF-1阳性表达预测EGFR为突变型意义重大。Somaiah等[11]报道,224例TTF-1阴性表达患者仅有2例EGFR基因突变,TTF-1预测EGFR基因突变的灵敏度和特异度分别为99.1%、36.4%。相关基础研究发现,EGFR基因突变最常见于“终末呼吸单位”的肺腺癌,其起源于Ⅱ型肺泡上皮、肺Clara细胞和无纤毛柱状上皮细胞的肺组织中,而上述细胞常表达TTF-1[12]。
大部分研究倾向于TTF-1阳性表达是NSCLC患者有利预后因素,Chung[13]等研究分析496例晚期腺癌,TTF-1阳性表达者总生存期27.4个月,而阴性表达者总生存期11.8个月,差异有统计学意义。一项分析中[14]包括17项研究的2 235例患者,表达TTF1的NSCLC是生存有利的影响因素,尤其是在Ⅰ期及Ⅲb/Ⅳ期患者中。
Nakamura等[15]认为,由于TTF-1生理状况下参与调节肺上皮组织发育、分化,因此可以推测肿瘤中TTF-1阳性代表着肿瘤尚保留一定的正常分化能力,说明肿瘤细胞相对分化成熟,其侵袭力较弱。Winslow等[16]发现,低分化的肺癌中TTF-1表达多为阴性;TTF-1可以控制肿瘤分化程度及限制恶性细胞转移的潜能。本研究单因素生存分析显示,TTF-1阳性、EGFR基因突变、年龄、PS评分、TNM分期与患者预后相关,多因素生存分析显示TTF-1阳性、EGFR基因突变、TNM分期早期、PS评分0~2分是肺腺癌远期生存的独立影响因素。上述结果提示,TTF-1在肺腺癌发生发展过程中起重要作用,其表达的缺失引起肿瘤侵袭性增强,分化程度降低,从而影响患者预后。
总之,TTF-1是一个预测肺腺癌EGFR基因突变状态的免疫组化指标,对于尚未开展EGFR基因检测的医疗机构,可以检测TTF-1用于靶点基因的初步筛选。TTF-1在肺腺癌的发生发展过程中起着重要作用,其阳性表达是肺腺癌患者有利的预后因素。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015,65(1):5-29.
[2] Shi Y, Au SK, Thongprasert S, et al. A prospective, molecular epidemiology study of EGFR mutations in asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology(PIONEER)[J]. J Thorac Oncol, 2014,9(2):154-162.
[3] Ye J, Findeis-Hosey JJ, Yang Q, et al. Combination of napsin A and TTF-1 immunohistochemistry helps in differentiating primary lung adenocarcinoma from metastatic carcinoma in the lung[J]. Appl Immunohistochem Mol Morphol, 2011,19(4):313-317.
[4] Sheffield BS, Bosdet IE, Ali RH, et al. Relationship of thyroid transcription factor 1 to EGFR status in non-small-cell lung cancer[J]. Current Oncology, 2014,21(6):305-308.
[5] 韩一平,张鹏,黄玲,等.肺癌组织Napsin A和TTF-1表达及其临床价值[J].中华肿瘤防治杂志,2010,17(3):194-197.
[6] 姚娟,王建军,王海燕,等.肺腺癌组织TTF-1和EGFR表达及与EGFR第19、21号外显子突变的关系[J].临床肿瘤学杂志,2015(4):338-342.
[7] Anagnostou VK, Syrigos KN, Bepler G, et al. Thyroid transcription factor 1 is an independent prognostic factor for patients with stage I lung adenocarcinoma [J]. Clin Oncol, 2009,27(2):271-278.
[8] Elsamany SA, Alfayea TM, Alzahrani AS, et al. Thyroid transcription factor-1 expression in advanced non- small cell lung cancer: impact on survival outcome[J]. Asian Pac J Cancer Prev, 2015,16(7):2987-2991.
[9] Barlési F, Pinot D, Legoffic A, et al. Positive thyroid transcription factor 1 staining strongly correlates with survival of patients with adenocarcinoma of the lung[J]. Br J Cancer, 2005,93(4):450-452.
[10] Stenhouse G, Fyfe N, King G, et al. Thyroid transcription factor 1 in pulmonary adenocarcinoma[J]. J Clin Pathol, 2004,57(4):383-387.
[11] Somaiah N, Garrettmayer E, Huang X, et al. Use of negative thyroid transcription factor (TTF-1) status to predict for negative epidermal growth factor receptor (EGFR) mutations (Mts) status with a high negative predictive value (NPV) in patients (pts) with adenocarcinomas (AC) of the lung[J]. J Clin Oncol, 2011,29(15):2696-2696.
[12] Peterson MR, Piao Z, Bazhenova LA, et al. Terminal respiratory unit type lung adenocarcinoma is associated with distinctive EGFR immunoreactivity and EGFR mutations[J]. Appl Immunohistochem Mol Morphol, 2007,15(3):242-247.
[13] Chung KP, Huang YT, Chang YL, et al. Clinical significance of thyroid transcription factor-1 in advanced lung adenocarcinoma under epidermal growth factor receptor tyrosine kinase inhibitor treatment[J]. Chest, 2012,141(2):420-428.
[14] Qian HH, Xu TS, Cai XQ, et al. Prognostic value of TTF-1 expression in patients with non-small cell lung cancer: a meta-analysis[J]. Clinica Chimica Acta, 2015,451(Pt B):208-214.
[15] Nakamura N, Miyagi E, Murata S, et al. Expression of thyroid transcription factor-1 in normal and neoplastic lung tissues[J]. Mod Pathol, 2002,15(10):1058-1067.
[16] Winslow MM, Dayton TL, Verhaak RG, et al. Suppression of lung adenocarcinoma progression by Nkx2-1[J]. Nature, 2011,473(7345):101-104.
北京市卫生系统高层次卫生技术人才队伍建设专项经费;北京市属医院科研培育计划项目(PX2016044);北京世纪坛医院院青年基金资助项目(2015-q10)。
魏博(E-mail: weibos@126.com)
10.3969/j.issn.1002-266X.2017.31.012
R734.2
B
1002-266X(2017)31-0044-03
2017-06-14)

