丹参酮ⅡA对脓毒症小鼠脑软膜微血流速度和脑组织炎性介质水平的干预作用*
张友平 占大钱 陈华文 吕 青 祝 伟,#
基础与实验 ▶
丹参酮ⅡA对脓毒症小鼠脑软膜微血流速度和脑组织炎性介质水平的干预作用*
张友平1占大钱1陈华文1吕 青2祝 伟1,#
目的:探讨丹参酮ⅡA(STS)对脓毒症小鼠脑微血流和神经炎症反应的干预作用。方法:32只昆明小鼠常规开颅窗后随机分成4 组:假手术组(Sham组)、STS对照组(STS组)、脓毒症模型组(LPS组)、STS治疗组(LPS+STS组)。LPS组和LPS+STS组小鼠经腹腔注射内毒素(LPS,5mg/μg体重)制备脓毒症模型小鼠,1h后造模成功,随后STS组和LPS+STS组腹腔注射STS(10mg/kg)。应用BI2000型微循环图像处理系统,通过开放式颅窗观察各组小鼠不同时相(造模前,成模后2h,成模后4h)软脑膜微静脉、微动脉血流速度,用 ELISA检测成模后4h小鼠脑海马组织内肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的水平变化。结果:LPS组小鼠于成模后2h、4h软脑膜微动脉、微静脉血管血流速度较Sham组明显减慢(P<0.01);脑海马组织成模后4h TNF-α和IL-1β的水平较Sham组明显升高(P<0.01)。LPS+STS组成模后2h、4h微动脉、微静脉血流速度较LPS组明显加快,脑海马组织TNF-α和IL-1β的水平较LPS组显著降低 (P<0.01)。结论:STS可改善脓毒症小鼠脑微血流速度,减轻神经炎症反应,发挥脑保护作用。
丹参酮ⅡA;脓毒症后脑损伤;微循环;炎性因子;小鼠
脓毒症是临床常见危重症,进一步发展可导致多器官功能障碍综合征(Multiple Organ Dysfunction Syndrome, MODS),危害极大。脑是脓毒症的重要靶器官之一。脓毒症后出现的弥漫性脑损伤被称之为脓毒症相关性脑病(Septic Associated Encephalopathy,SAE),发病率高达49%-63%。SAE可以导致多种神经系统功能障碍出现,增加脓毒症患者病死率,其病理生理机制较复杂,包括:脑微血管内皮细胞功能障碍、脑局部炎性细胞激活、炎性细胞因子增加、氧化应激、细胞凋亡等多方面[1]。其中,脑微循环障碍和神经炎症反应是SAE的重要病理生理基础。既往研究表明,丹参酮ⅡA(Sodium Tanshinone ⅡA Sulfonate,STS)可以通过改善脓毒症大鼠肠微循环障碍,保护肠组织[2-4]。其它研究发现,STS可以减轻脑血管意外患者的脑损伤[5,6]。本研究通过腹腔注射内毒素(LPS)制备脓毒症小鼠模型, 并以STS干预,观察小鼠软脑膜微血流的变化探讨STS对脓毒症小鼠的脑保护作用。
1 材料与方法
1.1 实验动物、试剂和仪器
健康成年昆明种小鼠32只,清洁级,雌雄兼用,体质量20-25g,由华中科技大学同济医学院实验动物中心提供,许可证号:SCXK(鄂)2010-0007,动物证号:00018517。STS(上海第一生化公司生产,批号100218,浓度10mg/20ml);肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒(中国CUSABIO,CSB-EQ023955MO);白细胞介素-β(IL-1β)ELISA检测试剂盒(美国R&D Systems, MLB00C,Minneapolis);内毒素检测试剂盒(美国Sigma公司,批号L2880);BI2000图像分析系统(成都泰盟电子有限公司);WX-9型多部位微循环显微仪(徐州光学仪器总厂)。
1.2 脓毒症小鼠模型制备[7]和动物分组处理
将小鼠俯卧位固定,切开颅顶部皮肤,暴露颅骨,以矢状缝外2mm、冠状缝下3mm为中心用手术刀片挑开颅骨和硬脑膜,制备直径大小约3mm的颅窗。随机选择16只小鼠平分为脓毒症模型组(LPS组)和STS治疗组(LPS+STS组),制备脓毒症模型,即一次性腹腔注射LPS(5mg/kg)[1]。另16只小鼠平分为假手术组(Sham组)和STS对照组(STS组),腹腔注射等量生理盐水[8]。1h后脓毒症小鼠模型全部成模,STS组和LPS+STS组腹腔注射STS(10mg/kg),Sham组和LPS组腹腔注射等量生理盐水。
1.3 观察指标和方法
于不同时相将小鼠颅窗置于微循环显微仪下,以冷光源照射,经显微摄像通过BI2000图像分析系统从电脑屏幕上观察软脑膜微循环并录像,测量微静脉和微动脉血流速度。实验过程中,动物体温经水循环系统保持在37.0±0.5℃,颅窗内用ACSF(37℃)保持软脑膜湿润。
1.3.1 脑微循环观测:于造模前、成模后2h、成模后4h分别观察软脑膜微动脉、微静脉血流速度。
1.3.2 脑海马组织TNF-α和IL-1β检测:微血流观测完毕后(成模后4h),以颈椎脱臼处死小鼠后迅速分离海马区脑组织(约40mg)置于盛有冰醋酸缓冲液的匀浆器中,匀浆后将组织粉碎的悬浮液转至干燥试管内,静置并离心,将上清液收集在小瓶内,-20℃保存。检测时严格按照仪器和试剂说明书,采用ELISA 法测定脑组织TNF-α和IL-1β含量。
1.5 统计学处理
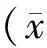
2 结果
2.1 实验各组小鼠软脑膜微动脉、微静脉血流速度比较
各组间比较造模前,各组小鼠间软脑膜微动脉和微静脉血流速度差异无统计学意义(F=0.135,P>0.05)。成模后2h和4h,各组软脑膜微动脉和微静脉血流速度差异有统计学意度(F=38.1、48.1,P<0.01)。与Sham组比较,STS组微动脉、微静脉血流速度无明显差异(t均<0.2,P>0.05);LPS组和LPS+STS组微动脉、微静脉血流速度都显著减慢(t均>8.0,P<0.01);LPS+STS组微动脉、微静脉血流速度较LPS组都显著加快(t均>3.0,P<0.01)。见表1、表2。
各组内比较,Sham组和STS组各时相微动脉、微静脉血流速度差异均无统计学意义(P>0.05)。LPS组成模后2h和4h,微动脉、微静脉血流速度均较成模前减慢(t均>6.0,P<0.01),成模后4h较2h更慢(t均>3.6,P<0.01)。LPS+STS组成模后2h和4h,微动脉、微静脉血流速度均较成模前减慢(t均>6.3,P<0.01),但成模后2h和4h,微动脉、微静脉血流速度差异无统计学意义(t均<0.8,P>0.05)。见表1、表2。
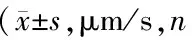
表1 实验各组小鼠软脑膜微动脉血流速度均=8)
注: 与Sham组比较,1)P<0.01;与LPS组比较,2)P<0.01;与同组内造模前比较,3)P<0.01;与同组内成模后2h比较,4)P<0.01
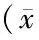
表2 实验各组小鼠软脑膜微静脉血流速度±s,μm/s,n均=8)
注: 与Sham组比较,1)P<0.01;与LPS组比较,2)P<0.01;与同组内造模前比较,3)P<0.01;与同组内成模后2h比较,4)P<0.01
2.2 各组小鼠脑海马组织TNF-α和IL-1β水平比较
成模4h后,四组TNF-α和IL-1β水平差异均有统计学意义(F=62.7、38.6,P<0.01)。Sham组与STS组小鼠脑海马组织TNF-α和IL-1β水平差异无统计学意义(t=0.07、0.10,P>0.05);LPS组海马组织TNF-α和IL-1β水平较Sham组明显升高(t=8.6、7.4,P<0.01);但LPS+STS组TNF-α和IL-1β水平较LPS组显著降低(t=8.3、6.0,P<0.01)。见图1、图2。

注:与Sham组比较,*P<0.01;与LPS组比较,#P<0.01
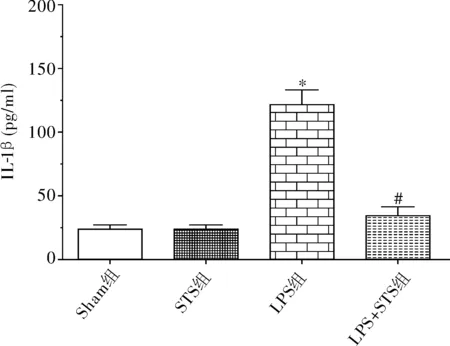
注:与Sham组比较,*P<0.01;与LPS组比较,#P<0.01
3 讨论
脓毒症是临床常见危重症,有极高的病死率。随着人口老龄化和侵入性治疗的增多,脓毒症的发病率也逐渐升高,全球每年新增数百万脓毒症患者,其中超过1/4的患者死亡[9],带来沉重的社会负担,也给现代医学提出了巨大的挑战。作为一种致命而危险的临床综合征,脓毒症加重可以累及不同脏器,导致不同器官功能障碍。其中,脓毒症后出现的SAE发病率高达49%-63%[1],可导致多种神经功能障碍,增加死亡风险。SAE的发生,被认为与血脑屏障功能障碍、脑微循环障碍、神经炎症反应、氨基酸和神经递质异常、线粒体功能障碍、氧化应激和凋亡等有关[1]。虽然其具体发病机制仍未完全阐明,但目前普遍认为脑微循环障碍和神经炎症反应是SAE的重要病理生理基础。
本实验观察到脓毒症模型小鼠软脑膜微动脉、微静脉血流速度缓慢,其原因可能为SAE与脑血管自主调节功能障碍相关[10],活体显微镜也观察到脓毒症时大量的血小板和白细胞粘附于脑后微静脉,阻碍微循环,导致微循环血流减慢,最终严重影响脑功能[11]。Taccone 等发现即使全身灌注压维持在正常水平, 仍可出现脑微循环异常[12]。这些研究都提示脑灌注的改变可能是SAE发生的重要机制。
此外,本实验还发现脓毒症模型小鼠脑海马组织内TNF-α和IL-1β水平明显升高。TNF-α 是参与脓毒症全身炎症反应的重要细胞因子,它可激活核因子-κB(Nuclear Factor-κB,NF-κB) 介导其它细胞因子( 如 IL-1) 的合成与释放, 启动炎症级联反应,从而导致炎症反应失控[13]。神经炎症反应也是脓毒性脑病发病的重要机制之一,脓毒症时TNF-α、 IL-1β、 IL-6 mRNA 及其受体显著上调,这些细胞因子可以激活和放大炎症反应并导致诸如发热、 纳差、 疲劳、 认知下降、 注意力不集中、精神萎靡、 社会退缩、 活动减少和体重下降等疾病行为。
丹参是具有代表性的活血化瘀中药,STS为丹参的有效成分, 具有抗氧化、 清除氧自由基的作用,既往文献报道STS能抑制 NF-κB 活性[14],同时还具有抗炎、 清除自由基,增强抗氧化活性以及减轻钙超载及细胞凋亡的作用[15]。本实验脓毒症模型小鼠在给予STS治疗后,微循环血流速度明显增加,TNF-α和IL-1β的表达水平也明显降低,提示STS可能通过改善脓毒症小鼠的微循环障碍,以及抑制TNF-α、IL-1β等炎性介质表达而发挥脑保护作用。
综上所述,脓毒症小鼠软脑膜微血流速度减慢,炎症反应明显,STS可明显改善脑组织微循环障碍,并降低炎性介质水平,控制炎症反应,在脓毒症中有脑保护作用。STS脑保护作用的具体的机制和作用靶点仍有待于进一步深入研究阐明。
本文第一作者简介:
张友平(1989-),男,汉族,硕士研究生,住院医师,研究方向:脑血管病与脑损伤
1 Zampieri FG, Park M, Machado FS, et al. Sepsis-associated encephalopathy: not just delirium[J]. Clinics, 2011, 66(10): 1 825-1 831.
2 Zhu W,Lu Q,Chen HW,et al.Protective effect and mechanism of sodium tanshinone ⅡA sulfonate on microcirculatory disturbance of small intestine in rats with sepsis[J]. J Huazhong Univ Sci Technol Med Sci, 2011, 31(4): 441.
3 Zhu W, Lu Q, Wan L, et al. Sodium tanshinone II A sulfonate ameliorates microcirculatory disturbance of small intestine by attenuating the production of reactie oxygen species in rats with sepsis[J]. Chin J Integr Med, 2016, 22(10):745-751.
4 Zhu W, Lu Q, Chen HW, et al. Protective effect of sodium tanshinone IIA sulfonate on injury of small intestine in rats with sepsis and its mechanism[J]. Chin J Integr Med, 2012, 18(7):496-501.
5 赵红领,李 磊,苗 成,等. 丹参酮ⅡA对脑出血大鼠脑组织HIF-1α和VEGF表达的影响[J]. 中风与神经疾病杂志,2017,34(2): 130-132.
6 赵 岩. 丹参酮ⅡA对缺血性脑损伤大鼠的保护作用及机制初探[J].光明中医,2016, 31(10): 1 400-1 402.
7 Anderson ST, Commins S, Moynagh PN, et al. Lipopolysaccharide-induced sepsis induces long-lasting affective changes in the mouse[J]. Brain Behav Immu, 2015, 43(19):98-109.
8 许 敏, 李志超, 董明清,等. 丹参酮IIA磺酸钠对脂多糖致小鼠急性肺损伤的预防与治疗作用及其机制[J]. 中国药理学通报,2008,24(4): 477-481.
9 中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014) [J]. 中华内科杂志, 2015, 54(6): 557-581.
10 Schramm P, Klein KU, Falkenberg L, et al. Impaired cerebrovascular autoregulation in patients with severe sepsis and sepsis-associated delirium[J]. Crit Care, 2012, 16(5): R181.
11 Vachharajani V, Russell JM, Scott KL, et al. Obesity exacerbates sepsis-induced inflammation and microvascular dysfunction in mouse brain[J]. Microcirculation, 2005, 12(2): 183-194.
12 Taccone FS, Su F, Pierrakos C, et al. Cerebral microcirculation is impaired during sepsis: an experimental study[J]. Crit Care, 2010, 14(4): R140.
13 Kim GY, Roh SI, Park SK, et al. Alleviation of experimental septic shock in mice by acidic polysaccharide isolated from the medicinal mushroom[J]. Phellinus Linteus Biol Pharm Bull, 2003, 26(10): 1 418-1 423.
14 张 俐, 安国尧, 张文光,等. 丹参酮-ⅡA磺酸钠对脊髓缺血再灌注损伤NF-κB、VCAM-1和血液流变性的影响[J]. 中国骨伤, 2012, 28(12): 1 016-1 020.
15 陈华文, 冯 俊, 李树生. 丹参酮ⅡA对脓毒症大鼠心肌凋亡的保护作用[J].中国药学杂志,2013, 48(17):1 267-1 271.
Intervention Effect of Tanshinone II A on Leptomeningeal Microcirculation and Neuroinflammation in Mice with Sepsis
ZHANG You-ping1, ZAN Da-qian1,CHEN Hua-wen1,LV Qin2, ZHU Wei1,#
1Department of Emergency Medicine, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030,China;2Department of Pharmacology, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030,China;#Corresponding author
Objective: To explore the effect of tanshinone ⅡA on leptomeningeal microcirculation and neuroinflammation in mice with sepsis.Method: Septic mouse model was developed by intraperitoneal injection of lipopolysaccharide (LPS,5mg/kg). 32 mice were drandomly divided into 4 groups: the sham group, tanshinone ⅡA group, sepsis group(LPS) and tanshinone ⅡA +sepsis group(LPS+STS). Changes of leptomeningeal microcirculation were observed through an open cranial window and the blood velocity of pial arterioles and venules were monitored by BI-2000 medical image analysis system. ELISA method was used to detect the content of TNF-α and IL-1β in the hippocampus.Results: The blood velocity of leptomeningeall vessels in sepsis group were slower than that in the sham group, and the level of TNF-α and IL-1β in the hippocampus were higher than that in the sham group (P<0.01). Compared with sepsis group, the level of TNF-α and IL-1β in tanshinone ⅡA +sepsis group(LPS+STS) were significantly lower(P<0.01) and the blood velocity of leptomeningeall vessels were faster.Conclusion: Sodium tanshinone ⅡA can alleviate neuroinflammation and improve microcirculation, which might in turn bring the septic mouse cerebral protection.
Tanshinone Ⅱ A; Sepsis associated encephalopathy; Microcirculation; Inflammatory medium; Mice
湖北省自然科学基金(2015CFB284)
1华中科技大学同济医学院附属同济医院急诊科,武汉430030;2华中科技大学同济医学院基础医学院药理学系,武汉430030;#
,E-mail:zhuwei@tjh.tjmu.edu.cn
本文2017-02-16收到,2017-05-30修回
R331.3+5R651.1+5
A
1005-1740(2017)03-0001-04