左旋甲状腺素抑制治疗对分化型甲状腺癌女性患者骨密度的影响分析
周 毅 林启谋 黄文俊 李 勇 袁 琳
左旋甲状腺素抑制治疗对分化型甲状腺癌女性患者骨密度的影响分析
周 毅 林启谋 黄文俊 李 勇 袁 琳
目的观察分析左旋甲状腺素抑制治疗对分化型甲状腺癌女性患者术后的骨密度的影响。方法选择2010年至2014年江门市中心医院普通外科一区接受甲状腺双侧腺叶全切或近全切手术,并于术后接受左旋甲状腺素抑制治疗的DTC成年女性患者共46例,按照年龄、体重指数(BMI)、绝经状态、初始TSH目标及随访年限内平均TSH水平分组比较术前、术后1年及术后3年的腰椎(L1~L4)及股骨近端骨密度(T值)。结果重复测量方差分析结果显示年龄(P<0.001)、绝经状态(P<0.001)以及初始TSH目标分组(P<0.05)的患者T值在组间的差异明显,均具有统计学意义。其中,多因素分析提示初始TSH目标分组(P<0.001)以及平均TSH水平分组(P<0.001)与时间因素存在交互作用,说明时间因素的作用随TSH的变化而变化。结论绝经后的高龄女性分化型甲状腺癌患者在长期L-T4抑制治疗过程中,无论其初始TSH目标以及平均TSH水平高低,均应接受抗骨质疏松的初级预防;对于初始TSH抑制目标较低(TSH≤0.1m IU/L)的女性患者,无论其年龄大小及绝经状况,同样应接受抗骨质疏松的初级预防治疗。
分化型甲状腺癌;左旋甲状腺素;TSH抑制;女性患者;骨密度
分化型甲状腺癌(differentiated thyroid cancer,DTC)是最常见的恶性肿瘤之一。术后根据动态的危险分层给予超过生理剂量的左旋甲状腺素(L⁃T4)抑制治疗已成为目前DTC的长期随访中的常规治疗决策,以减少患者的远期复发风险[1]。但是,长期服用L⁃T4对体内的促甲状腺素(thyroid stimulating hormone,TSH)进行抑制会导致患者处于亚临床甲状腺亢进状态,从而引起心血管系统及骨质代谢等一系列改变[2]。尽管近年来国外有许多关于L⁃T4抑制TSH是否会影响患者骨密度(bonemineral density,BMD)的研究,其结论尚存在争议[3-6]。本研究通过分析本地区内处于长期L⁃T4抑制治疗的DTC女性患者的BMD改变,为合理的个体化术后管理策略提供临床资料。
1 资料与方法
1.1 研究对象
选择2010年至2014年江门市中心医院普通外科一区接受甲状腺双侧腺叶全切或近全切手术,并于术后接受左旋甲状腺素抑制治疗的DTC成年女性患者。特别强调,近年来关于DTC的诊治指南一直在更新,尤其是对于DTC术后的危险程度分层以及TSH的初始抑制目标,我们在治疗过程中的主要参考依据是2009年美国甲状腺协会(American Thyroid Association,ATA)发表的《甲状腺结节和分化型甲状腺癌诊治指南》,以及我国2012年发表的《甲状腺结节和分化型甲状腺癌诊治指南》[1,7]。
纳入标准:①女性,年龄18~70岁;②依从性良好,定期按时服用左旋甲状腺素,并在初始期治疗(第一年)内达到初始TSH目标;③自愿接受TSH及骨密度检测。
排除标准:①随访期间发现原位复发或远处转移病灶;②行甲状腺切除手术后继发甲状旁腺功能减退,血清钙、磷代谢受影响;③接受左旋甲状腺素抑制治疗过程中出现明显甲状腺功能亢进症状而被迫停药者;④长期服用影响骨代谢的药物,如雌激素类药物、双磷酸盐及糖皮质激素等;⑤心、肺、肝等重要脏器功能不全者。
1.2 TSH及BMD检测
TSH检测采用电化学发光免疫分析法,被检人员空腹8 h后于清晨采取静脉血,在罗氏Modular⁃DDP全自动生化分析仪上进行检测,其试剂和校准品均为原装配套。本实验室TSH正常参考范围为:0.34~5.60m IU/L。
BMD检测采用双能X线吸收测定法(DEXA)测量腰椎(L1~L4)及股骨近端BMD,仪器为美国Lunar公司生产的DPX⁃L型骨密度仪。与同性别、骨峰值年龄健康人相比计算T值。
1.3 统计学处理
所有数据均采用SPSS 23.0软件包进行分析。手术前后各时间点指标比较采用重复测量方差分析。P<0.05为有统计学意义。
2 结果
2.1 患者一般临床特征
符合入组条件的患者共46例,按照年龄、体质量指数(bodymass index,BMI)、绝经状态、初始TSH目标及随访年限内平均TSH水平分组(表1)。所有患者的初始TSH目标及随访年限内平均TSH水平在年龄、BMI及绝经状态分组上的分布差异没有统计学意义(Chi⁃square test,P>0.05)。
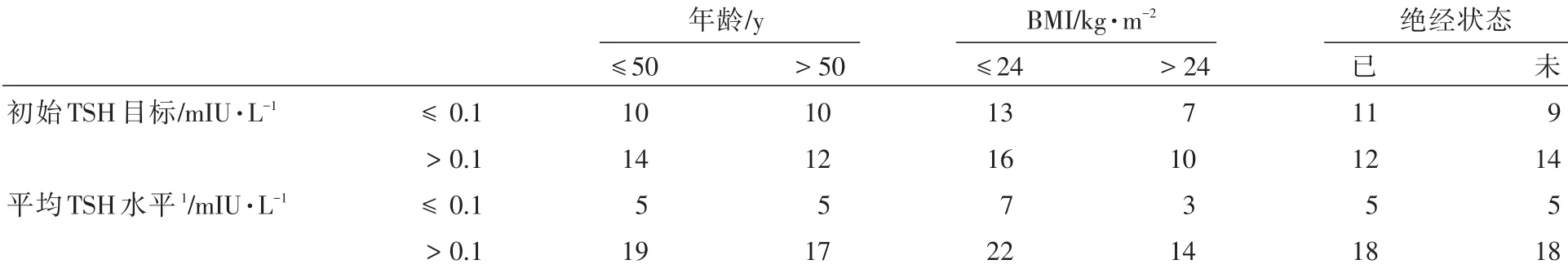
表1 患者一般临床特征
2.2 不同时间点各分组BMD比较
所有入组患者均于术前、术后1年、术后3年行腰椎(L1~L4)及股骨近端BMD测定,并计算T值(表2)。
根据患者年龄、BMI、绝经状态、初始TSH目标及随访年限内平均TSH水平分组,对患者各时间点BMD行重复测量方差分析(表3)。结果显示,年龄(FL=55.799,P<0.001;FF=19.828,P<0.001)、绝经状态(FL=93.961,P<0.001;FF=33.616,P<0.001)以及初始TSH目标分组(FL=4.271,P=0.045;FF=4.354,P=0.043)的患者T值在组间的差异明显,均具有统计学意义。其中,多因素分析提示初始TSH目标分组(FL=49.404,P<0.001;FF=15.992,P<0.001)以及平均TSH水平分组(FL=6.660,P=0.013;FF=7.394,P=0.009)与时间因素存在交互作用,说明时间因素的作用随TSH的变化而变化。

表2 术前、术后不同时间点BMD比较(T⁃score)
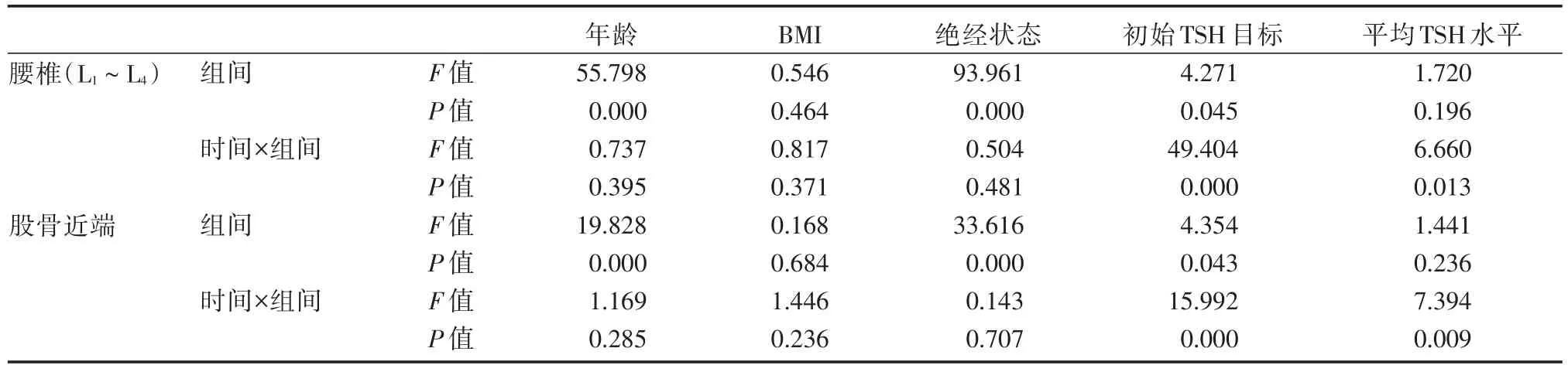
表3 重复测量方差分析的统计参数
3 讨论
分化型甲状腺癌(包括甲状腺乳头状癌和滤泡状癌)是最常见的甲状腺恶性肿瘤,甲状腺切除、131I治疗和长期TSH抑制治疗是DTC的传统治疗方法[1,7]。通过给予患者超过生理需要量的L⁃T4以抑制垂体分泌TSH,继而减少TSH依赖性肿瘤的复发和转移,降低癌症相关死亡。但关于TSH抑制治疗及其抑制程度,各国临床指南尚未达成共识,同时,其潜在的治疗风险也不能忽视[8]。既往的研究表明,甲状腺功能亢进是骨量减少、骨质疏松以及病理性骨折的独立危险因素[9,10],但由于服用左旋甲状腺素抑制TSH而引起的亚临床甲亢状态是否会导致骨质改变尚无明确定论[3-6,11,12]。Abe等的研究指出,TSH受体同时表达于成骨细胞及破骨细胞上,直接调控骨吸收和骨形成,影响骨重建过程[13];而部分女性患者,尤其在绝经后,其骨质水平随雌激素下调而逐年减退,如何针对DTC术后的女性患者制定合适的个体化长期L⁃T4抑制治疗方案值得探讨。
本研究发现,不同年龄及绝经状态分组的女性患者,其BMD在术前即有明显差异(P<0.001);绝经后的高龄女性患者,在长期L⁃T4抑制治疗过程中,无论其初始TSH目标以及平均TSH水平高低,其骨量丢失情况远比绝经前的低龄患者明显,分析比较各个随访时间点上的T值均具有明显的组间差异(P<0.001)。提示该部分患者在接受长期L⁃T4抑制治疗过程中,均应接受抗骨质疏松的初级预防,包括保证钙离子摄入,补充维生素D,以及每年复查BMD,警惕骨质疏松症的发生[8]。同时,本研究结果显示,对于初始TSH抑制目标较低(TSH≤0.1 m IU/L)的患者,无论其BMD基线如何,各随访时间点上T值的差异同样具有统计学意义(P<0.05),且TSH水平与时间存在交互作用,推测接受越长时间的TSH抑制治疗,其骨量下降情况越明显。因此,针对初始TSH抑制目标≤0.1 m IU/L的女性患者,无论其年龄大小及绝经状况,同样应接受抗骨质疏松的初级预防治疗。
本研究随访年限较短,且入组病例较少,研究结果存在一定的局限性。同时缺乏空白对照组及干预组,即设立与健康同龄女性的BMD配对比较,以及针对绝经后高龄女性和初始TSH目标≤0.1m IU/L的患者增加钙质及维生素D摄入后的干预治疗能否改善骨量减少的情况等,研究结论尚有待进一步完善。
[1]Cooper DS,Doherty GM,Haugen BR,et al.Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167-1214.
[2]Flynn RW,Bonellie SR,Jung RT,et al.Serum thyroid⁃stimulating hormone concentration and morbidity from cardiovascular disease and fractures in patients on long⁃term thyroxine therapy[J].JClin Endocrinol Metab,2010,95(1):186-193.
[3]Lee MY,Park JH,Bae KS,et al.Bone mineral density and bone turnover markers in patients on long⁃term suppressive levothyroxine therapy for differentiated thyroid cancer[J].Ann Surg TreatRes,2014,86(2):55-60.
[4]Heijckmann AC,Huijberts MS,Geusens P,et al.Hip bone mineral density,bone turnover and risk of fracture in patients on long⁃term suppressive L⁃thyroxine therapy for differentiated thyroid carcinoma[J].Eur JEndocrinol,2005,153(1):23-29.
[5]de Melo TG,Da AL,Santos AO,et al.Low BMIand low TSH value as risk factors related to lower bone mineral density in postmenospausal women under levothyroxine therapy for differentiated thyroid carcinoma[J].Thyroid Res,2015,8:7.
[6]Rosen HN,Moses AC,Garber J,et al.Randomized trial of pamidronate in patientswith thyroid cancer:bone density is not reduced by suppressive doses of thyroxine,but is increased by cyclic intravenous pamidronate[J].J Clin Endocrinol Metab,1998,83(7):2324-2330.
[7]中华医学会内分泌学分会.甲状腺结节和分化型甲状腺癌诊治指南[J].中国肿瘤临床,2012,33(17):651-652.
[8]Biondi B,Cooper DS.Benefits of thyrotropin suppression versus the risks of adverse effects in differentiated thyroid cancer[J]. Thyroid,2010,20(2):135-146.
[9]Bassett JH,Williams GR.Critical role of the hypothalamic⁃pituitary⁃thyroid axis in bone[J].Bone,2008,43(3):418-426.
[10]Lee MS,Kim SY,Lee MC,et al.Negative correlation between the change in bone mineral density and serum osteocalcin in patients with hyperthyroidism[J].J Clin Endocrinol Metab,1990,70(3):766-770.
[11]Bertoli A,Fusco A,Andreoli A,et al.Effect of subclinical hypothyroidism and obesity on whole⁃body and regional bone mineral conten[tJ].Horm Res,2002,57(3-4):79-84.
[12]梁利波,王佑娟,张玫,等.亚临床甲状腺功能减退症与骨密度及骨代谢指标的相关性研究[J].四川大学学报医学版,2014,45(1):66-69.
[13]Abe E,Marians RC,YuW,etal.TSH isa negative regulator of skeletal remodeling[J].Cell,2003,115(2):151-162.
The influence of suppressive levothyroxine therapy on bone m ineral density in women w ith acute intestinal obstruction
ZHOU Yi,LIN Qimou,HUANGWenjun,LI Yong,YUAN Lin.
Department of General Surgery(Thyroid and Breast surgery),Jiangmen Central Hospital,Jiangmen 529000,China.
Objective To investigate the influence of suppressive levothyroxine therapy on bone mineral density(BMD)in women with differentiated thyroid carcinoma after thyroidectomy. M ethods A total of 46 female patients with differentiated thyroid carcinoma who underwent total or near total thyroidectomy in Jiangmen Central Hospital from 2010 to 2014,were enrolled in this study. Pre⁃and post⁃operative BMD(T⁃score)of lumbar(L1⁃L4)and femur were detected and compared in each groups include age,BMI,menopausal status,initial target TSH level and average TSH level. Results Repeated measurement ANOVA showed that T⁃score of lumbar(L1⁃L4)and femur after suppressive levothyroxine therapy had significantly differences(P<0.05)in each group included group age,menopausal status and initial target TSH level.There was interaction between time effect and group effect in group initial target TSH level and group average TSH level.Conclusion Elder postmenopausal female patientswith DTCwho underwent long⁃term suppressive levothyroxine therapy,should be accepted primary prevention againstosteoporosis nomatterwhat TSH level theymaintain.And also female patients who have lower initial target TSH level(≤0.01 m IU/L),should keep on primary prevention against osteoporosis.
differentiated thyroid carcinoma;levothyroxine;TSH suppressive;female patients;bonemineral density
R736.1
A
10.3969/j.issn.1009⁃976X.2017.04.013
2017-04-15)
529000广东江门江门市中心医院普通外科一区(甲状腺乳腺专科)
周毅,Email:ptwkyq@163.com

