血清抵抗素与胃癌恶病质的关系
赵理想 陈思曾 王结实 闫保功 郑方阁
血清抵抗素与胃癌恶病质的关系
赵理想1陈思曾2王结实1闫保功1郑方阁1
目的观察血清抵抗素与胃癌及胃癌恶病质的关系,并初步探讨胃癌恶病质中抵抗素与白介素⁃6相关性。方法选取胃癌并恶病质患者23例为胃癌恶病质组,胃癌患者23例为胃癌组、健康成人23例为对照组。记录患者性别、年龄、BMI及肿瘤分期。采用ELISA法测定血清抵抗素和白介素⁃6水平(IL⁃6)。结果Ⅲ、Ⅳ期胃癌较Ⅰ、Ⅱ期胃癌更易发生恶病质(P<0.05),与健康成人相比血清抵抗素、白介素⁃6在胃癌及胃癌恶病质中升高(P<0.05)。血清抵抗素水平随着胃癌病理分期的增加有逐渐升高趋势(P<0.05)。胃癌恶病质组血清白介素⁃6水平与血清抵抗素水平显著正相关(r=0.512,P=0.012)。结论血清抵抗素水平随着胃癌病理分期的增加逐渐升高,胃癌恶病质患者血清抵抗素的升高与白介素⁃6呈正相关关系。
抵抗素;胃癌;恶病质;白介素⁃6
癌症恶病质(cancer cachexia,CC)临床常见,其主要表现为厌食、乏力、消瘦、糖代谢紊乱、脂肪分解、肌肉萎缩、低蛋白血症,癌症恶病质病人对放化疗等抗肿瘤治疗耐受性差,容易发生感染,生活质量下降,胃癌病人较易发生恶病质[1]。癌症恶病质的发生原因尚不完全明确,炎性细胞因子如IL⁃6、TNF⁃α等在其发生、发展中的作用逐渐被认识[2]。抵抗素是脂肪细胞分泌小分子蛋白,作为一个炎症调节因子和肥胖相关疾病的潜在介导者,与胰岛素抵抗、动脉硬化、恶性肿瘤等疾病的发生有着重要的关系[3,4]。抵抗素与肿瘤恶病质的关系鲜有报道,本文旨在探讨抵抗素与胃癌恶病质的关系。
1 资料与方法
1.1 一般资料
2012年3月~2014年9月就诊于我院普外科的胃癌恶病质患者(胃癌恶病质组)23例,恶病质的诊断标准为半年内出现渐进性消瘦,体质量下降>5%或BMI<20 kg/m2并伴有体质量下降>2%者。排除标准为:①入院前6个月进行过放化疗、手术治疗等其他特殊治疗;②严重心肝脑肺部等疾病及其他肿瘤所导致的恶病质;③急慢性感染;④严重的胃肠道良性疾病;④神经性厌食。恶病质组中男11例,女12例;年龄18~89岁,平均年龄60.3±18.2岁。同时选取同期在我院就诊的胃癌非恶病质患者(胃癌组)23例,其中男10例,女13例;年龄39~89岁,平均年龄62.3±11.7岁。依照国际抗癌联盟(UICC)制订的指南对肿瘤病人进行分期。另选取健康体检者23例作为对照组,其中男10例,女13例;年龄25~86岁,平均年龄57.8±17.3岁。(见表1)
1.2 血标本采集
抽取晨空腹静脉血5 mL,离心、分离血清,⁃70℃低温保存待用。指标检测:血清IL⁃6(interleukin⁃6,IL⁃6)、抵抗素采用酶联免疫吸附法(ELISA)检测,试剂盒均购自R&D Systems,Inc. USA,操作严格按照试剂盒说明书进行。
1.3 统计方法
数据使用SPSS 19.0统计软件包处理。定量资料用x±s表示,组间比较采用方差分析(one⁃way ANOVA),方差齐时选用LSD(least⁃Significant Difference),方差不齐是选用Dunnett′s法,计数资料比较采用χ2检验。相关性分析采用spearman相关检验。以P<0.05为差异有统计学意义。
2 结果
3组患者在年龄、性别构成比及BMI方面无差异。肿瘤的分期与恶病质的发生关系密切,分期越差恶病质发生机会增加,差异有统计学意义(P<0.05),见表1。血清IL⁃6在胃癌各分期中无明显异常,抵抗素随着胃癌病理分期的增加有逐渐升高趋势,且差异有统计学意义(P<0.05),见表2。与C组相比,A组及B组血清IL⁃6及抵抗素均升高且具有统计学意义(P<0.05)。与B组相比,A组血清IL⁃6及抵抗素均升高且具有统计学意义(P<0.05),见表3。胃癌恶病质组血清IL⁃6水平与血清抵抗素水平显著正相关(r=0.512,P=0.012)。
表1 胃癌恶病质患者、胃癌患者及健康人一般情况(n±s)
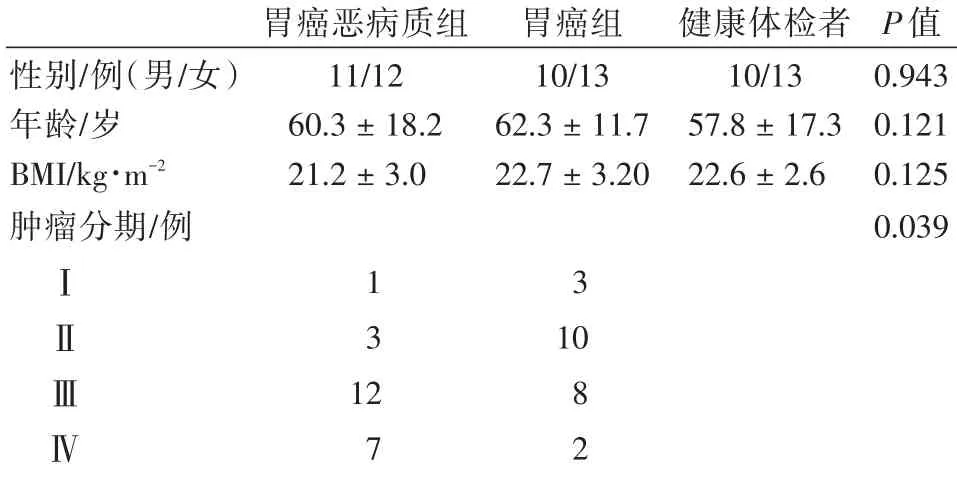
表1 胃癌恶病质患者、胃癌患者及健康人一般情况(n±s)
胃癌恶病质组胃癌组健康体检者P值性别/例(男/女)11/1210/1310/130.943年龄/岁60.3±18.262.3±11.757.8±17.30.121 BMI/kg∙m-2 21.2±3.022.7±3.2022.6±2.60.125肿瘤分期/例0.039Ⅰ1 3Ⅱ3 10Ⅲ128Ⅳ7 2

表2 不同病理分期胃癌患者中血清抵抗素、白介素⁃6水平比较

表3 胃癌恶病质患者、胃癌患者及健康人血清抵抗素、白介素⁃6水平比较
3 讨论
癌症恶病质是一组以脂肪、肌肉组织丢失、进行性营养状况恶化为特征,主要表现为进行性消瘦、乏力、厌食等表现。50%~80%的恶性肿瘤患者死亡前会出现恶病质。30%的恶性肿瘤患者死于恶病质,而不是肿瘤本身[5]。癌症恶病质发生、发展机制目前尚不完全明确,但作为机体肿瘤与免疫系统相互作用而引发的炎性细胞因子如IL⁃6等在癌症恶病质发生、发展中的作用逐渐被认识。以前研究多集中在肌肉消耗方面,而有研究表明脂肪的丢失要快于且早于肌肉的丢失[6]。
抵抗素主要由白色脂肪组织分泌,于2001年被STEPPAN等[7]首次报道,因其具有胰岛素抵抗作用而命名,而其在外周血中单核细胞和巨噬细胞也能产生。抵抗素在体内有广泛的生物学作用,在能量平衡、葡萄糖和脂质代谢等方面发挥着重要作用。目前研究发现抵抗素与结直肠癌[8]、乳腺癌[9]、胰腺癌[10]等多种恶性肿瘤关系密切。而抵抗素与胃癌及恶病质的关系尚不明确。
本研究中显示胃癌病人血清抵抗素水平较健康人升高且有统计学意义,随着胃癌病理分期的增加血清抵抗素逐渐增加,而IL⁃6同样随着病理分期的增加也有升高,但没有达到统计学意义。提示血清抵抗素浓度与胃癌临床分期有关,或可能成为胃癌临床分期的标志物。胃癌远处转移在临床分期中已属Ⅳ期,而胃癌远处转移与胃癌恶病质的关系密切,有研究发现在胃癌中基质细胞衍生因子⁃1可刺激血管生成及肿瘤细胞远处转移,而抵抗素可通过Toll样受体4、p38 MAPK和NF⁃κB信号转导途径诱导其表达[11],抵抗素或许在胃癌远处转移方面发挥着一定的作用。
本研究发现在胃癌恶病质病人中血清抵抗素、IL⁃6水平较胃癌非恶病质组升高且差异有统计学意义,说明抵抗素、IL⁃6可能参与胃癌恶病质发生、发展;在相关分析中发现抵抗素与IL⁃6存在正相关关系,而抵抗素、IL⁃6如何在胃癌恶病质中发挥相互作用目前尚不清楚,国内外少有报道,KASER等[12]研究发现在妊娠期高血压疾病患者胎盘中过高表达的抵抗素可通过激活NF⁃κB促进IL⁃6等炎症介质的表达,此外IL⁃6亦可促进人抵抗素表达,形成炎症级联放大反应。结合其他研究我们推测在胃癌恶病质中抵抗素参与系统炎症反应调控,在白色脂肪组织中刺激炎症细胞因子IL⁃6的产生[13]。其机制或许是在抵抗素刺激下NF⁃κB被活化,被活化的NF⁃κB诱导炎症相关因子释放[14],而IL⁃6的释放又能促进抵抗素的产生,两者协同发挥作用,但这需要进一步的研究。
总之,胃癌恶病质患者血清抵抗素明显升高,并与炎性介质IL⁃6升高呈正相关,说明血清抵抗素可能参与胃癌恶病质的发生、发展。进一步更深入的研究以便了解血清抵抗素的机制是必要的,同时,针对抵抗素的干预性措施可能为掌握胃癌恶病质的研究方向或治疗提供基础。
[1]Graul AI,Stringer M,Sorbera L.Cachexia[J].Drugs Today(Barc),2016,52(9):519-529.
[2]Laine A,Iyengar P,Pandita TK.The role of inflammatory pathways in cancer⁃associated cachexia and radiation resistance[J].MolCancerRes,2013,11(9):967-972.
[3]FantuzziG.Adipose tissue,adipokines,and inflammation[J].J Allergy Clin Immunol,2005,115(5):911-919.
[4]Codoñer⁃Franch P,Alonso⁃Iglesias E.Resistin:insulin resistance tomalignancy[J].Clin Chim Acta,2015,438:46-54.
[5]Fearon K,Strasser F,Anker SD,et al.Definition and classification of caner cahcexia:an international consensus[J]. LancetOncol,2011,12(5):489-495.
[6]Arner P.Medicine.Lipases in cachexia[J].Science,2011,333(6039):163-164.
[7]Steppan CM,Bailey ST,Bhat S,et al.The hormone resistin linksobesity to diabete[J].Nature,2001,409(6818):307-312.
[8]Yang G,Fan W,Luo B,et al.Circulating resistin levels and risk of colorectal cancer:ameta-analysis[J].Biomed Res Int,2016,2016:7367485
[9]Georgiou GP,Provatopoulou X,Kalogera E,et al.Serum resistin is inversely related to breast cancer risk in premenopausalwomen[J].Breast,2016,29:163-169.
[10]Gᶏsiorowska A,Talar⁃wojnarowska R,Kaczka A,etal.Role of adipocytokines and its correlation with endocrine pancreatic function in patients with pancreatic cancer[J].Pancreatology,2013,13(4):409-414.
[11]Hsieh YY,Shen CH,Huang WS,et al.Resistin⁃induced stromal cell⁃derived factor⁃1 expression through Toll⁃like receptor 4 and activation of p38 MAPK/NFκB signaling pathway in gastric cancer cells[J].JBiomed Sci,2014,21(1):1-10.
[12]Kaser S,Kaser A,Sandhofer A,etal.Resist inmessenger⁃RNA expression is increased by proinflammatory cytokines in vitro[J].Biochem BiophysResCommun,2003,309(2):286-290.
[13]Batista ML Jr,Olivan M,Alcantara PS,et al.Adipose tissue⁃derived factors as potential biomarkers in cachectic cancer patients[J].Cytokine,2013,61(2):532-539.
[14]Jiang CY,Wang W.Resistin aggravates the expression of proinflammatory cytokines in ceruleinstimulated AR42J pancreatic acinar cells[J].Mol Med Rep,2017,15(1):502-506.
Relationship between serum resistin and gastric cancer⁃associated cachexia
ZHAO Lixiang1,CHEN Sizeng2,WANG Jieshi1,YAN Baogong1,ZHENG Fangge1.
1Department of General Surgery,Pingdingshan People'sHospital,Pingdingshan,He'nan 467000,China;2DepartmentofGeneral Surgery,The FirstAffiliated HospitalofFujian MedicalUniversity,Fuzhou,Fujian 350005,China.
Objective To observe the changes of serum resistin level in patients with gastric cancer associated⁃cachexia and to investigate the relationship between resistin and interleukin⁃6(IL⁃6). M ethods Twenty⁃three cases of gastric cancer patients with cachexia were assigned to the cachexia group;23 cases of gastric cancer patientswithout cachexia were used as the gastric cancer group;and 23 healthy peoplewere taken asnormal controls.All the subjectswere tested the sex,age,BMIand pathologic stagesof cancer.The serum levelsof IL⁃6,resistinwere detected by enzyme⁃linked immunoabsorbentassay(ELISA).Results Patientswith pathologic stagesⅢandⅣweremore susceptible to cachexia than those with pathologic stagesⅠandⅡin gastric cancer(P<0.05).Compared with control group,the serum resistin level and IL⁃6 were significantly increased in the cathexia group and gastric cancer group(P<0.05).Alongwith pathologicalstage increasing,the serum resistin levelweresignificantly increased.Serum resistin levelwas positive correlated with IL⁃6 in the cachexia group(r=0.512,P=0.012).Conclusion Along with pathological stage increasing in gastric cancer,the serum levels of resistin and IL⁃6 were significantly increased.Serum resistin and IL⁃6 were increased in the cathexia patients.And serum resistin waspositively correlatedwith interleukin⁃6 in gastric cancer cachexia.
resistin;gastric cancer;cachexia;IL⁃6
R735.2
A
10.3969/j.issn.1009⁃976X.2017.04.006
2017-03-15)
1467000河南平顶山平顶山市第一人民医院普外三科;2350005福建福州福建医科大学附属第一医院胃肠外科
赵理想,Email:360701810@qq.com

