小鼠感染旋毛虫后部分组织器官中NOD1、RIP2、NF-κB mRNA表达的监测
胡 静 , 韩彩霞 , 赵 祥 , 孟 诗 , 张 妍 , 李 莹 , 李 成 , 李晓云 , 宋铭忻
(东北农业大学动物医学学院 , 黑龙江哈尔滨150030)
小鼠感染旋毛虫后部分组织器官中NOD1、RIP2、NF-κB mRNA表达的监测
胡 静 , 韩彩霞 , 赵 祥 , 孟 诗 , 张 妍 , 李 莹 , 李 成 , 李晓云 , 宋铭忻
(东北农业大学动物医学学院 , 黑龙江哈尔滨150030)
应用荧光定量PCR方法,对感染旋毛虫小鼠的小肠、肺脏、心脏和肌肉中NOD1受体及其信号传导通路中接头分子RIP2和下游分子NF-κB mRNA表达水平进行监测。结果在小肠和心脏中,旋毛虫感染不同时期各目的基因表达量都有升高,分别于感染后4 d和14 d达到峰值,与对照组比均有极显著差异(P<0.01)。在肺脏中,NOD1 mRNA表达量仅在感染后7 d略升高,而RIP2的mRNA表达量在不同感染期均升高,于感染后4 d达到峰值,与对照组比有极显著差异(P<0.01)。在肌肉中,各目的基因在感染初期表达量变化不明显,而于感染后21 d mRNA表达量明显升高,28 d达到高峰,与对照组比有极显著差异(P<0.01)。表明旋毛虫感染对小鼠的小肠、心脏、肺脏和肌肉中NOD1、RIP2和NF-κB的表达水平均有不同程度的影响,这与旋毛虫在宿主体内移行途径和不同寄生阶段及其产生的各类抗原密切相关。
旋毛虫 ; NOD1受体 ; 组织 ; 荧光定量PCR
旋毛虫病是由旋毛虫引起的一种重要的食源性人兽共患线虫病。旋毛虫可通过产生的各类抗原与宿主免疫系统相互作用,从而危害宿主健康。天然免疫系统是机体抵抗病原体的第一道防线。NOD1受体是一种重要的天然免疫受体,广泛存在于多种细胞和组织中[1-2]。一般认为NOD1受体被病原体激活后可引起自身寡聚化,并通过N末端的CARD-CARD结构域相互作用激活下游的受体相互作用蛋白2(Receptor interacting protein2,RIP2),RIP2能够激活Caspase-1、MAPKs、NF-κB等信号通路,诱导炎性因子TNF-α、IL-1β和趋化因子IL-18等分泌,引起一系列免疫应答反应[3-4]。已有研究显示,NOD1受体参与了许多病毒、细菌、真菌、寄生虫的免疫应答[5-6]。而NLRs在旋毛虫感染中的研究未见报道。
因此,为了研究旋毛虫感染对小鼠NOD1-RIP2-NF-κB信号传导通路的影响,本试验应用荧光定量PCR方法对旋毛虫感染不同时期小鼠的小肠、心脏、肺脏、肌肉中NOD1、RIP2和NF-κB mRNA的表达量进行相对定量分析,从而进一步探讨旋毛虫感染与宿主免疫系统之间的相互作用机制。
1 材料与方法
1.1 实验动物及虫种 黑龙江猪旋毛虫虫株由本实验室传代保存,2月龄昆明系小鼠,购自中国农业科学院哈尔滨兽医研究所。
1.2 主要试剂和器材 rTag聚合酶、EcorI、HindIII、pMD18-T载体、DH5α感受态细胞、TRIZol、MLV和RRI,均购自宝生物工程(大连)有限公司;提质粒、胶回收试剂盒为北京全式金生物技术有限公司产品;Forma Scientific型超净台为上海博逊实业有限公司产品;7500荧光定量PCR仪为ABI公司产品;PCR仪为德国Eppendorf公司产品。
1.3 感染旋毛虫小鼠小肠、心脏、肺脏、肌肉组织分离及样品处理 将旋毛虫肌幼虫经口感染小鼠,剂量为500蚴/只,对照组小鼠口服生理盐水。旋毛虫于感染后0.5、4、7、14、21、28 d和35 d分别从对照组和试验组中随机取5只小鼠,脱颈处死后,在超净工作台中取其小肠、心脏、肺脏和肌肉,用DEPC配置的生理盐水冲洗干净,剪成约0.1 g小样,滤纸吸干后,置冻存管中,于液氮中速冻后,用TRIZol法提取总RNA并反转录合成cDNA,置-80 ℃保存备用[7]。
1.4 荧光定量PCR方法的建立
1.4.1 标准品引物的设计 根据GenBank上登陆的小鼠NOD1 mRNA参考序列(登录号:NM_001171007.1)、RIP2 mRNA参考序列(登录号:NM_138952.3)、NF-κB mRNA参考序列(登录号:NM_008689.2)和GAPDH mRNA参考序列(登录号:NM_008084.3),运用Primer Premier 5.0软件设计引物,应用Oligo 7.0软件分析引物特异性。NOD1基因上游引物:5′-CCTTGCTTTAGCCGTCTCAC-3′,下游引物:5′-CCCGCCCTCACTTGTTATT-3′;RIP2基因上游引物:5′-GCTGGGATGGTATCGTTT-3′,下游引物5′-GTCCTTGTAGGTTTGGTGC-3′;NF-κB基因荧光定量上游引物:5′-TGGAGGCATGTTCGGTAGTGG-3′,下游引物:5′-GGCGATGGGTTCCGTCTTG-3′;GAPDH基因上游引物:5′-CCAGCCTCGTCCCGTAGACA-3′,下游引物:5′-ATACTCAGCACCGGCCTCACCC-3′;。预期扩增片段分别为231 bp、274 bp、298 bp和289 bp。上述引物由上海英骏生物技术有限公司合成。
1.4.2 标准品质粒的构建 以小鼠cDNA为模板用PCR方法扩增1.4.1中各目的基因片段,PCR产物用琼脂糖凝胶电泳检测,将验证正确的PCR产物回收纯化,连接在pMD18-T载体上,转入DH5α感受态细胞中,于37 ℃温箱培养12 h后,将PCR和双酶切鉴定正确的克隆菌液送上海英骏生物技术有限公司进行双向测序,并利用生物学软件进行序列比对。阳性菌液使用全式金柱式质粒小量抽提试剂盒提取质粒,用分光光度计测定质粒的浓度,于-20 ℃保存备用。
1.4.3 标准曲线的建立 将标准品质粒10倍稀释5个浓度。反应条件为: 95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,反应40个循环。反应体系为20 μL,SYBRRPremixExTaqII(Tli RnaseH Plus)10 μL,上下游引物各0.5 μL,ROX Reference Dye II 0.4 μL,稀释后的模板0.5 μL,ddH2O 8.1 μL。并以起始模板质粒标准品浓度(lg)为X轴,获得的Ct值为Y轴制作标准曲线,通过熔解曲线情况分析引物特异性,并计算扩增效率。
1.5 待测样品NOD1、RIP2和NF-κB mRNA表达水平的测定 将各组样品反转录合成的cDNA作为模板,对各组样品中的相关基因mRNA表达水平进行测定,得到待测样品的Ct值。△△Ct法计算目的基因的表达水平。
1.6 数据分析 应用EXCEL、ABI7500Fast、SPSS 21.0和GraphPad Prism 5对试验数据进行统计分析。
2 结果
2.1 荧光定量PCR检测NOD1、RIP2、NF-κB和GAPDH mRNA表达水平方法建立
2.1.1 目的基因片段的扩增和重组质粒的鉴定 经RT-PCR扩增NOD1、RIP2、NF-κB和GAPDH目的基因片段,琼脂糖凝胶电泳检测各目的条带与预期大小相符。目的片段经克隆后,菌液送去测序,结果用DNAMAN序列比对分析,大小分别为231 bp、274 bp、298 bp和289 bp,与目的基因大小相符。将各目的基因片段测序正确的菌液进行质粒提取,PCR扩增,紫外分光光度计检测质粒的浓度。
2.1.2 NOD1、RIP2、NF-κB和GAPDH荧光定量PCR检测方法的建立 分别以目的基因重组质粒的标准品进行实时荧光定量PCR反应。结果表明,NOD1、RIP2、NF-κB和GAPDH熔解曲线峰值单一,说明引物特异性良好。应用ABI7500Fast荧光定量PCR仪进行数据分析,根据其模板数与Ct值之间存在的线性关系(y代表Ct值;x代表起始模板数),得到标准曲线,直线回归方程分别如下:y=-3.360x+14.639(R2=1),y=-3.375x+14.720(R2=1),y=-3.329x+13.622(R2=1)和y=-3.269x+11.890(R2=0.999)。研究结果显示,各目的基因相关系数都在0.99~1之间,扩增效率均在0.8~1.2之间,可以用△△Ct进行相对定量分析,见图 1~4。
图1 NOD1基因的标准曲线

图2 RIP2基因的标准曲线

图3 NF-κB基因的标准曲线

图4 GAPDH基因的标准曲线
2.2 旋毛虫感染小鼠不同时期的小肠、心脏、肺脏和肌肉中NOD1、RIP2和NF-κB mRNA表达量测定 研究结果表明,旋毛虫感染小鼠不同时期的小肠、心脏、肺脏和肌肉中,NOD1、RIP2和N-F-κB mRNA相对表达量与对照组相比,总体均呈现先升高后下降的趋势。小肠中NOD1、RIP2和NF-κB mRNA的表达量,都于感染后0.5 d升高,4 d达到峰值,分别约为对照组1.7倍、2.4倍和3.1倍,其后呈下降趋势。心脏中NOD1、RIP2和NF-κB mRNA的表达量,于感染后0.5 d开始逐渐升高,都于14 d达到最高,分别约为对照组的2.3倍、3.8倍和2.0倍,其后呈下降状态。肺脏中NOD1和RIP2 mRNA相对表达量,于感染后0.5 d逐渐升高,分别于7 d和4 d达最大值,约为对照组1.7倍和2.0倍;而NF-κB mRNA相对表达量于感染后0.5 d为最高值,约为对照组1.5倍,其后各目的基因相对表达量呈下降态势。肌肉中NOD1、RIP2和NF-κB mRNA的表达量,都于感染后0.5 d逐渐上升,21 d开始显著升高,28 d达最高峰,分别约为对照组的3.8倍、10倍和7.2倍,而后开始显著降低。见图5~8。
3 讨论
旋毛虫经口感染后,3~5 d在肠上皮细胞内发育成可交配的雌雄成虫,感染后5~7 d,雌虫开始产出新生幼虫,而后新生幼虫随淋巴液和血液循环到达宿主各器官组织,于感染后21 d开始,新生幼虫陆续达到肌肉中并开始形成包囊型肌幼虫,42 d完全形成包囊,并具感染性[8]。旋毛虫在移行与寄生过程中,可通过表面抗原、虫体抗原、杆细胞颗粒相关抗原和排泄分泌(ES)抗原与宿主免疫系统相互作用,而引起宿主的免疫应答[9]。

图5 小肠中各目的基因mRNA相对表达量
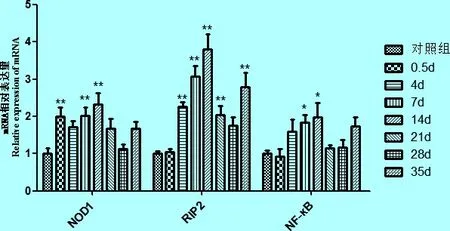
图6 心脏中各目的基因mRNA相对表达量

图7 肺中各目的基因mRNA相对表达量

图8 肌肉中各目的基因mRNA相对表达量
本研究选择了旋毛虫感染后主要移行与寄生的器官组织-小肠、心脏、肺脏和肌肉,来探讨NOD1受体在旋毛虫感染中的作用。试验结果显示,上述各器官组织中存在NOD1受体,目前研究认为,NOD1受体的特异性配体是革兰阴性菌细胞壁中的二氨基庚二酸(-D-gly-meso-diaminopimelic acid,iE-DAP),而本研究结果提示,旋毛虫抗原中可能含有与其对应的配体,但由于旋毛虫抗原种类和成分非常复杂,还不知道旋毛虫的哪类抗原成分和结构能激活该受体。同时,由试验结果可以看出,旋毛虫感染小鼠后,各器官组织中NOD1、RIP2和NF-κB mRNA表达量升高降低的变化趋势与旋毛虫在宿主体内移行途径和不同寄生阶段有关,这也与旋毛虫各类抗原在不同器官组织内出现的时间不同相关。小肠、心脏和肺脏内的各目的基因变化在旋毛虫感染小鼠的早期寄生与移行过程中呈现先上升后下降的趋势,而肌肉内的各目的基因变化在旋毛虫感染后期,即在旋毛虫肌幼虫成囊过程中呈现先高后低的态势。从上述各器官组织中各目的基因变化趋势还可看出,旋毛虫感染先引起宿主免疫增强,后导致出现免疫耐受现象。
以上研究结果揭示,旋毛虫感染可通过激活主要器官组织中NOD1-RIP2-NF-κB信号传导通路,而与宿主免疫系统相互作用,并导致宿主出现免疫耐受。但由于旋毛虫与宿主之间相互作用的复杂性,其具体作用机制还需进一步研究。
[1] Janeway C A,Medzhitov R. Innate immune recognition[J]. Annu Rev Immunol,2002,20: 197-216.
[2] Inohara N,Koseki T,del Peso L,etal.Nod1,an Apaf-1-like activator of caspase-9 and nuclear factor-kappaB[J]. J Biol Chem,1999,274(21): 14 560-14 567.
[3] Keestra A M,Winter M G,Klein-Douwel D,etal. A Salmonella virulence factor activates the NOD1/NOD2 signaling pathway[J]. M Bio,2011,2(6): e00266-11.
[4] Park J H,Kim Y G,McDonald C,etal. RICK/RIP2 mediates innate respomses induced through Nod1 and Nod2 but not TLRs[J]. J Immunol,2007,178(4): 2 380-2 386.
[5] Loving C L,Osorio M,Kim Y G,etal. Nod1/Nod2-mediated recognition plays a critical role in induction of adaptive immunity to anthrax after acrosol exposure[J]. Infect Immun,2009,77(10): 4 529-4 537.
[6] Cho K A,Jun Y H,Suh J W,etal.Orientiatsutsugamushiinduced endothelial cell activation ria the NOD1-1L-32 pathway[J]. Microb Pathog,2010,49(3): 95-104.
[7] 李晓云,徐佳,李巍,等.感染旋毛虫小鼠腹腔巨噬细胞TLR4及细胞因子的变化[J].中国人兽共患病学报,2014,36(10): 801-804.[8] Bruschi F.The immune response to the parasitic nematodeTrichinellaand the ways to escape it From experimental studies to implications for human infection[J]. Curr Drug Targets Immune Endocr Metabol Disord,2002,2(3): 269-80.
[9] 马鸣旺,申丽洁.旋毛虫抗原的研究进展[J].中国病原生物学杂志,2008,3(8):631-634.
The monitoring of the mRNA expressions of NOD1,RIP2, NF-κB in mice tissues and organs afterTrichinella spiralis infection
HU Jing , HAN Cai-xia , ZHAO Xiang , MENG Shi , ZHANG Yan , LI Ying , LI Cheng , LI Xiao-yun , SONG Ming-xin
(Northeast Agricultural University, Harbin 150030, China)
In this study, mRNA expressions of NOD1 receptor, adaptor molecule RIP2 and downstream molecule NF-κB in small intestines, lungs, hearts and muscles of the Trichinella spiralis infected mice were analyzedby fluorescent quantitative PCR. Results indicated that the target gene expressions were significantly (p<0.01)elevated in small intestines and hearts during different phases of Trichinella spiralis infection, reaching peak values at day 4 and day 14 after infection, respectively. In lung, the mRNA expression level of NOD1 was only slightly elevated at day 7 after infection, and mRNA expression level of RIP2 was significantly (P<0.01) elevated at different infection stages, and reached peak value at day 4 after infection. In muscle, the mRNA expression levels of target genes were all significantly increased (P<0.01)at day 21, 28 and 35 after infection, and reached peak value in at day 28. The results show that the expression levels of NOD1, RIP2, and NF-κB in small intestine, lung, heart and muscle of mice are affected by the infection with Trichinella spiralis at different degrees, and all these are closely related with the shift way of Trichinella spiralis in the host and different parasitic stages and all kinds of antigen produced by them.
Trichinella spiralis ; NOD1 receptor ; Tissues ; Fluorescent quantitative PCR
SONG Ming-xin
2016-12-19
国家自然科学基金项目(31172312)
胡静(1990-),女,硕士,研究方向为寄生虫病及其分子生物学,E-mail:249397913@qq.com
宋铭忻,E-mail:songmx@neau.edu.cn
S855.9
A
0529-6005(2017)07-0003-04

