天然生物活性N-酰基高丝氨酸内酯小分子抗原的化学合成及其抗体生成初探
付凯飞,王欲晓,李 军,吴成林,周丽君
天然生物活性N-酰基高丝氨酸内酯小分子抗原的化学合成及其抗体生成初探
付凯飞,王欲晓,李 军,吴成林,周丽君
目的人工合成N-酰基高丝氨酸内酯(N-acylated homoserine lactones,N-aHSLs)完全抗原并制备相应单抗,建立N-aHSLs免疫检测的新方法及海洋弧菌N-aHSLs动态监测。方法以月桂酸和高丝氨酸内酯为主要原料,通过多步系列化学反应人工合成N-十二酰高丝氨酸内酯(N-lauroyl-homoserine lactone,N-C12-HSL)及含羧基活性交联基团的半抗原衍生物12-羧基-N-十二酰高丝氨酸内酯(12-carboxyl-N-decanoyl-L-homoserine lactone,12-CD-LHL),用1H-磁共振、高压/效液相色谱仪和液相色谱-质谱联用方法确证合成产物的结构,并用生物感应法检测合成N-aHSLs的天然生物活性;用N-羟基琥珀酰亚胺活泼酯法将12-CD-LHL半抗原衍生物连接到载体蛋白;将N-C12-HSL人工完全抗原通过传统单抗制备技术,获得抗N-aHSLs杂交瘤细胞株,用酶联免疫吸附测定法鉴定其特异性和效价。结果质谱、磁共振氢谱分析结果与理论预测相同,成功合成目标产物N-C12-HSL和12-CD-LHL半抗原衍生物;所合成的N-aHSLs能够分别激活生物感应菌株大肠杆菌MG4和紫色色杆菌026并使之显色;紫外吸收光谱扫描结果显示,半抗原已分别与牛血清白蛋白和卵清蛋白发生偶联,成功制备完全抗原;共获得3株抗N-C12-HSL单抗,均具有良好的免疫反应性。结论N-aHSLs完全抗原和相应的单抗制备为N-aHSLs动态监测和后续研究奠定了基础。
N-十二酰高丝氨酸内酯;半抗原衍生物;单抗
菌群感应(quorum sensing,QS)信号分子是细菌产生的一种菌体细胞与细胞间的通讯工具,即细菌通过可扩散的信号分子感知菌群的密度,从而引起一些特定基因在细菌群体中的表达。QS信号分子主要包括具有不同酰基侧链的N-酰基高丝氨酸内酯(N-acylated homoserine lactones,N-aHSLs)、一些小肽以及自体诱导子,其中N-aHSLs是大多数革兰阴性细菌产生的QS信号分子,也是近年来的研究热点。大量研究表明,细菌感染致病机制与QS系统的调控密切相关。弧菌是水生环境中分布最多的细菌,课题组及前期研究的文献资料表明,部分亚群可导致人类发生严重感染[1-3]。N-aHSLs是海洋弧菌产生的一类重要QS信号分子[4-6],这些N-aHSLs可通过海洋弧菌QS系统发挥调控作用,参与调控生物膜的形成、细菌毒力因子释放等许多生理特性,抑制或干扰细菌产生N-aHSLs是目前缓解细菌耐药、减弱细菌致病力等感染治疗的重要途径。因此,随着对细菌QS领域研究的深入,对于信号分子N-aHSLs的检测和分析研究也越来越引起人们的关注。
目前,关于检测N-aHSLs信号分子的方法主要有物理学方法和生物传感器测定法。物理学方法一般使用高效液相色谱技术来检测,同时还可以通过连接质谱、磁共振或红外光谱来鉴定其结构、性质[7];生物传感器测定法需构建突变菌株,通过外源信号分子启动其报告基因的转录表达,进而检测其活性[8-9]。这2种方法操作复杂,重复性差,耗时、耗力,检测费用昂贵,不适于连续测定和现场监测。基于单抗作为一种特异性强、灵敏度高、反应快速的经典生物医学检测试剂,目前已广泛应用于免疫组织化学、酶联免疫吸附测定及流式细胞检测等技术。因此,研制N-aHSLs的单抗,建立相应的N-aHSLs快速免疫诊断方法,成为目前N-aHSLs分析测定的新选择。
目前,已有研究制备出针对3-氧-N-癸酰高丝氨酸内酯和N-辛酰高丝氨酸内酯的单抗,并揭示了这些特异性抗体的潜在临床免疫诊治价值[10]。但现有针对N-aHSLs分子的单抗种类很少且尚局限于实验室研究阶段,故在N-aHSLs的免疫分析领域还有很大的探究空间,这也是课题组研究目前对接的方向。此外,由于N-aHSLs天然存在量极少,且不稳定,故采用常规天然提取方法较难获得;而既往采用人工方法合成N-aHSLs时,往往不能兼顾保留其天然生物活性,具备天然免疫活性又是获得高亲和力N-aHSLs抗体所必需的。因此,合成获得具有天然活性的N-aHSLs,制备出高灵敏、特异的单抗,仍然具有很大的挑战性,国内外鲜见相关研究。
为此,本研究尝试以有较长侧链的N-十二酰高丝氨酸内酯(N-lauroyl-homoserine lactone,N-C12-HSL)为靶标,通过有机合成技术和单克隆制备方法,制备出针对N-aHSLs的单抗,为进一步建立简便、快捷的N-aHSLs动态检测方法开辟一条新途径。
1 材料与方法
1.1 材料
1.1.1 主要仪器 Electron LCQ Deca液质联用仪(美国Thermo公司),DRX-400磁共振仪(德国Bruker公司)。
1.1.2 主要试剂 化学合成试剂月桂酸、L-高丝氨酸内酯盐酸盐、草酰氯、月桂酰、二甲基甲酰胺、二甲基氯硅烷(美国Sigma公司);完全弗氏佐剂和不完全弗氏佐剂(北京赛驰生物技术),PEG 1500聚乙二醇(德国Merck公司),HT supplement及HAT supplement细胞选择性培养基(美国Gibco公司),洛斯维公园纪念研究所1640培养基(北京天润善达生物技术),辣根过氧化物酶(horseradish peroxidase,HRP)标志的羊抗鼠免疫球蛋白G(美国Sigma公司);溶菌肉汤(lysogeny broth,LB)培养基(北京陆桥公司),海生菌肉汤培养基(美国BD公司);N-己酰高丝氨酸内酯(N-caproyl-L-homoserine lactone,N-C6-HSL)、N-丁酰高丝氨酸内酯(N-butyryl-L-homoserine lactone,N-C4-HSL)、完全抗原N-丁酰高丝氨酸内酯-卵清蛋白(N-butyryl-L-homoserine lactone-ovalbumin,NC4-HSL-OVA)以及完全抗原N-己酰高丝氨酸内酯-OVA(N-caproyl-L-homoserine lactone-OVA,N-C6-HSLOVA)由课题组前期合成[11]。
1.1.3 菌株 铜绿假单胞菌(pseudomonas aeruginosa,PA)ATCC 27853(美国菌种保藏中心);异源QS菌株大肠杆菌MG4(escherichia coli,E.coli MG4)由美国盖泽尔医学院Deborah A.Hogan教授授权中国海洋大学宫倩红实验室馈赠;异源QS菌株紫色色杆菌026(chromobacterium violaceum 026,CV026)由军事医学科学院五所童怡刚实验室馈赠。
1.1.4 动物 雌性BALB/c小鼠(8周龄)海军总医院动物中心,实验动物质量合格证SCXK-(军) 2012-0004,实验动物使用许可证SYXK-(军)2012-0012。
1.2 方法
1.2.1 N-C12-HSL的合成 将2.00 g(10 mmol/L)月桂酸加入0.05 L二氯甲烷中,加入草酰氯5.00 g (39.4 mmol/L),搅拌并浓缩至干,加入二氯甲烷和二甲基甲酰胺混合溶液0.025 L,加入L-高丝氨酸内酯盐酸盐1.40 g(10.2 mmol/L)和三乙胺0.002 L,55℃反应过夜并浓缩至干,经二氯甲烷洗涤未溶解的部分为目的产物。产物进行1H-磁共振(1H-nuclearmagnetic resonance,1H-NMR)和高压/效液相色谱仪(high pressure/performance liquid chromatography,HPLC)表征。合成路线见图1。
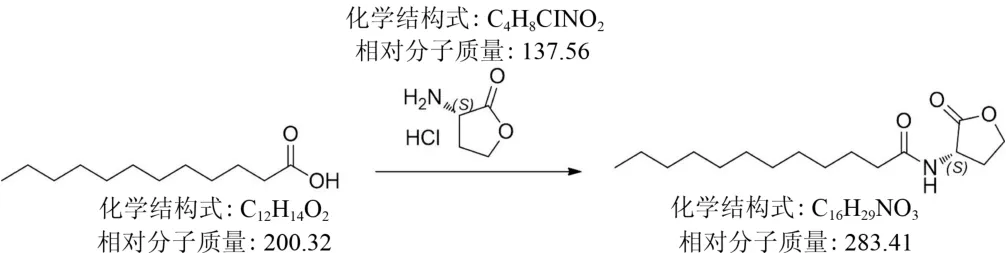
图1 N-C12-HSL合成路线
1.2.2 N-aHSLs生物活性鉴定 采用平板划线法检测[12]。以产生QS信号分子3-氧-N-十二酰高丝氨酸内酯的PA验证E.coli MG4敏感性,再分别用E.coli MG4和CV026验证合成产物N-C12-HSL和N-C6-HSL的生物活性。将分别培养于LB培养液中的PA和 E.coli MG4菌液稀释到光密度(optical density,OD)值600 nm即OD600=0.5,并分别取30 μL菌液在LB培养基上呈“T”方式涂板(图2A),37℃培养12 h后观察变化。同样,将LB培养液中的E.coli MG4和CV026菌液稀释到OD600=0.5,并分别取30μL菌液在LB培养基上呈“i”方式涂板;将合成的N-aHSLs分别用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,各取5μL N-aHSLs溶液加于5 mm×5 mm无菌滤纸上,置于涂板的感应菌液的一端,使两者呈“i”字状(图2b),设DMSO为空白对照组,30℃培养12 h后取出观察。
图2 N-aHSLs生物活性鉴定涂板
1.2.3 12-羧基-N-十二酰高丝氨酸内酯的合成用N-羟基琥珀酰亚胺活泼酯法合成12-羧基-N-十二酰高丝氨酸内酯(12-carboxyl-N-decanoyl-L-homoserine lactone,12-CD-LHL)。将4.60 g十二碳二酸加入到0.095 L二氯甲烷中,加入特戊酰氯2.40 g,然后加入三乙胺2.20 g,加热至回流,搅拌4 h并浓缩至干,加入0.025 L二氯甲烷和二甲基甲酰胺的混合溶液,加入4-二甲基氨基吡啶0.24 g、L-高丝氨酸内酯盐酸盐2.80 g及三乙胺0.002 L,55℃反应过夜,浓缩至干,经高压液相制备目的产物,产品进行1H-NMR、HPLC和液相色谱-质谱联用(liquid chromatography-mass spectroscopy,LC-MS)确证。合成路线见图3。
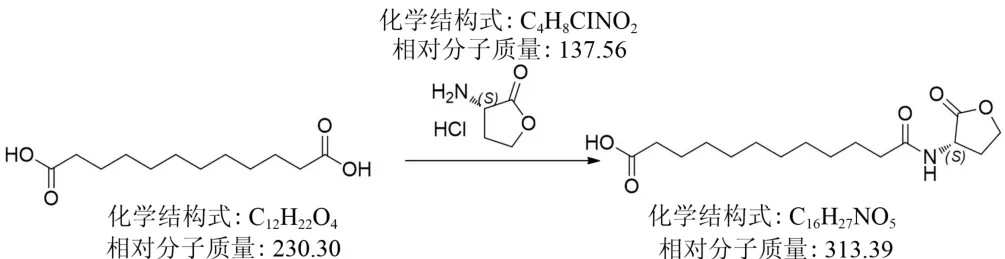
图3 12-CD-LHL合成路线
1.2.4 N-C12-HSL完全抗原制备 参照文献[13-14]活泼酯法制备完全抗原。获得的偶联产物用紫外光谱扫描法鉴定[15-16],Bradford法测定蛋白浓度,分装后-76℃保存。
1.2.5 动物免疫及杂交瘤细胞系的建立 采用常规杂交瘤单抗制备技术[17-18],将人工合成的羧基-N-十二酰高丝氨酸内酯-牛血清白蛋白(carboxyl-N-decanoyl-L-homoserine lactone-bovine serum albumin,CDLHL-BSA)完全抗原免疫BALB/c小鼠(每次每只100~150μg),共腹腔注射4次,每次间隔21 d,第3次免疫后小鼠眼球取血,用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测血清抗体滴度,并于末次免疫后第3天取小鼠脾细胞与小鼠骨髓瘤细胞系SP2/0融合;羧基-N-十二酰高丝氨酸内酯-OVA(carboxyl-N-decanoyl-L-homoserine lactone-OVA,CD-LHL-OVA)作为包被抗原,ELISA检测杂交瘤细胞培养上清效价,筛选阳性细胞孔,常规有限稀释法筛选阳性克隆,重复3次,以便获得的杂交瘤细胞能够稳定分泌单抗;常规腹水法制备大量单抗,同时冻存腹水中细胞。
1.2.6 血清抗体效价及抗C12-HSL单抗的特异性鉴定 用间接ELISA进行检测[17-18]。先用包被缓冲液将包被抗原CD-LHL-OVA进行倍比稀释,每孔0.1 mL,4℃过夜,弃去孔内液体并洗涤、拍干,加封闭液每孔250μL,37℃放置2~3 h;重复洗涤后分别与免疫小鼠血清(1∶25 000~1∶50稀释)或杂交瘤细胞培养上清(1∶1 280~1∶5稀释)反应(37℃放置1 h),然后再与HRP标志的羊抗鼠免疫球蛋白G二抗(1∶2 000稀释)反应(37℃放置1 h),邻苯二胺方法显色;全自动定量酶标仪测定其OD490值,若大于规定的阴性对照的2.1倍,即为阳性。同时,将N-aHSLs用磷酸缓冲盐溶液倍比稀释成系列标准浓度(1 600、400、100、25、6.25、1.56、0 ng/mL),进行间接竞争ELISA检测,比较其半抑制浓度(halfmaximal inhibitory concentration,IC50),并计算抗C12-HSL单抗与其他N-aHSLs的交叉反应率,即 IC50(CDLHL)/IC50(其他N-aHSLs)×100%。
1.3 统计学处理 应用SPSS 11.0软件,组间比较采用方差分析,Excel软件作图,P<0.05为差异有统计学意义。
2 结果
2.1 N-C12-HSL的表征 LC-MS显示所合成的化合物的分子离子峰[M+H]+为284,与N-C12-HSL的理论分子离子峰完全一致;所得产物1H-NMR鉴定图谱数据与理论分析完全一致,即为目标化合物NC12-HSL。1H-NMR鉴定图谱数据为[400 MHz,氘氯仿;多重峰(multi-peaks,m);氢(hydrogen,H);双峰(doublet,d)]:0.882~0.915(m,3H),1.276~1.315 (m,16H),1.645~1.680(m,2H),2.119~2.172(m,1H),2.248~2.286(m,2H),2.888(m,1H),4.297~4.339(m,1H),4.469~4.514(m,1H),4.566~ 4.580(m,1H),6.041(d,1H,偶合常数=4)。
2.2 N-C12-HSL的生物活性 “T”涂板显示,靠近PA处的E.coli MG4条带有明显显色(图4A)。“i”涂板显示,合成的 N-C12-HSL分子可与感应菌株E.coli MG4结合并使之显色,产生与PA相似的效果;同样,N-C4-HSL和N-C6-HSL分子也可与感应菌株CV026结合并使之显现特征性的紫色(图4B)。
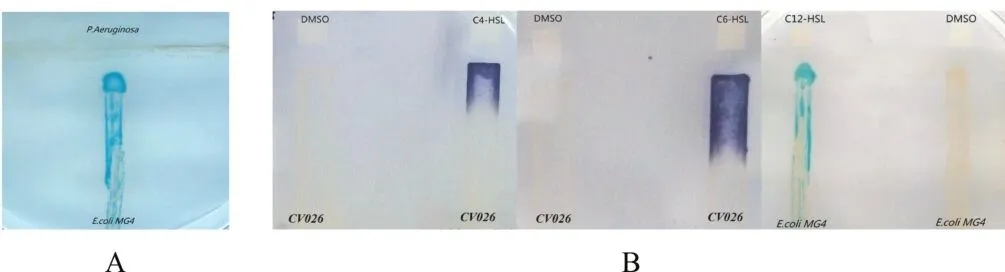
图4 N-aHSLs生物活性鉴定
2.3 CD-LHL的表征 LC-MS图谱显示化合物的分子离子峰[M+H]+为314,与CD-LHL的理论分子离子峰完全一致;1H-NMR鉴定图谱数据与理论分析也一致,即为目标化合物CD-LHL。1H-NMR(400 MHz,DMSO-d6):1.235(m,12H),1.474(m,4H),2.089(m,2H),2.177(m,2H),2.357(m,1H),4.197(m,1H),4.327~4.332(m,1H),4.494(m,1H),4.566~4.580(m,1H),8.290(d,1H,偶合常数=8)。2.4 CD-LHL-OVA和CD-LHL-BSA鉴定 人工合成的完全抗原紫外吸收图谱不同于原载体蛋白(BSA)和CD-LHL半抗原的紫外扫描图谱(图5)。
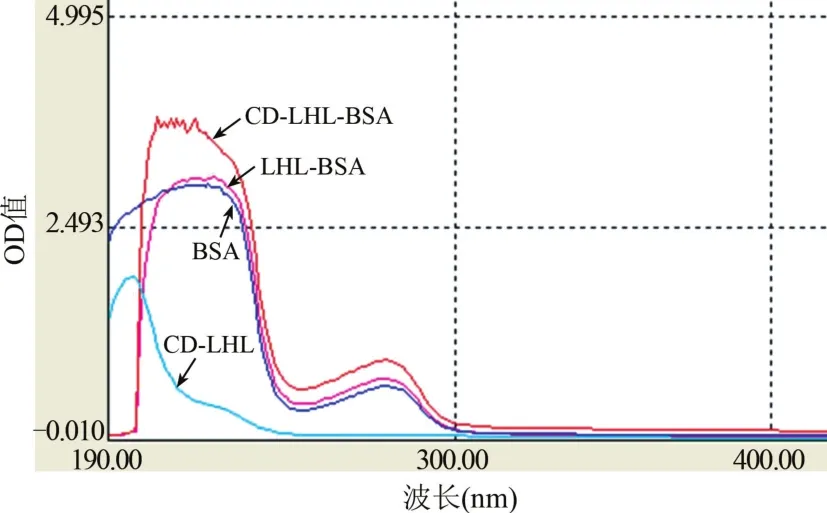
图5 CD-LHL-BSA(OVA)紫外吸收光谱图
2.5 抗N-C12-HSL单抗鉴定 以人工合成的CDLHL-BSA作为免疫抗原,经反复间接ELISA检测初筛后,获得01A8、03F5和06F4共3株杂交瘤细胞克隆。
2.5.1 间接ELISA效价测定 CD-LHL-OVA包被酶标板浓度为1.5 mg/L,ELISA检测杂交瘤细胞培养上清单抗效价为10-2(图6),CD-LHL-BSA免疫小鼠血清效价可达10-4。
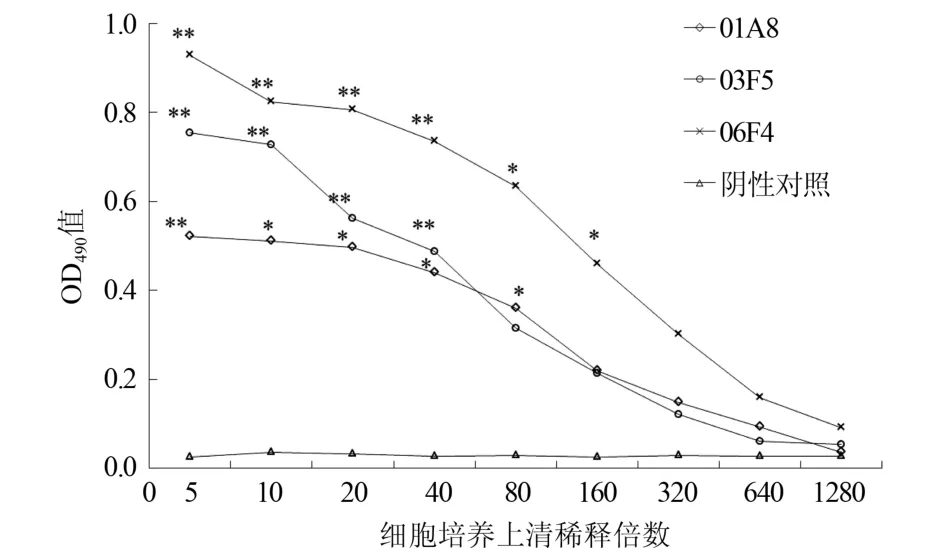
图6 抗CD-LHL杂交瘤细胞培养上清效价检测
2.5.2 单抗灵敏度测定 以CD-LHL的浓度常用对数为X轴,以CD-LHL的ELISA检测OD值为Y轴,拟合标准曲线的回归方程。根据标准曲线回归方程:y=-0.754 5x+3.401 5(R2=0.992 1),抗CDLHL单抗的IC50是190.98 ng/mL。
2.5.3 特异性鉴定 抗N-aHSLs抗体与N-C4-HSL和N-C6-HSL分子交叉反应实验见表1。单抗01A8与N-C4-HSL和N-C6-HSL抗原交叉反应率均小于0.3%,单抗03F5、06F4分别与 N-C6-HSL及N-C4-HSL抗原交叉反应率为8%~23%。
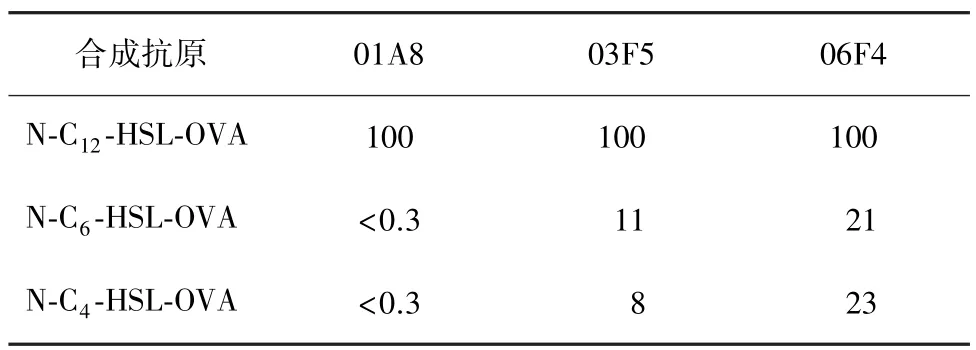
表1 N-C12-HSL单抗与其他HSL抗原的交叉反应率检测(%)
3 讨论
N-aHSLs信号分子主要由革兰阴性菌产生,其对于感染的重要性已广为报道。自然环境中尤其在海洋中革兰阴性菌也占主导优势,常见的如假单胞菌、弧菌、杆菌、非发酵菌等。当这些细菌以群体形式存在时,N-aHSLs等信号分子与细菌受体结合,进而调控细菌生理功能,如形成生物被膜、产生毒力因子等,使细菌的生长模式、代谢状态和耐药性发生显著的变化,往往造成难治性感染,引起极高的死亡率。如果能够及时、快捷地识别菌群产生的信号分子,并能准确地定量分析,将有助于深入了解菌群的生理活性、感染能力及毒力特点,从而更有效地把握控制细菌感染的时机和措施,同时也可为深入研究QS及其调控机制提供有力工具。因此,制备N-aHSLs单抗可用于对QS信号分子进行免疫测定,较为便捷、灵敏,可作为现有常规分析技术和生物传感器测定法的替代或补充。此外,制备的抗体也可应用于N-aHSLs原位检测、中和抗体及免疫化学测定、流式细胞检测等技术的研究中。
由于人工合成的N-aHSLs是一种非天然存在的小分子酰胺类分子,在制备抗体前首先要对侧链的水溶性和长度进行选择。相关研究资料表明,N-aHSLs侧链碳原子的数目与其免疫活性相关,酰基侧链较短时免疫活性较弱,而侧链长度为11~14个碳原子时免疫活性较强[19]。故本实验首先选择具有较强免疫活性的N-C12-HSL为研究对象,以月桂酸、L-高丝氨酸内酯盐酸盐及草酰氯等为原料,通过酰化反应大量合成了N-C12-HSL,解决了其来源紧张的问题。本研究对合成的N-C12-HSL进行了表征鉴定,1H-NMR和HPLC分析结果与理论预测相一致,表明目标产物N-C12-HSL合成成功。
对合成的信号分子生物活性的检测采用敏感菌株信号感应方法,用感应菌株E.coli MG4和CV026分别检测长链和短链的N-aHSLs。生物感应菌株E. coli MG4以β-半乳糖苷酶基因为报告基因,对含有8~14个碳原子的外源性N-aHSLs敏感,有外源性N-aHSLs存在时,其β-半乳糖苷酶基因被激活并显现蓝色[20]。由于PA可产生特征性的3-氧-N-十二酰高丝氨酸内酯分子[21],本研究用PA标准菌株验证E.coli MG4的敏感性;结果显示E.coli MG4可以检测到PA产生的QS信号分子,合成的N-C12-HSL分子也可与E.coli MG4结合并使之显色,说明合成的N-C12-HSL分子具备与生理条件下产生的N-aHSLs分子相同的生物活性。而CV026为mini Tn5双重突变株,本身不产生N-aHSLs,但经外源短侧链N-aHSLs(含4~8个碳原子)激活时可使产色素基因表达而显示特征性的紫色[22]。本实验结果显示CV026能够被人工合成的N-C4-HSL和N-C6-HSL分子激活显色,证明这些合成的N-aHSLs分子具备天然分子的生物活性。这些合成N-aHSLs天然生物活性的验证也从侧面提示其天然免疫活性的存在可能性,为后续制备其高亲和力抗体的可行性提供保障。
由于N-aHSL是小分子水溶性内酯类化合物,无法直接诱导机体产生特异性抗体。因此,必须将N-C12-HSL与载体蛋白进行化学交联,使之成为具有免疫原性的完全抗原,才能通过动物免疫制备其特异性抗体。本实验反复比较直接在N-C12-HSL分子上连接活性基团、构建半抗原中间体等多种方法的效果后,最终选择采用本身含有-COOH活性基团的十二碳二酸(C12H22O4)重新合成与N-C12-HSL结构相似的半抗原衍生物CD-LHL。CD-LHL因其起始原料十二碳二酸的结构特殊性,使用二氯亚砜、草酰氯等常规的生成酰氯的方法,然后和L-高丝氨酸内酯盐酸盐反应,都无法得到产物;采用生成酰胺键的常用缩合方法,例如碳二亚胺、二环己基碳二亚胺的偶联反应,也无法得到预期的产物;经过大量的实验筛选,本实验使用特戊酰氯生成活泼酸酐,然后用L-高丝氨酸内酯盐酸盐在碱性条件下对活泼酯进行胺解,得到了CD-LHL。用LC-MS、HPLC和1H-NMR进行产物确证,CD-LHL的结构和相对分子质量与理论预测一致,表明化学合成CD-LHL成功。并根据羧基偶联特点,选择较为常用的N-羟基琥珀酰亚胺活泼酯法,将CD-LHL半抗原与BSA偶联合成了人工抗原,前期的紫外吸收光谱扫描初步鉴定和后期小鼠免疫活性验证均表明偶联成功。此制备方法成本低廉,适用于大量合成。
而本研究在成功合成N-C12-HSL人工抗原的基础上,利用成熟的单抗制备技术,制备了3株能稳定分泌抗N-C12-HSL单抗的杂交瘤细胞系;抗体初步鉴定表明,杂交瘤细胞培养上清中单抗效价为10-2,具有较好的免疫活性,单抗01A8与课题组前期合成的完全抗原N-C4-HSL-OVA和N-C6-HSL-OVA几乎均不发生交叉反应,单抗03F5、06F4分别与完全抗原N-C6-HSL-OVA及N-C4-HSL-OVA均有弱交叉反应。据文献报道,所制备的N-HSL同类单抗IC50值范围为200~2 000 ng/mL,交叉反应率则变动范围很大,鲜见特异性高的抗HSL抗体[10]。本实验中所得抗N-C12-HSL单抗IC50值相对较低,说明抗体亲和力较好,其中01A8单抗与完全抗原N-C4-HSL-OVA和 N-C6-HSL-OVA交叉反应率均小于0.3%,也显示了较好的特异性。表明这3株单抗具有较好的特异性和免疫反应性。但鉴于参与交叉反应的同类分子种类欠充足,且不同N-aHSLs分子差异的结构基础主要在于酰胺侧链上——长度不同或第3位碳原子上取代基团不同(氢、羟基或羰基),故侧链结构在N-aHSLs抗体识别中担任重要角色。而本实验采用的N-aHSLs免疫抗原结构较为单一,未考虑到侧链第3位碳原子上取代基团的差异对现有抗体识别的影响,现有相关文献资料也鲜有报道,在应用中还需更进一步的鉴定。
虽然N-C12-HSL信号分子含量甚微,检测困难,但目前应用化学有机合成方法使充足N-aHSLs样品的获得成为可能,并通过杂交瘤技术成功制备了N-C12-HSL单抗,为进一步建立基于抗原抗体特异性反应的N-aHSLs免疫学快速检测方法奠定了基础,也为将来实时和现场大批量检测提供了有力工具。
[1]Trubiano JA,Lee JY,Valcanis M,et al.Non-O1,non-O139 Vibrio cholerae bacteraemia in an Australian population [J].Intern Med J,2014,44(5):508-511.
[2]Tsao CH,Chen CC,Tsai SJ,et al.Seasonality,clinical types and prognostic factors of Vibrio vulnificus infection [J].J Infect Dev Ctries,2013,7(7):533-540.
[3]Whittaker SJ.Shellfish-acquired Vibrio cholerae cellulitis and sepsis from a vulnerable leg[J].N ZMed J,2013,126 (1379):95-97.
[4]Buch C,Sigh J,Nielsen J,et al.Production of acylated homoserine lactones by different serotypes of Vibrio anguillarum both inculture and during infection of rainbow trout [J].Syst Appl Microbiol,2003,26(3):338-349.
[5]Tait K,Havenhand J.Investigating a possible role for the bacterial signal molecules N-acylhomoserine lactones in Balanus improvisus cyprid settlement[J].Mol Ecol,2013,22(9):2588-2602.
[6]Wang Y,Wang H,Liang W,et al.Quorum sensing regulatory cascades control Vibrio fluvialis pathogenesis[J].J Bacteriol,2013,195(16):3583-3589.
[7]Makemson J,Eberhard A,Mathee K.Simple electrospray mass spectrometry detection of acylhomoserine lactones[J]. Luminescence,2006,21(1):1-6.
[8]Deng X,Zhuang G,Ma A,et al.Construction of a dual fluorescence whole-cell biosensor to detect N-acyl homoserine lactones[J].J Environ Sci(China),2014,26(2):415-422.
[9]Anbazhagan D,Mansor M,Yan GO,etal.Detection ofquorum sensing signalmolecules and identification of an autoinducer synthasegene among biofilm forming clinical isolates of Acinetobacter spp[J].PLoS One,2012,7(7):e36696.
[10]Chen X,Kremmer E,Gouzy MF,et al.Development and characterization of ratmonoclonal antibodies for N-acylated homoserine lactones[J].Anal Bioanal Chem,2010,398(6):2655-2667.
[11]付凯飞,赵翀,周丽君,等.N-酰基高丝氨酸内酯半抗原衍生物及其全抗原的合成与鉴定[J].转化医学杂志,2013,2(6):348-351.
[12]Han-Jen RE,Wai-Fong Y,Kok-Gan C.Pandoraea sp.RB-44,a novel quorum sensing soil bacterium[J].Sensors (Basel),2013,13(10):14121-14132.
[13]Taguchi T,Saito H,Iwasashi M,et al.Development of a novel glue consisting of naturally-derived biomolecules:citric acid and human serum albumin[J].JNanosciNanotechnol,2007,7(3):742-747.
[14]Peeters JM,Hazendonk TG,Beuvery EC,et al.Comparison of four bifunctional reagents for coupling peptides to proteins and the effect of the threemoieties on the immunogenicity of the conjugates[J].J ImmunolMethods,1989,120 (1):133-143.
[15]Tazawa T,Zhao HQ,Li Y,et al.A new enzyme immunoassay for aconitine and its application to quantitative determination of aconitine levels in plasma[J].Biol Pharm Bull,2003,26(9):1289-1294.
[16]Pauillac S,Naar J,Branaa P,et al.An improved method for the production of antibodies to lipophilic carboxylic hapten using small amount of hapten-carrier conjugate[J]. J Immunol Methods,1998,220(1/2):105-114.
[17]Li T,WangW,Chen Y,etal.Preparation and characterization of monoclonal antibodies against VSTM1[J].Monoclon Antib Immunodiagn Immunother,2013,32(4):283-289.
[18]付凯飞,马骢,郭建巍,等.抗创伤弧菌单克隆抗体杂交瘤细胞系的建立及初步鉴定[J].细胞与分子免疫学杂志,2012,28(3):279-281.
[19]Chhabra SR,Harty C,Hooi DS,et al.Synthetic analogues of the bacterial signal(quorum sensing)molecule N-(3-oxododecanoyl)-L-homoserine lactone as immunemodulators[J].JMed Chem,2003,46(1):97-104.
[20]Kumar R,Chhibber S,Gupta V,etal.Screening&profiling of quorum sensing signalmolecules in Pseudomonas aeruginosa isolates from catheterized urinary tract infection patients[J].Indian JMed Res,2011,134:208-213.
[21]Nagant C,Seil M,Nachtergael A,et al.Contribution of the production of quormones to some phenotypic characteristics of Pseudomonas aeruginosa clinical strains[J].JMed Microbiol,2013,62(Pt 7):951-958.
[22]Lade H,Paul D,Kweon JH.Isolation and molecular characterization of biofouling bacteria and profiling of quorum sensing signalmolecules from membrane bioreactor activated sludge[J].Int JMol Sci,2014,15(2):2255-2273.
Chemosynthesis of N-acylated homoserine lactones hapten derivant and the prelim inary study of its antibody formation
FU Kaifei1,WANG Yuxiao1,LIJun2,WU Chenglin1,ZHOU Lijun1
(1.Center for Basic Medical Science,Navy General Hospital,Beijing 100048,China;2.Department of Scientific Research and Training,Navy General Hospital,Beijing 100048,China)
ObjectiveTo synthesize the artificial holoantigen and correspondingmonoclonal antibodies of N-acylated homoserine lactones(N-aHSLs),and to provide basis for establishment of a new immunodetection and monitoringmethod of N-aHSLs.MethodsLauric acid and homoserine lactone were used as the startingmaterials to synthesize N-lauroyl-homoserine lactone(N-C12-HSL) and the hapten derivantof12-carboxyl-N-decanoyl-L-homoserine lactone(12-CD-LHL)with chemical crosslinking active group by serial reactions.The target products were characterized by1H nuclearmagnetic resonance(1H-NMR),high pressure/performance liquid chromatography(HPLC) and liquid chromatograph-mass spectrometer(LC-MS).The natural bioactivity of N-aHSLs was detected by biological response method.Holoantigen of N-C12-HSL was synthesized by the method of active ester.BALB/cmicewas immunized with N-C12-HSL holoantigen,and hybridoma cells against N-C12-HSL were produced by cell-fusion technique.The specificity and titers ofmonoclonal antibody against N-C12-HSL were screened by enzyme-linked immunosorbent assay.ResultsThe1H-NMR,HPLC and LC-MS results revealed that the obtained compound were the target product of N-C12-HSL and 12-CD-LHL,just as the prediction.The synthetical N-aHSLs could activate the biological response strains of escherichia coli and chromobacterium violaceum 026 seperately and color the strains.The ultraviolet absorption spectrum results revealed that hapten N-C12-HSL had crosslinked with bovine serum albumin and ovalbumin,N-C12-HSL holoantigen had been prepared well.Three strains of hybridoma against N-C12-HSL were obtained,and the identification results indicated which all have favourable immunoreactivity.ConclusionThe preparation of N-aHSLs whole antigen and correspondingmonoclonal antibody laid the foundation for N-aHSLs dynamic monitoring and subsequent research.
N-lauroyl-homoserine lactone(N-C12-HSL);Hapten derivant;Monoclonal antibody
R344
A
2095-3097(2017)04-0207-07
10.3969/j.issn.2095-3097.2017.04.004
2016-10-27 本文编辑:徐海琴)
国家自然科学基金青年科学基金项目(31400107);军队重点项目(BHJ14J004);海军总医院创新培育基金(CX201201)
100048北京,海军总医院中心实验科(付凯飞,王欲晓,吴成林,周丽君),科训科(李 军)
周丽君,E-mail:hzzhoulj@126.com

