帕金森病的秀丽隐杆线虫模型研究进展
赵亦周,王香明
帕金森病的秀丽隐杆线虫模型研究进展
赵亦周,王香明
帕金森病是第二大神经退行性疾病,病因及发病机制复杂,可能与年老、环境因素及遗传因素等有关,目前尚不能治愈。秀丽隐杆线虫因其独特的优势,逐渐成为研究帕金森疾病的重要模式生物。作者对近几年帕金森病的秀丽隐杆线虫转基因模型和化学因素诱导模型进行综述。
秀丽隐杆线虫;帕金森病
帕金森病(Parkinson’s disease,PD)由英国医生James Parkinson于1817年首次报道描述,是仅次于阿尔兹海默病的第二大神经退行性疾病,以运动障碍为主要表现,55岁以上人口PD患病率为1.4%,65岁以上人群中患病率大约为2%,75岁以上人口中达3.4%[1]。PD的主要临床表现是静止性震颤、肌强直、运动迟缓;典型的病理改变是中脑黑质致密部多巴胺(dopamine,DA)能神经元进行性变性缺失,残存神经元胞浆内路易小体(Lewy’s body)形成,主要成分为 α-突触蛋白(α-Synuclein,α-Syn)、泛素等[2]。PD病因及发病机制复杂,可能与年老、环境因素及遗传因素等有关,目前尚不能治愈,主要是对症治疗。
PD疾病病程长、致残率高,给患者、家庭及社会造成非常沉重的负担。为了更深入研究探讨PD病因、病理、预防与治疗方案,寻找并制备合适的动物模型至关重要。秀丽隐杆线虫(Caenorhabditis elegans,C.elegans)作为理想的模式生物,在PD的研究中发挥着不可替代的作用。
1 C.elegans
20世纪70年代Brenner[3]首次将C.elegans作为动物模型用于遗传基础研究,证明C.elegans是一个非常有价值的模式动物。C.elegans属于低等无脊椎动物,如今被生物学家们广泛用来进行基因组、细胞生物、细胞死亡、表观遗传以及抗衰老研究。它身体透明,有雌雄同体和雄虫2种性别特征,成虫体长1~2mm,以大肠杆菌为食,生命周期为3 d,具有结构简单、生命周期短暂、繁殖迅速和易于培养的特点。
C.elegans由959个体细胞构成,其神经系统只含有302个神经元,每一个神经元都有其特定的位置,走向都特别清晰明确,是所有动物中细胞谱系和神经元连接研究最清楚的一种模式动物,为研究哺乳动物神经系统提供了框架。其中共有75个运动神经元,包括56个胆碱能神经元和19个γ-氨基丁酸神经元。它的基因功能与哺乳动物相似,并具有与哺乳动物类似的神经递质,如乙酰胆碱、DA、5-羟色胺、谷氨酸和神经肽等。最重要的是,C.elegans雌雄同体有一个相对简单的DA神经系统,包括8个神经元;其中4个头部神经元和2个咽前部神经元,还有2个位于身体中部的神经元;其DA神经末梢和突触囊泡的DA水平与哺乳动物的神经细胞相似[4]。它透明的身体为观察细胞的变化和虫体中荧光标志蛋白的表达提供了方便[5],很容易观察和量化神经细胞的死亡[6],在活体组织中,能够观察到某特定神经元的缺失或者存在,这是在研究神经退行性疾病时非常重要的一点。
同时,C.elegans是第1个完成了基因组测序的多细胞生物[7],并将数据提供给公众。此外,C.elegans遗传中心有大量的突变株供研究者使用,并具有丰富的网络资源与数据库。因此,C.elegans是研究退行性疾病非常好的模式动物。
2 PD的C.elegans模型
2.1 转基因模型
2.1.1 α-Syn模型 α-Syn是构成路易小体的最主要蛋白,在家族性和特发性PD的发病机制中都扮演着非常重要的作用。通过研究,人们已经发现了多个与PD相关的基因,比如PARK1、PARK2、PARK5、PARK6、PARK7、PARK8、PARK9、PARK11及PARK13;在C.elegans中发现了6个同源基因,但不包括编码α-Syn的PARK1。这个特性允许研究者建立过表达人源α-Syn的野生型或突变型C.elegans模型,研究α-Syn在PD发病中的作用,而不用考虑内源性α-Syn的影响,简化了实验条件。
研究者们通过在C.elegans的不同细胞中过表达α-Syn,从而对PD发病机制进行研究,并且筛选相关药物。Lakso等[8]利用不同启动子(promotor,P)aex-3、acr-2、unc-30及dat-1,建立过表达人源α-Syn的野生型和A53T突变的C.elegans模型,发现α-Syn过表达可以导致C.elegans运动减少、DA能神经元减少、树突减少及神经元传递中断增多;在DA能神经元中的过表达可诱导C.elegans产生渐进性、时间依赖性神经退行性疾病和运动缺陷。Springer等[9]利用过表达 α-Syn模型发现 C.elegans Parkin同源蛋白PDR-1突变进一步增强α-Syn过表达造成的发育异常和致死。Kuwahara等[10]报道,A30P和A53T C.elegans模型中α-Syn的过表达导致DA水平下降,DA神经元树突退行性病变,并且丧失对食物的反应。Vartiainen等[11]研究了α-Syn过表达C.elegans模型导致基因的表达改变,发现7个泛素相关基因以及35个线粒体相关基因高表达,9个组蛋白相关基因低表达。Kuwahara等[12]报道,过表达α-Syn模型可能通过影响内吞通路而导致神经退行性病变。Cao等[13]报道α-Syn通过破坏DA的平衡而导致DA神经元退行性病变。Shukla等[14]报道环烯醚萜类化合物10-O-trans-p-coumaroylcatalpol可以降低α-Syn的聚集并且延长 C.elegans的寿命。Fu等[15]报道正丁烯基苯酞保护C.elegans免于DA神经退行性病变。Johnson等[16]报道,谷氧还蛋白对C.elegans PD模型有保护作用。Jadiya等[17]通过系统的RNA干扰筛选发现,组蛋白去甲基化酶、小核糖体亚基、细胞骨架蛋白等对过表达α-Syn造成的神经损伤有保护作用。
α-Syn模型能够很好地模拟PD行为学改变、神经元结构、神经生化的改变过程,是研究PD发病机制、基因治疗以及药物干预的良好动物模型。今后C.elegansα-Syn模型将继续发挥其在基因药物筛选中的巨大作用,为阐释PD机制贡献力量。
2.1.2 LRRK2转基因模型 LRRK2是常染色体显性遗传性PD的相关基因,编码一个由2 527个氨基酸组成的LRRK2蛋白质,含有6个主要功能域。LRRK2突变是常染色体显性遗传性PD最常见的、研究最多的致病基因,对该基因的功能特征、分子机制和调节机制的研究、阐明PD发病机制以及发现新的治疗靶点具有重要意义。由LRRK2引起的PD最主要的特征是路易小体的出现和黑质纹状体DA神经元的缺失。LRRK2基因最常见的突变是在其第41号外显子上的G2019S发生错义突变(即2 019位甘氨酸突变为丝氨酸)[18]。
Saha等[19]利用启动子(Psnb-1)建立了野生型和LRRK2(G2019S)突变的C.elegans模型,其产生过表达的LRRK2蛋白可导致DA能神经元退化伴有DA减少。此外,LRRK2(G2019S)突变型与野生型LRRK2相比,对鱼藤酮敏感性更高。Yao等[20]发现过表达LRRK2(G2019S)导致神经退行性病变,DA运动神经元介导的运动和行为削弱。Liu等[21]发现激酶抑制剂GW5074和索拉非尼可防止C.elegans体内LRRK2蛋白介导的神经退行性变化,出现阳性表型。因此,可以将抑制LRRK2蛋白活性作为治疗PD的切入点。
2.2 化学因素诱导模型 只有10%的PD患者具有基因突变,环境因素在PD的发病中具有重要的作用。通过建立化学因素诱导的PD C.elegans模型,研究环境因素在PD中的作用。主要的化学因素模型有1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)模型、6-羟基多巴胺(6-hydroxydopamine,6-OHDA)模型、重金属Mn2+模型、百草枯模型、鱼藤酮等模型。
2.2.1 MPTP模型 MPTP是一种能通过血脑屏障及细胞膜的脂溶性有机化合物,进入大脑之后,会被神经胶质细胞产生的单胺氧化酶-B代谢成有毒的阳离子即1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium ion,MPP+)。Braungart等[22]研究发现暴露于MPP+的野生型C.elegans,活动度减低,并出现死亡,利用治疗PD的药物左线多巴对C.elegans处理后,损伤减轻。同时证实了MPP+的靶细胞就是DA能神经细胞。该模型可用于PD治疗药物的药效评估。
2.2.2 6-OHDA模型 另一种广泛使用的 C.elegans药理模型是6-OHDA模型。6-OHDA是神经递质DA的羟基化衍生物,可被DA再摄取转运体识别,并诱导选择性DA能神经元变性,表现为特征性突起泡状化、神经元细胞胞体膨胀并最终以非凋亡(或至少不是典型细胞凋亡)方式崩解[23]。Nass等[24]研究表明,C.elegans暴露于6-OHDA后,出现时间和剂量依赖性的神经元退化。6-OHDA被神经元摄取后,导致自由基形成和氧化应激,最后神经元死亡。利用这个模型,研究者们[25]确定了一些能够改变DA神经元对6-OHDA敏感性的基因和药物,确定了一些可以影响6-OHDA毒性的因素,包括DA受体调节、自噬失活等。6-OHDA还能诱导线粒体崩解。
运用基因过表达及基因敲除技术,可以很好地研究各个基因的作用。C.elegans各种模型的汇总见表1、2[6]。

表1 转基因模型
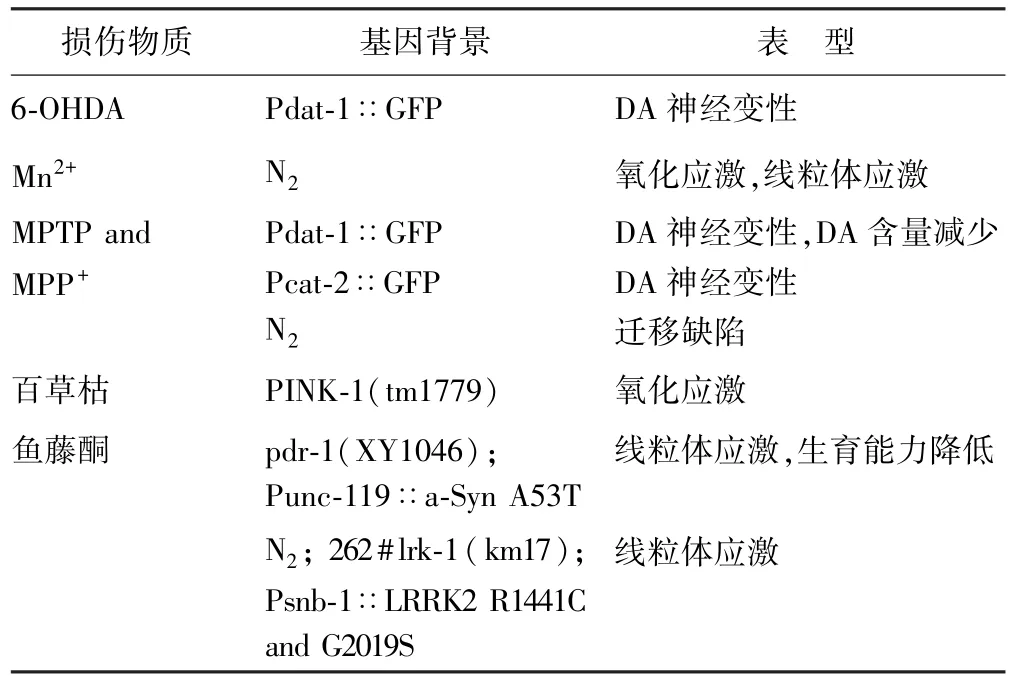
表2 化学因素诱导模型
综上,众多学者结合C.elegans的结构特点,建立了多种模型,在不断发展的新技术基础上,如转基因技术、通过化学诱变和RNA干扰进行正向和反向的遗传基因筛选、高通量小分子筛选系统等,进行PD发病机制的研究,并行大批量药物的筛选。尤其是中药成分复杂,C.elegans是很好的研究模型[26]。
[1]de Rijk MC,Launer LJ,Berger K,et al.Prevalence of Parkinson’s disease in Europe:a collaborative study of population-based cohorts.Neurologic Diseases in the Elderly Research Group[J].Neurology,2000,54(11 Suppl 5):S21-S23.
[2]刘佳,段春礼,杨慧.帕金森病发病机制与治疗研究进展[J].生理科学进展,2015,46(3):163-169.
[3]Brenner S.The Genetics of Caenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[4]艾佳晨,谭正怀.帕金森病非脊椎动物模型研究进展[J].中药药理与临床,2016,32(2):248-251.
[5]许云,阮秦莉,王梦.秀丽隐杆线虫在神经退行性疾病致病机制研究及中药干预作用中的应用[J].上海中医药大学学报,2016,30(4):92-97.
[6]Harrington AJ,Hamamichi S,Caldwell GA,etal.C.elegans as amodel organism to investigatemolecular pathways involved with Parkinson’s disease[J].Dev Dyn,2010,239 (5):1282-1295.
[7]The C.elegans Sequencing Consortium.Genome sequence of the nematode C.elegans:a platform for investigating biology[J].Science,1998,282(5396):2012-2018.
[8]Lakso M,Vartiainen S,Moilanen AM,et al.Dopaminergic neuronal loss and motor deficits in Caenorhabditis elegans overexpressing human alpha-synuclein[J].JNeurochem,2003,86(1):165-172.
[9]Springer W,Hoppe T,Schmidt E,et al.A Caenorhabditis elegans Parkinmutantwith altered solubility couplesα-synuclein aggregation to proteotoxic stress[J].Hum Mol Genet,2005,14(22):3407-3423.
[10]Kuwahara T,Koyama A,Gengyo-Ando K,et al.Familial Parkinsonmutantalpha-synuclein causes dopamine neuron dysfunction in transgenic Caenorhabditis elegans[J].JBiol Chem,2006,281(1):334-340.
[11]Vartiainen S,Pehkonen P,Lakso M,et al.Identification of gene expression changes in transgenic C.elegans overexpressing human alpha-synuclein[J].Neurobiol Dis,2006,22(3):477-486.
[12]Kuwahara T,Koyama A,Koyama S,et al.A systematic RNAi screen reveals involvement of endocytic pathway in neuronal dysfunction in alpha-synuclein transgenic C.elegans[J].Hum Mol Genet,2008,17(19):2997-3009.
[13]Cao P,Yuan Y,Pehek EA,et al.Alpha-synuclein disrupted dopamine homeostasis leads to dopaminergic neuron degenerationin Caenorhabditis elegans[J].PLoSOne,2010,5(2):e9312.
[14]Shukla V,Phulara SC,Yadav D,et al.Iridoid compound 10-O-trans-p-coumaroylcatalpol extends longevity and reduces alpha synuclein aggregation in Caenorhabditis elegans[J].CNSNeurol Disord Drug Targets,2012,11(8):984-992.
[15]Fu RH,Harn HJ,Liu SP,et al.n-butylidenephthalide protects against dopaminergic neuron degeneration andα-synuclein accumulation in Caenorhabditis elegans models of Parkinson’s disease[J].PLoSOne,2014,9(1):e85305.
[16]Johnson WM,Yao C,Siedlak SL,et al.Glutaredoxin deficiency exacerbates neurodegeneration in C.elegans models of Parkinson’s disease[J].Hum Mol Genet,2015,24(5):1322-1335.
[17]Jadiya P,Fatima S,Baghel T,et al.A systematic RNAi screen of neuroprotective genes identifies novelmodulators of alpha-synuclein-associated effects in transgenic Caenorhabditis elegans[J].Mol Neurobiol,2016,53(9):6288-6300.
[18]Di Fonzo A,RohéCF,Ferreira J,et al.A frequent LRRK2 genemutation associated with autosomal dominant Parkinson’s disease[J].Lancet,2005,365(9457):412-415.
[19]Saha S,Guillily MD,Ferree A,et al.LRRK2 modulates vulnerability tomitochondrial dysfunction in Caenorhabditis elegans[J].Neurobiol Disv,2009,29(29):9210-9218.
[20]Yao C,El Khoury R,WangW,et al.LRRK2-mediated neurodegeneration and dysfunction of dopaminergic neurons in a Caenorhabditis elegans model of Parkinson’s disease [J].Neurobiol Dis,2010,40(1):73-81.
[21]Liu Z,Hamamichi S,Lee BD,et al.Inhibitors of LRRK2 kinase attenuate neurodegeneration and Parkinson-like phenotypes in Caenorhabditis elegans and Drosophila Parkinson’s disease models[J].Hum Mol Genet,2011,20 (20):3933-3942.
[22]Braungart E,Gerlach M,Riederer P,et al.Caenorhabditis elegans MPP+model of Parkinson’s disease for high-throughput drug screenings[J].Neurodegener Dis,2004,1(4/ 5):175-183.
[23]王刚,郑静.6-OHDA损毁帕金森大鼠模型和MPTP诱导帕金森小鼠模型的比较[J].南京医科大学学报:自然科学版,2010,30(3):383-419.
[24]Nass R,Hall DH,Miller DM 3rd,etal.Neurotoxin-induced degeneration of dopamine neurons in Caenorhabditis elegans[J].Proc Natl Acad Sci USA,2002,99(5):3264-3269.
[25]Martinez BA,Caldwell KA,Caldwell GA.C.elegans as a model system to accelerate discovery for Parkinson disease [J].Curr Opin Genet Dev,2017,44:102-109.
[26]李玉娟,王香明,王丹巧.人参皂苷Rg1干预线虫帕金森病模型分子机制研究[J].中国药业,2013,22(19):4-7.
Study on the Caenorhabditis elegans model of Parkinson’s disease
ZHAO Yizhou,WANG Xiangming
(Institute of Biophysics,Chinese Academy of Sciences,Beijing 100101,China)
Parkinson’s disease is the second largest neurodegenerative disease,with complex etiology and pathogenesis,which is currently thought to be associated with age,environmental and genetic factors.Caenorhabditis elegans has become an importantmodel of Parkinson’s disease because of its unique physiological structure.In this paper,we reviewed the geneticmodel and chemical factors induced model of Parkinson’s disease in recent years.
Caenorhabditis elegans(C.elegans);Parkinson’s disease(PD)
R742.5
A
2095-3097(2017)04-0248-04
10.3969/j.issn.2095-3097.2017.04.015
2017-06-30 本文编辑:徐海琴)
国家自然科学基金面上项目(31571061)
100101北京,中国科学院生物物理研究所(赵亦周,王香明)

