雷奈酸锶结合钙剂对颈髓损伤合并骨质疏松症影响的临床研究
刘念 尹锐锋 李志安 李雷
郑州大学附属南阳市中心医院骨二科,河南南阳473400
脊髓损伤(SCI)后早期出现明显的骨量丢失和骨转换增加,导致骨质疏松和骨折的发生,特别是在损伤平面以下[1-3]。因此,超过50%的完全性 SCI患者在损伤后1年发生骨质疏松[1],这些受试者的长期总体发生率高达81%[4]。近年来,颈脊髓损伤的发病率也在增加,但是接受抗骨质疏松的治疗患者不足20%[2]。近年来,一种新开发的药物,雷奈酸锶(strontium ranelate,SR)已证明其在降低绝经后骨质疏松症女性的椎体、非椎体和髋部骨折风险中的有效性[5,6],而且SR的这种功效与基线风险因素无关[7],并且可以在 5[8]甚至 8 年[9]期间保持有效性。SR具有双重作用模式,即不仅可以促进成骨作用,同时还能抑制破骨作用[10,11]。鉴于此,我们假设SR可以通过改变人体骨代谢来影响颈脊髓损伤合并骨质疏松症的骨密度,减少颈脊髓损伤合并骨质疏松的骨折发生率,因此,我们设计该研究,探索该方案的可行性。
1 材料和方法
1.1 一般资料
2010年2月至2015年11月,郑州大学附属南阳市中心医院收治的80例颈椎损伤导致颈脊髓损伤合并骨质疏松症患者作为研究对象。患者均符合骨质疏松症的临床诊断标准,均伴不同程度的颈椎节段疼痛的表现,经X线骨密度测定仪监测证实其腰椎骨密度T-Score≤-2.5 SD,生化检查证实碱性磷酸酶、钙、磷值在正常范围内。排除影响骨代谢的内分泌疾病、类风湿性关节炎、长期服用糖皮质激素、孕激素、雄激素、雌激素、异黄酮、双膦酸盐以及降钙素等影响骨代谢药物、严重内分泌、神经系统、心脏以及消化系统疾病、血压>160/95 mmHg(1 mmHg=0.133 kPa)、存在糖尿病史、过敏体质以及对雷奈酸锶等药物过敏患者;排除其他继发性疏松症患者以及严重精神疾病患者。
所有患者入组前3个月内未接受激素及影响骨代谢相关药物治疗。按随机数字表法将其分为治疗组及对照组。治疗组(n=40)中,男性14例,女性26例;年龄22~72岁,平均(47.1±10.6)岁;病程1~3年,平均(1.8±0.9)年;体重指数(23.7±3.8)kg/m2;均为颈椎损伤导致的颈脊髓损伤;美国脊髓损伤协会(ASIA)分级B级27例,C级13例。对照组(n=40)中,男性13例,女性27例;年龄23~73岁,平均(46.7±10.5)岁;病程1~3年,平均(1.9±0.8)年;体重指数(23.5±3.5)kg/m2;均为胸腰椎损伤;ASIA分级B级28例,C级12例;两组患者性别、年龄、病程、损伤部位、体重指数、ASIA分级等基线资料对比差异均无统计学意义(P>0.05)。
1.2 方法
所有患者均口服惠氏制药有限公司碳酸钙D3片(钙尔奇)600 mg×60 s1次1片,1日1~2次及常规康复作为基础治疗;对照组不接受其他任何治疗,治疗组给予欧思美(法国施维亚制药厂)2 g/d,连续口服进行治疗,治疗时间为6个月。
1.3 疗效判定标准
1.3.1 VAS疼痛评分:采用视觉模拟法 (visual analog scale,VAS)观察两组患者治疗前及治疗后1个月及3个月、6个月后两组患者VAS分值,总分为100分,分值越高疼痛程度越高。
1.3.2 BMD值测定:采用Prodigy X线双能骨密度仪(美国GE公司)测定药物治疗前及治疗后3个月、6个月后两组患者L2-4椎体、股骨颈、Wards三角及全髋BMD值,观察对比两种治疗方案对患者骨密度的影响。
1.3.3 骨代谢指标检测:血清1型前胶原N端前肽(P1NP)及1型胶原羧基端降解产物(β-CTX),使用罗氏公司生产的 Elecsys2010型全自动化学发光免疫分析仪,及配套的试剂盒及试剂,严格按照使用说明书对患者血清β-CTX与P1NP水平进行检测。
1.4 统计学处理
采用SPSS 19.0统计学软件处理数据。两组患者治疗不同时间段VAS评分对比采用总体方差分析及SNK两两比较的方法;治疗前后的骨密度和各项骨代谢指标的比较应用配对样本t检验;两组患者之间的相应指标比较应用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 VAS评分
治疗前,两组患者的VAS评分无统计学差异(P>0.05)。通过药物的治疗,每组不同时间段VAS评分均有显著性差异(P<0.05),且随时间增加评分降低。治疗后1、3个月及6个月后治疗组患者VAS评分显著低于对照组(P<0.05),见表1。
表1 两组患者治疗不同时间段VAS评分(±s)Table 1 VAS score of the two groups of patients at different time points(±s)

表1 两组患者治疗不同时间段VAS评分(±s)Table 1 VAS score of the two groups of patients at different time points(±s)
注:与本组治疗前后比较,*P<0.05;与同时间点对照组比较,#P<0.05
个月对照组 6.5±1.8 5.6±1.2* 4.7±0.9* 3.9±0.7组别 治疗前 治疗1个月 治疗3个月 治疗6*治疗组 6.5±1.9 3.5±0.8*# 2.7±0.6*# 1.9±0.4*#
2.2 骨密度
治疗前,两组患者腰椎及股骨颈骨密度无显著性差异(P>0.05)。治疗后,治疗组患者腰椎及股骨颈骨密度均高于治疗前(P<0.05);且治疗组的骨密度显著高于对照组(P<0.05)。见表2。
表2 治疗前后两组患者腰椎及股骨颈骨密度变化对比(g/cm2,±s)Table 2 Changes in bone mineral density of lumbar and femoral neck before and after treatment in the two groups of patients(g/cm2,±s)
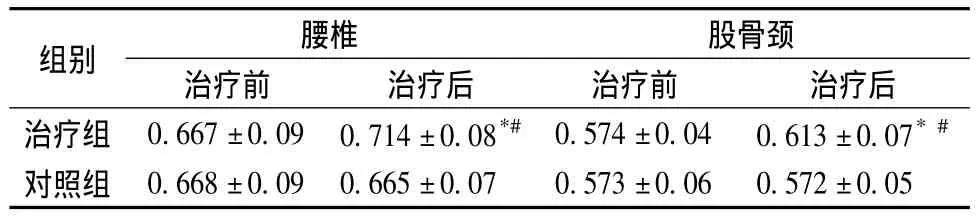
表2 治疗前后两组患者腰椎及股骨颈骨密度变化对比(g/cm2,±s)Table 2 Changes in bone mineral density of lumbar and femoral neck before and after treatment in the two groups of patients(g/cm2,±s)
注:与本组治疗前后比较,*P<0.05;与同时间点对照组比较,#P<0.05
治疗前 治疗后 治疗前 治疗后治疗组 0.667±0.09 0.714±0.08*# 0.574±0.04 0.613±0.07*#组别 腰椎 股骨颈对照组 0.668±0.09 0.665±0.07 0.573±0.06 0.572±0.05
2.3 骨代谢指标
治疗前,两组患者β-CTX及P1NP无显著性差异(P>0.05)。治疗6个月后,治疗组的β-CTX较治疗前明显降低(P<0.05),而P1NP与治疗前相比明显升高(P<0.05);对照组治疗前后的β-CTX及P1NP无显著性差异(P>0.05),见表3。
表3 两组患者治疗前后相关生化指标的变化(±s)Table 3 Changes in biochemical indicators in the two groups of patients before and after treatment of(±s)

表3 两组患者治疗前后相关生化指标的变化(±s)Table 3 Changes in biochemical indicators in the two groups of patients before and after treatment of(±s)
注:与本组治疗前后比较,*P<0.05;与同时间点对照组比较,#P<0.05
治疗前 治疗后 治疗前 治疗后治疗组 0.71±0.05 0.43±0.06*# 22.36±7.92 31.83±7.69*#组别 β-CTX(ng/mL) P1NP(ng/mL)0.71±0.05 0.73±0.08 22.36±7.92 20.34±7.34对照组
3 讨论
本研究选取80例脊髓损伤合并骨质疏松的患者作为研究对象,两组患者均予以钙剂及常规康复治疗作为基础治疗。治疗组使用雷奈酸锶进行治疗,治疗时间为6个月。通过6个月的治疗,观察两组患者在治疗前及治疗后1、3个月及6个月的VAS评分;治疗前及治疗后6个月两组患者腰椎及股骨颈BMD和骨代谢指标β-CTX及P1NP。结果表明治疗组患者的VAS评分及腰椎及股骨颈BMD和骨代谢指标β-CTX及P1NP作用效果明显优于对照组。这些结果表明雷奈酸锶联合钙剂是一种治疗颈脊髓损伤合并骨质疏松合适的方法,可以提高腰椎及髋部骨密度,减低VAS评分,改善骨代谢指标,值得临床使用。
人体骨骼代谢主要有赖于骨的吸收与重塑,使之维持动态平衡,并保持骨骼的质量与形态。脊髓损伤后早期骨骼的组织形态学研究揭示了成骨细胞和破骨细胞活性的增加,迅速的变成到破骨细胞活性的增加和成骨细胞活性的抑制[12]。成骨细胞/破骨细胞功能的这种解偶联在临床上以高钙尿的出现和骨吸收的生物化学标记的大量分泌所证实[13],导致BMD的快速损失和小梁结构的降解,最终替换为脂肪骨髓[14]。正常骨骼的重塑,骨骼重建的量几乎完全被新的骨形成所替代;而脊髓损伤的骨组织,骨组织的代谢平衡被破坏导致骨形成和吸收的解偶联的病理生理情况,其迅速导致严重的骨量丢失。最严重的骨量丢失发生在急性SCI后的最初12~24个月[15]。下肢骨骼的结构和强度的损失使得脊髓损伤患者的骨折风险的明显加大。
以前的多项实验已经证实SR可以通过抑制破骨细胞活性减少骨吸收,刺激成骨细胞活性增加骨形成[16-18]。具体来说,SR可以提高骨源细胞的增殖及复制和成骨细胞活性,包括骨基质合成和碱性磷酸酶的产生,减少骨髓细胞分化时产生的破骨细胞标志物,抑制破骨细胞分化,减弱破骨细胞活性,刺激间叶干细胞及其他组细胞的骨原细胞分化。在体外,它通过增强前成骨细胞复制,分化和活性增加骨形成[16,19]和抑制破骨细胞分化,活性和刺激破骨细胞的细胞凋亡来降低骨吸收[16,20]。在体内,SR 可以完全防止由于卵巢切除对(OVX)大鼠骨微架构和内在骨质量的变化[17]。
本次研究中,我们对80例颈脊髓损伤进行血清β-CTX与P1NP检测,提示颈脊髓损伤药物治疗β-CTX与P1NP发生了改变,由此反映了骨的变化情况。颈脊髓损伤后,血清β-CTX值呈逐渐上升趋势,预示骨吸收转换增加,破骨细胞活动性增强,同时P1NP值呈逐渐下降趋势,预示骨形成转换降低,成骨细胞合成减少。使用SR过后,明显发现P1NP值在上升,而β-CTX在下降,这表明治疗组患者成骨活性增加,破骨受到抑制,而骨密度的上升再次证实了这点,VAS的快速降低和破骨抑制也有一定的联系。
当然,本研究也有其不足之处,首先,患者数量较少,其随访时间较短,适当的增加样本量及延长随访时间很有必要;其次,我们这项研究只在一家医院实行,研究的内容较局限。但是总的来说SR联合钙剂治疗颈脊髓损伤合并骨质疏松是一种切实可行的方法,安全有效,值得临床推广。

