中医不同治法对绝经后骨质疏松症大鼠骨组织Hedgehog信号通路mRNA和蛋白表达的影响
邓洋洋 李佳 孙鑫 蒋宁 郑洪新
辽宁中医药大学,辽宁沈阳110032
骨质疏松症(osteoporosis,OP)是以骨量减少、骨组织微细结构破坏为特征,继而导致骨脆性增加和骨折危险性增高的一种全身性骨骼疾病[1]。该病以腰腿部骨骼疼痛,身高缩短,甚至易发生骨折及脊柱变形为主要临床表现,尤其是在突然活动发力、久坐、久立、久行时更为明显。随着我国老龄社会的加速到来,OP的发生率正逐步上升,已经严重威胁到老年人的生活质量。中医认为骨质疏松症是以肾精亏虚为本,血行瘀滞为标,兼有脾虚气弱的疾病。而骨质疏松症的骨痛多由不荣则痛和不通则痛而导致。此次实验在前期补肾填精法研究的基础上,增立活血化瘀法和补肾活血法,三法比较,观察中医不同治法对原发性骨质疏松症的治疗效果,从而为临床上治疗原发性骨质疏松症提供最佳的中医药治疗方案。
1 材料和方法
1.1 材料
1.1.1 动物:SPF级雌性2~3月龄SD大鼠60只,体重250~270克g,由北京维通利华实验动物技术有限公司提供,动物合格证书号:SCXK(京)2012-0001。
1.1.2 饲养条件:饲养温度为恒温24℃,湿度40%,各组大鼠正常光照(12 h昼/12 h夜),自由进食水,饲料为SPF大小鼠饲料,购于北京科澳协力饲料有限公司。
1.1.3 药物:补肾填精复方为左归丸(熟地、山药、枸杞、山茱萸、川牛膝、菟丝子、鹿胶、龟胶,辽宁中医药大学附属医院);活血化瘀复方为身痛逐瘀汤(秦艽、川芎、桃仁、红花、甘草、羌活、没药、当归、灵脂、香附、川牛膝、地龙,辽宁中医药大学附属医院);补肾活血复方为左归丸与身痛逐瘀汤加减(熟地、菟丝子、鹿胶、龟胶、川芎、桃仁、红花、川牛膝,辽宁中医药大学附属医院);阳性对照药为骨疏康颗粒(辽宁康辰药业有限公司,批号:20100830)。
1.1.4 试剂:大鼠 VEGF ELISA试剂盒(R&D systems)、Trizol(Invitrogen)、逆转录试剂盒(Takara)、荧光定量 PCR 试剂盒(Agilent Technologies)。
1.2 方法
1.2.1 分组:大鼠按体重分层后随机分为6组:正常组、模型组、补肾填精组、活血化瘀组、补肾活血组、阳性对照组,每组10只。
1.2.2 造模:采用一次性手术摘除双侧卵巢造模法。除正常组外,大鼠经氯胺酮(50 mg/mL)肌肉注射麻醉,0.1 mL/100 g体重。麻醉后的大鼠从腰背部脊柱两侧做纵行切口切开皮肤及肌肉,见到呈深粉红色卵巢组织,提起后丝线结扎其周围相连组织,将其完整切除,摘除两侧卵巢组织后逐层缝合,关闭创口。术后给与青霉素肌肉注射,连续注射3 d。
1.2.3 给药;手术后1周开始灌胃给药,每日1次。正常组、模型组给等量生理盐水,补肾填精组、活血化瘀组、补肾活血组、阳性对照组用药量按人体公斤体重(g/kg)每日用药量的6.3倍计算,体积为1 mL/100 g,给药12周。
1.2.4 取材
最后一次灌胃后,禁食24 h,10%水合氯醛注射麻醉(36 mg/kg)后,用碘伏消毒手术部位,开腹,腹主动脉取血,3 000 r/min离心15 min,取血清,取出双肾及股骨,并于高温灭菌EP管中-70℃冰箱保存。
1.2.5 指标与检测:①骨密度测定:取大鼠左后肢股骨,通过双能 X线骨密度分析仪(美国,NORLAND)对大鼠离体股骨进行检测,结果采用单位面积内的骨矿物质含量(g/cm2)表示,应用The Small Subject Scout Scan软件进行数据分析。②血清ALP、TRACP测定:将取材时获得的血清分装,应用多功能酶标仪(型号Infinite M200,瑞士TECAN公司)测定血清ALP、TRACP含量。③骨组织SHH、GLI1蛋白含量测定:将股骨放入约5倍于组织体积量的MSH缓冲液中洗净,晾干、称重后,用剪刀剪碎置入匀浆瓶中;以500 r/min匀浆充分;将匀浆后的组织放入离心管中离心,2 000 r/min,10 min;提取上清液放入高温灭菌EP管中。具体检测步骤按ELISA试剂盒说明书进行。④骨组织 SHH、GLI1mRNA表达测定:定量PCR法测定骨中SHH、GLI1mRNA 相对表达量。使用 Primer-BLAST[2]设计引物,各引物序列见下表1利用测得Ct值计算相对表达量[3]。

表1 各引物序列Table 1 The primer sequences
1.3 统计学处理
采用SPSS19.0软件处理所得数据,选用ONEWay ANOVA进行统计析,数据以均数±标准差(±s)表示。当P<0.05时认为作比较的两组数据在统计学上具有差异。
2 结果
2.1 骨密度及骨代谢变化
2.1.1 各组大鼠股骨骨密度结果(见表2):各组大鼠骨密度结果表示,切除大鼠卵巢13周后,与正常组相比模型组大鼠股骨骨密度显著降低,用药12周后,各用药组均可以提高大鼠股骨骨密度。与模型组相比,差异有统计学意义,其中补肾填精组略高于活血组,补肾活血组和对照药物骨疏康组比较,但差异无统计学意义,说明补肾填精中药复方具有提高去卵巢骨质疏松症模型大鼠骨密度,防止骨质丢失的作用。
表2 各组大鼠股骨骨密度检测结果比较(g/cm2,±s)Table 2 Comparison among the groups on rats’femur BMD test results(g/cm2,±s)
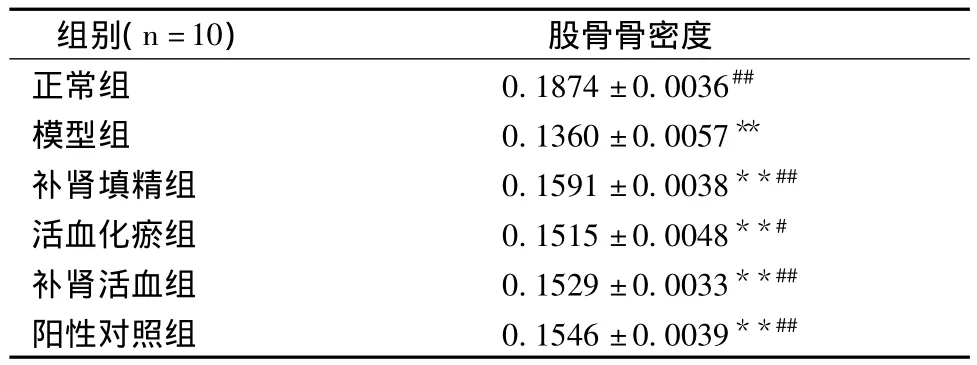
表2 各组大鼠股骨骨密度检测结果比较(g/cm2,±s)Table 2 Comparison among the groups on rats’femur BMD test results(g/cm2,±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
股骨骨密度正常组 0.1874±0.0036组别(n=10)##模型组 0.1360 ±0.0057**补肾填精组 0.1591±0.0038**##活血化瘀组 0.1515±0.0048**#补肾活血组 0.1529±0.0033**##阳性对照组 0.1546±0.0039**##
2.1.2 各组大鼠骨代谢结果(见表3):各组大鼠血清碱性磷酸酶含量测定结果表示,与正常组相比,模型组血清碱性磷酸酶水平显著降低,提示骨形成显著下降,而用药12周后,各用药组可以提高血清碱性磷酸酶水平,促进骨形成。各组大鼠血清抗酒石酸酸性磷酸酶水平测定结果表示,与正常组相比,模型组血清抗酒石酸酸性磷酸酶水平显著升高,提示骨吸收显著升高,而用药12周后,各用药组可以下调抗酒石酸酸性磷酸酶水平,降低骨吸收。
2.2 骨组织SHH以及Gli1 mRNA表达(见表4)
骨组织SHH mRNA相对表达量测定:与正常组比较,模型组大鼠SHH mRNA相对表达量显著降低(P<0.05);与模型组比较,补肾填精组、补肾活血组、阳性对照组大鼠SHH mRNA相对表达量显著升高(P <0.05)。补肾填精组SHH mRNA相对表达量含量显著高于各用药组(P<0.05)。
表3 大鼠血清碱性磷酸酶、抗酒石酸酸性磷酸酶结果比较(±s)Table 3 Comparison among the groups on rats’ALP and TRAP test results(±s)

表3 大鼠血清碱性磷酸酶、抗酒石酸酸性磷酸酶结果比较(±s)Table 3 Comparison among the groups on rats’ALP and TRAP test results(±s)
注:与正常组比较,*P <0.05,**P <0.01;与模型组比较,#P <0.05,##P<0.01;与补肾组比较,▲P <0.05,▲▲P <0.01;与活血组比较,※P<0.05,※※ P<0.01
含量正常组 325.8707±3.4387##▲▲※※ 145.7332±3.5338##▲▲组别(n=10) ALP含量 TRACP模型组 144.1321±2.4134**▲▲ 451.5920±2.6201**▲▲补肾填精组 206.2904±4.3182**##※※ 223.1013±3.2815**##▲▲活血化瘀组 144.2597±3.0048**▲▲ 207.6755±3.5741**##补肾活血组 194.3663±2.1777**##▲▲※※ 210.4100±4.4453**##阳性对照组 208.4726±1.2690**##※※ 197.5354±4.4705**##
骨组织GLI1 mRNA相对表达量测定:与正常组比较,模型组大鼠GLI1 mRNA相对表达量显著降低(P <0.05);与模型组比较,补肾填精组、活血化瘀组、补肾活血组、阳性对照组大鼠GLI1 mRNA相对表达量显著升高(P <0.05)。补肾填精组、活血化瘀组、补肾活血组之间互相比较差异无统计学意义。
表4 大鼠骨SHH以及GLI1 mRNA相对表达量结果(±s)Table 4Rats’bone tissue Gli1 mRNA test results(±s)
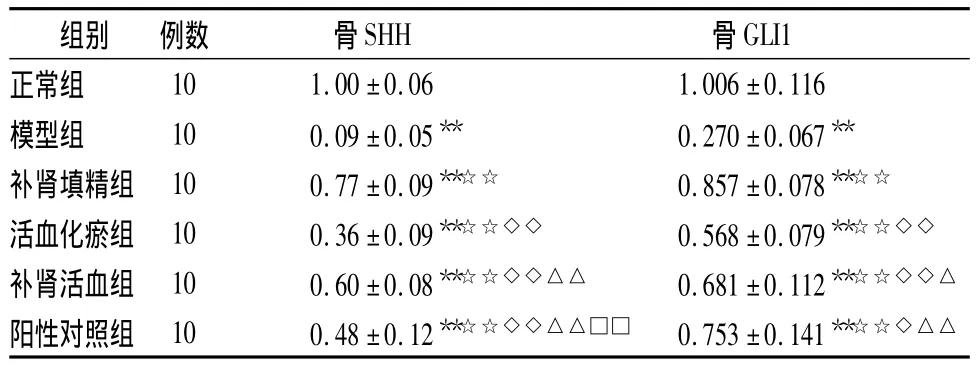
表4 大鼠骨SHH以及GLI1 mRNA相对表达量结果(±s)Table 4Rats’bone tissue Gli1 mRNA test results(±s)
注:与正常组比较,*P<0.05,**P <0.01;与模型组比较,☆P <0.05,☆☆P<0.01;与补肾组比较,◇P <0.05,◇◇P<0.01;与活血逐瘀组比较,△P <0.05,△△P <0.01;与补肾活血组比较,□P <0.05,□□P <0.01
GLI1正常组组别 例数 骨SHH 骨10 1.00 ±0.06 1.006 ±0.116模型组 10 0.09±0.05** 0.270±0.067**补肾填精组 10 0.77±0.09**☆☆ 0.857±0.078**☆☆活血化瘀组 10 0.36±0.09**☆☆◇◇ 0.568±0.079**☆☆◇◇补肾活血组 10 0.60±0.08**☆☆◇◇△△ 0.681±0.112**☆☆◇◇△阳性对照组 10 0.48±0.12**☆☆◇◇△△□□ 0.753±0.141**☆☆◇△△
2.3 骨组织SHH以及GLI1蛋白表达(见表5)
骨组织SHH蛋白含量测定:与正常组比较,模型组大鼠SHH含量显著降低(P<0.05);与模型组比较,补肾填精组、活血化瘀组、补肾活血组、阳性对照组大鼠SHH含量显著升高(P<0.05)。
骨组织GLI1蛋白含量测定:与正常组比较,模型组大鼠GLI1含量显著降低(P <0.05);与模型组比较,补肾填精组、活血化瘀组、补肾活血组、阳性对照组大鼠GLI1含量显著升高(P <0.05)。补肾填精组GLI1含量显著高于活血化瘀组(P <0.05)。
表5 大鼠骨SHH、GLI1蛋白含量结果(±s)Table 5 Rats’bone tissue SHH and GLI1 protein test results(±s)
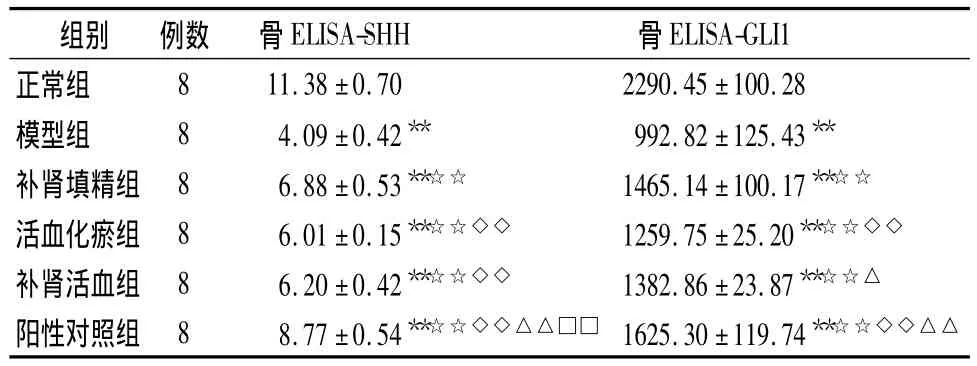
表5 大鼠骨SHH、GLI1蛋白含量结果(±s)Table 5 Rats’bone tissue SHH and GLI1 protein test results(±s)
注:与正常组比较,*P<0.05,**P <0.01;与模型组比较,☆P <0.05,☆☆ P<0.01;与补肾组比较,◇P <0.05,◇◇P <0.01;与活血组比较,△P<0.05,△△P <0.05;补肾活血组比较,□P <0.05,□□P<0.01
ELISA-GLI1正常组组别 例数 骨ELISA-SHH 骨8 11.38 ±0.70 2290.45 ±100.28模型组 8 4.09±0.42** 992.82±125.43**补肾填精组 8 6.88 ±0.53**☆☆ 1465.14 ±100.17**☆☆活血化瘀组 8 6.01±0.15**☆☆◇◇ 1259.75±25.20**☆☆◇◇补肾活血组 8 6.20±0.42**☆☆◇◇ 1382.86±23.87**☆☆△阳性对照组 8 8.77±0.54**☆☆◇◇△△□□ 1625.30±119.74**☆☆◇◇△△
3 讨论
3.1 骨质疏松症的中医病因病机及治法
中医学古典医籍中没有“骨质疏松症”的这一病名的记载,但在《内经》等经典医籍中可以见到与骨质疏松症病理变化及临床表现相似的论述。根据其临床表现,当属中医学“骨痿”、“骨痹”、“骨枯”等范畴,就其临床症状而言主要以骨痛为主,其病机主要与肾精亏虚导致不荣则痛、血行瘀滞导致不通则痛有关。
①肾虚髓减、骨失所养
肾藏精,主生长、发育、生殖,在体合骨,主骨生髓,为先天之本。骨的生长发育都有赖于肾中精气的充盈。清·唐宗海《中西汇通医经精义-脏腑所合》曰:“肾藏精,精生髓,髓生骨,故骨者肾之所合也;髓者,肾精所生,精足则髓足,髓在骨内.髓足者则骨强。”若肾精亏虚,生髓乏源,骨失所养,导致骨代谢异常形成骨质疏松症。宋·窦才《扁鹊心书·骨缩病》曰:“此由肾气疲惫,肾主骨,肾水既涸,则诸骨皆枯,渐至短缩”指出骨痿病因是“肾气衰惫”,症状是“身上缩短”、疼痛,这和骨质疏松症发生之后腰椎发生挤压的症状非常的相似。由此可见,肾虚髓减、骨失所养是骨质疏松症发生的根本。
中医对通过补肾中药治疗骨质疏松症具有很好的效果。本研究团队前期研究结果表明:补肾填精中药能促进骨形成因子、抑制骨吸收因子的活性,其作用机理之一可能是通过调控某些影响骨形成及骨吸收的信号通路和局部细胞生长因子及凋亡基因而达到的[4,5]。
②气血不畅、瘀血阻络
骨痛是骨质疏松症常见的症状。中医认为痛则不通,骨痛是瘀血阻络的主要临床表现之一。由于绝经后妇女脏腑功能衰退,所以多见虚证。又由于其机体功能衰退,体虚气弱,易受外邪侵袭,导致气机不利,气虚无力推动血行脉中,使经络不通、气血不畅,往往伴随血瘀的存在[6]。瘀阻经络、经络不通则出现疼痛、功能障碍。瘀血一旦形成,不但在局部产生疼痛症状,而且使气血运行障碍,营养物质不能濡养脏腑,骨骼失养,脆性增加,加重骨质疏松症。眭承志等[7]对60例绝经后骨质疏松症患者进行研究发现绝经后骨质疏松症存在着血瘀的客观性病理变化,血瘀是引起绝经后骨质疏松症的主要病机之一。
综上所述,骨质疏松症是以肾精亏虚为本,血行瘀滞为标的疾病。而骨质疏松症的骨痛多由不荣则痛和不通则痛而导致。此次本课题在前期补肾填精法研究的基础上,增立活血化瘀法和补肾活血法,三法比较,观察中医不同治法对原发性骨质疏松症的治疗效果,从而为临床上治疗原发性骨质疏松症提供最佳的中医药治疗方案。
本实验采用的补肾活血方剂由熟地、菟丝子、川芎、桃仁、红花、川牛膝、龟胶7味中药组成,方中以熟地为君药,滋补肾阴,填精益髓;桃仁、红花相须为用,活血通经、祛瘀止痛;川芎活血行气、祛风止痛,为血中之气药,走而不守,上行可达巅顶,下行可达血海,适宜各种血瘀病症,三药共为臣药;龟胶滋阴补血、补肾生精益髓;菟丝子、牛膝共归肝、肾两经,补肾活血、强腰膝、健筋骨,共为佐药。诸药合用,共奏补肾活血、填精益髓之功。
3.2 骨代谢与碱性磷酸酶、抗酒石酸酸性磷酸酶
骨质疏松症是以单位体积内骨组织量减少为特点的代谢性骨病变。在人类原发性骨质疏松症中,骨代谢呈高转换型特点,骨吸收强于骨形成的作用。检测骨代谢标志物能够很好的反应骨转化情况,ALP是成骨细胞分泌的一种酶蛋白,是检测成骨细胞分化的特异性指标。ALP在成骨过程中通过去磷酸化,使磷酸根与钙离子结合成磷酸钙矿化物沉积于骨中,有利于骨的形成[8]。血清 TRACP是由破骨细胞分泌的一种活性酶,是骨吸收和破骨细胞活性的标志物,在骨吸收过程中,TRACP与其他酶一起对骨基质中钙磷矿化物降级,在大鼠模型中TRACP表达升高,表现为骨质疏松。
3.3 Hedgehog信号通路与骨代谢
Hedgehog(Hh)基因发现于1980年,Nüsslein-Volhard等在果蝇中发现了一种基因[9],由其突变导致果蝇皮肤外表有着连续的刺猬(hedgehog)样刺状突起,该基因被分离出来后,便被命名为Hedgehog(Hh)基因。以后10年中,包括人类和小鼠在内的许多脊椎动物中与果蝇Hh同源的基因逐渐被分离和鉴定出来[10]。Hh信号通路是调节昆虫和胚胎发育的经典通路之一[11],是一个高度保守的细胞间信号传导系统[12]。Hh通路在动物发育过程中起重要的细胞间通讯作用[13]。
Hedgehog信号通路由 Hh配体,膜蛋白受体复合物Patched、Smo、核转录因子Glis和下游靶基因4部分组成。哺乳动物的 Hh配体包括 sonic Hh(Shh)、desert Hh(Dhh)、indianHh(Ihh)3 种[14]。Hedgehog信号通路在体外能诱导成骨细胞系分化及促进一些间充质细胞向成骨细胞方向发育。体外实验表明Hedgehog和BMP通路协调作用促进成熟成骨细胞的产生[15]。此外,也有研究发现音猬因子(sonic hedgehog,Shh)在Hedgehog家族中表达最广泛,在该信号传导通路上对轴骨、四肢骨、颅面骨等骨骼的形成起着重要作用[16]。
本实验结果表明,骨质疏松症大鼠骨组织中SHH以及GLI1蛋白及mRNA表达量显著降低,提示SHH以及GLI1表达的变化与骨质疏松症的发生密切相关,SHH、GLI1表达降低是骨质疏松症的病理机制之一。运用补肾、活血中药复方干预后,各组SHH、GLI1蛋白含量有不同程度的显著升高,与单纯的活血化瘀法相比较,补肾填精法,补肾活血法效果更好。各干预组SHH、GLI1mRNA表达量亦显著增高,与单纯的活血化瘀法相比较,补肾填精法、补肾活血法效果更好。
综上所述,骨质疏松症的发生可能与Hedgehog信号通路中SHH、GLI1表达降低密切相关,通过补肾填精、补肾活血法提高SHH、GLI1表达水平可能是补肾填精、补肾活血中药复方治疗骨质疏松症的作用机制之一。

