铜与稀硝酸反应实验的探究
樊耀平
【摘要】铜与稀硝酸反应实验的成功与否,对学生学习硝酸的氧化性有着重要的影响。文章从温度、浓度、催化剂多角度探究,完善铜与稀硝酸反应。
【关键词】实验探究;改进
一、实验在教学中的作用和地位
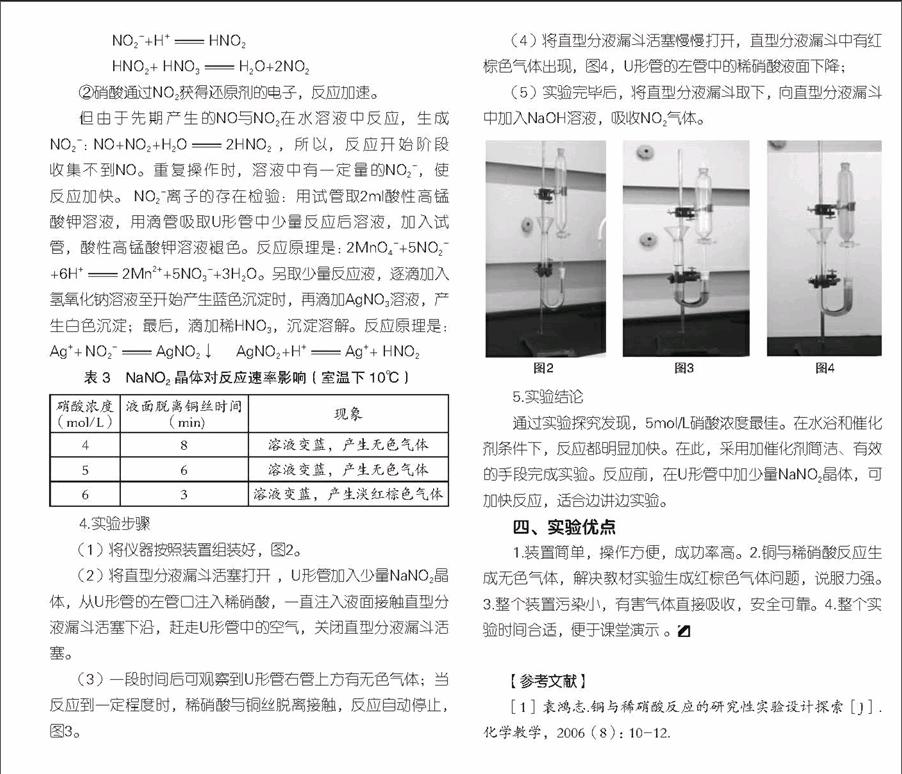
硝酸的强氧化性是中学化学教学的重要内容。浓、稀硝酸与铜的反应也是重要的演示实验,通过演示实验可以形成鲜明的对比,使学生掌握不同浓度的硝酸的强氧化性。苏教版教材采用试管实验,如图1装置。在课后“练习与实践”中,对铜与稀硝酸反应已有初步的改进,但还不够完善,存在大气污染。
二、存在的问题
1.教材中的试管实验,铜和稀硝酸反应,由于试管内存在空气,只能观察到红棕色气体,观察不到无色气体。
2.反应不能自行停止,只能等到硝酸或者铜片反应完,浪费药品。
3.NO,NO2是大气污染物,随意排放不利于师生健康,又污染空气。
三、实验探究
1.实验用品
仪器:U形管、单孔橡皮塞、直型分液漏斗、铁架台、漏斗、注射器、药匙。
药品:稀硝酸、铜丝圈、亚硝酸钠晶体、5%NaOH溶液。
2.实验的反应原理及改进装置
(1)主要反应原理:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
2NO+O2=2NO2
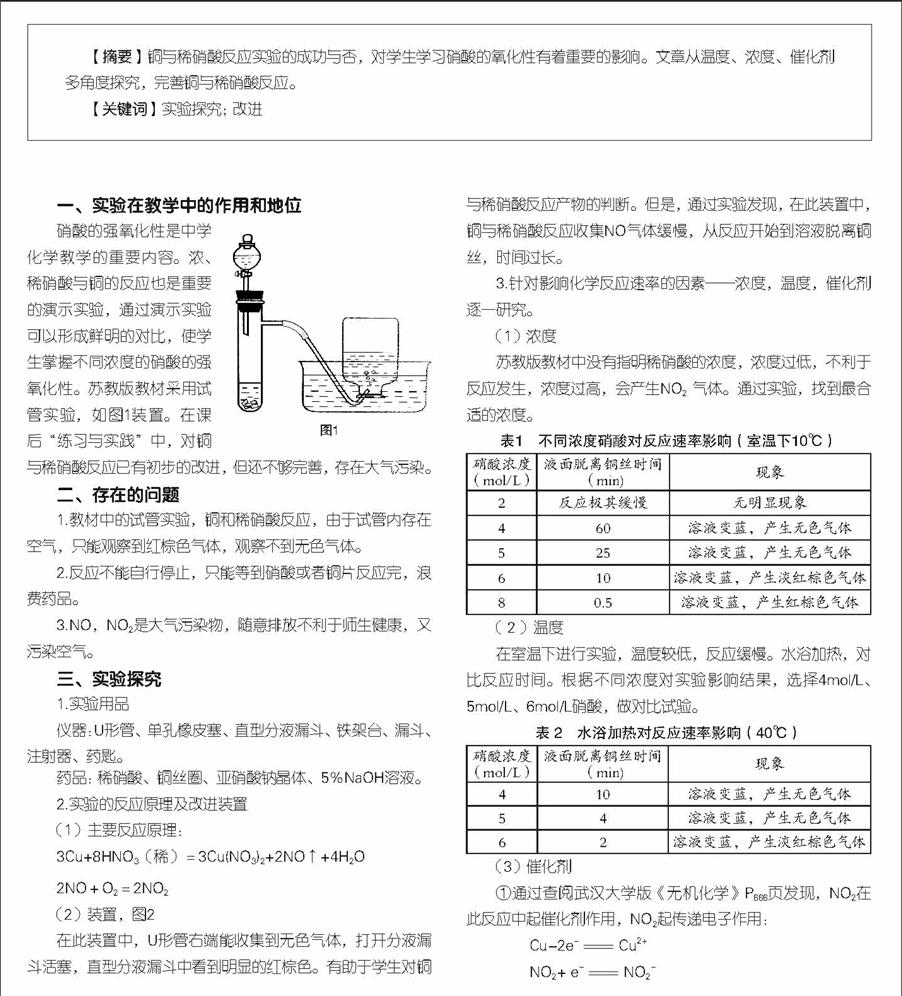
(2)装置,图2
在此装置中,U形管右端能收集到无色气体,打开分液漏斗活塞,直型分液漏斗中看到明显的红棕色。有助于学生对铜与稀硝酸反应产物的判断。但是,通过实验发现,在此装置中,铜与稀硝酸反应收集NO气体缓慢,从反应开始到溶液脱离铜丝,时间过长。
3.针对影响化学反应速率的因素——浓度,温度,催化剂逐一研究。
(1)浓度
苏教版教材中没有指明稀硝酸的浓度,浓度过低,不利于反应发生,濃度过高,会产生NO2 气体。通过实验,找到最合适的浓度。
(2)温度
在室温下进行实验,温度较低,反应缓慢。水浴加热,对比反应时间。根据不同浓度对实验影响结果,选择4mol/L、5mol/L、6mol/L硝酸,做对比试验。
(3)催化剂
①通过查阅武汉大学版《无机化学》P666页发现,NO2在此反应中起催化剂作用,NO2起传递电子作用:
Cu-2e-=Cu2+
NO2+ e-=NO2-
NO2-+H+=HNO2
HNO2+ HNO3=H2O+2NO2
②硝酸通过NO2获得还原剂的电子,反应加速。
但由于先期产生的NO与NO2在水溶液中反应,生成 NO2-:NO+NO2+H2O=2HNO2 ,所以,反应开始阶段收集不到NO。重复操作时,溶液中有一定量的NO2-,使反应加快。 NO2-离子的存在检验:用试管取2ml酸性高锰酸钾溶液,用滴管吸取U形管中少量反应后溶液,加入试管,酸性高锰酸钾溶液褪色。反应原理是:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O。另取少量反应液,逐滴加入氢氧化钠溶液至开始产生蓝色沉淀时,再滴加AgNO3溶液,产生白色沉淀;最后,滴加稀HNO3,沉淀溶解。反应原理是: Ag++ NO2-=AgNO2↓ AgNO2+H+=Ag++ HNO2
4.实验步骤
(1)将仪器按照装置组装好,图2。
(2)将直型分液漏斗活塞打开 ,U形管加入少量NaNO2晶体,从U形管的左管口注入稀硝酸,一直注入液面接触直型分液漏斗活塞下沿,赶走U形管中的空气,关闭直型分液漏斗活塞。
(3)一段时间后可观察到U形管右管上方有无色气体;当反应到一定程度时,稀硝酸与铜丝脱离接触,反应自动停止,图3。
(4)将直型分液漏斗活塞慢慢打开,直型分液漏斗中有红棕色气体出现,图4,U形管的左管中的稀硝酸液面下降;
(5)实验完毕后,将直型分液漏斗取下, 向直型分液漏斗中加入NaOH溶液,吸收NO2气体。
5.实验结论
通过实验探究发现,5mol/L硝酸浓度最佳。在水浴和催化剂条件下,反应都明显加快。在此,采用加催化剂简洁、有效的手段完成实验。反应前,在U形管中加少量NaNO2晶体,可加快反应,适合边讲边实验。
四、实验优点
1.装置简单,操作方便,成功率高。2.铜与稀硝酸反应生成无色气体,解决教材实验生成红棕色气体问题,说服力强。3.整个装置污染小,有害气体直接吸收,安全可靠。4.整个实验时间合适,便于课堂演示 。
【参考文献】
[1]袁鸿志.铜与稀硝酸反应的研究性实验设计探索[J].化学教学,2006(8):10-12.

