12例涎腺肌上皮癌诊断与治疗分析
曹培龙,张少强,赵继元,闫金凤,姚小宝,张鹏飞,刘利锋
1.西安交通大学第一附属医院病理科,陕西 西安 710061;2.西安交通大学第一附属医院耳鼻咽喉头颈外科,陕西 西安 710061
12例涎腺肌上皮癌诊断与治疗分析
曹培龙1,张少强2,赵继元2,闫金凤2,姚小宝2,张鹏飞2,刘利锋2
1.西安交通大学第一附属医院病理科,陕西 西安 710061;2.西安交通大学第一附属医院耳鼻咽喉头颈外科,陕西 西安 710061
背景与目的:涎腺肌上皮癌(myoepithelial carcinoma,MC)是一种罕见的涎腺恶性肿瘤,其诊断及治疗存在争议。该研究旨在探讨涎腺MC的临床表现、病理、免疫组织化学表型及治疗,以期提高该病的诊断和治疗水平。方法:对2010年1月—2016年6月就诊于西安交通大学第一附属医院的12例涎腺MC患者进行分析。平均年龄为(48.9±12.2)岁。采用H-E及免疫组织化学法染色,对组织形态学及免疫组织化学表型进行分析。11例行肿瘤扩大切除术,2例术后辅以放疗;1例未完整切除者,术后给予多西他赛120 mg(第1天)+顺铂40 mg(第1~3天)化疗4个周期。结果:7例发生于腮腺,5例发生于小涎腺。肿瘤直径为2.0~5.0 cm,肿瘤在切面上呈灰白色或灰红色,多无完整包膜,与周围组织分界不清,肿瘤内可有坏死及液化区。涎腺MC组织中透明细胞多见,亦可见上皮细胞、浆细胞样细胞及梭形细胞,细胞异型性明显;4例伴有出血坏死。12例表达CK,7例表达S-100,7例表达EMA,4例表达SMA,8例表达calponin,11例表达p63,5例表达vimentin,9例表达Ki-67。Ki-67增殖指数为2%~40%,平均为15%。随访2~78个月,10例术后患者未见局部复发及远处转移,1例于术后5个月因肾脏透明细胞癌死亡。1例经化疗后3个月死亡。结论:涎腺MC细胞形态多样,病理检查结合CK、p63、Ki-67、S-100、Vim、Calponin、EMA及SMA等免疫指标可提高MC的确诊率。以手术治疗为主,手术应有足够的边界,临床无淋巴结转移者,颈淋巴结清扫术不作为手术必须部分。
肌上皮癌;涎腺;诊断;免疫组织化学;治疗
肌上皮癌(myoepithelial carcinoma,MC)是一种发生于涎腺的较为罕见的恶性肿瘤。涎腺MC多发生于腮腺,小涎腺及腺体外组织亦可发病。1991年,MC首次被世界卫生组织按涎腺肿瘤组织学分类列为一类独立的肿瘤[1]。由于MC罕见,对其诊断、免疫表型和生物学行为的认识还不足。本研究旨在分析MC患者的临床表现、病理特点、免疫表型及治疗效果,以期提高对该病的认识、诊断及治疗水平。
1 资料和方法
1.1 资料
收集西安交通大学第一附属医院2010年1月—2016年6月经病理诊断为涎腺MC的12例患者,均经过2位病理科专科医师诊断。男性6例,女性6例。年龄24~70岁,平均年龄为(48.9±12.2)岁。
1.2 方法
1.2.1 免疫组织化学法检测
标本经4%甲醛溶液固定后,常规石蜡包埋处理,制备4 μm厚切片,常规H-E染色;免疫组织化学染色应用EnVision两步法。一抗试剂均购自福州迈新生物技术开发有限公司,以PBS代替一抗作为阴性对照,阳性对照参考已知的阳性切片。一抗包括CK、S-100、EMA、SMA、calponin、p63、Ki-67和vimentin。
1.2.2 治疗方法
7例发生于腮腺者接受肿瘤+腮腺浅叶切除术,2例接受术后辅以放疗;3例发生于颊部和1例发生于咽部者接受肿瘤扩大切除术;1例位于咽旁,未完整切除,术后给予多西他赛120 mg(第1天)+顺铂40 mg(第1~3天)化疗4个周期。
1.2.3 随访
患者术后开始随访,随访截至2016年7月31日。
2 结 果
2.1 临床特征
7例发生于腮腺,3例发生于颊部小涎腺,2例发生于咽部小涎腺。2例女性为涎腺多形性腺瘤伴肌上皮癌变(表1)。12例患者肿瘤均无肺、肝及骨等组织转移。
2.2 眼观
肿块表现为大小不一的结节,直径为1.0~9.0 cm,平均为3.5 cm,多数无包膜或包膜不完整,和周围组织界限不清,质地中等,呈实性,切面呈灰白或灰粉色,4例标本中可见明显出血及坏死灶。
2.3 镜检
肿瘤细胞呈大小不等实性片状、巢团状或梁索状排列,均呈浸润性生长,间质内可见数量不等的黏液变性,4例癌巢内可见坏死。肿瘤细胞形态多样,7例以透明细胞为主,细胞呈卵圆形或多边形,细胞质丰富、透亮或微嗜酸性,细胞核圆形,位于细胞中央,可见核分裂像,部分巢团周围可见大量嗜酸性玻璃样物质(图1);3例以上皮样细胞为主,细胞异型性明显,呈多边形或圆形,细胞质嗜双色性或嗜酸性,量中等,细胞核居中,核分裂像可见(图2);1例以浆细胞样细胞为主,并混合有上皮样细胞,浆细胞样细胞表现为圆形或卵圆形,细胞质丰富,嗜酸性,细胞核偏位(图3);另1例肿瘤细胞为梭形细胞和上皮样细胞混合,细胞异型性明显,长梭形的梭形细胞呈束状交错排列,上皮样细胞呈小巢团状排列(图4),二者间有移行。12例患者的肿瘤标本中有2例包含良性混合瘤成分,可见腺管样结构、黏液软骨样基质和短梭形肌上皮细胞。
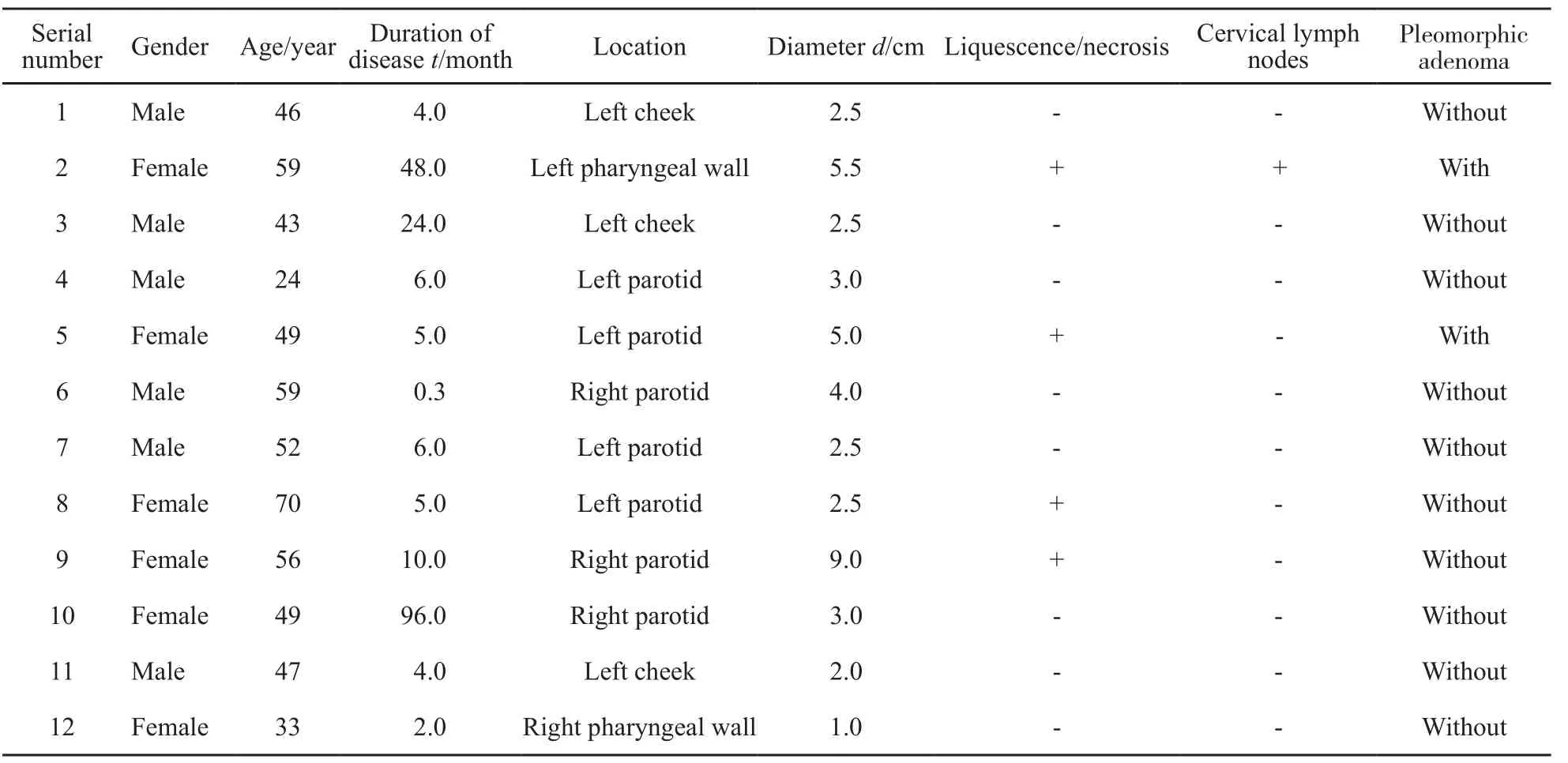
表 1 12例涎腺MC患者一般资料Tab. 1 General characteristic of the 12 cases of MC
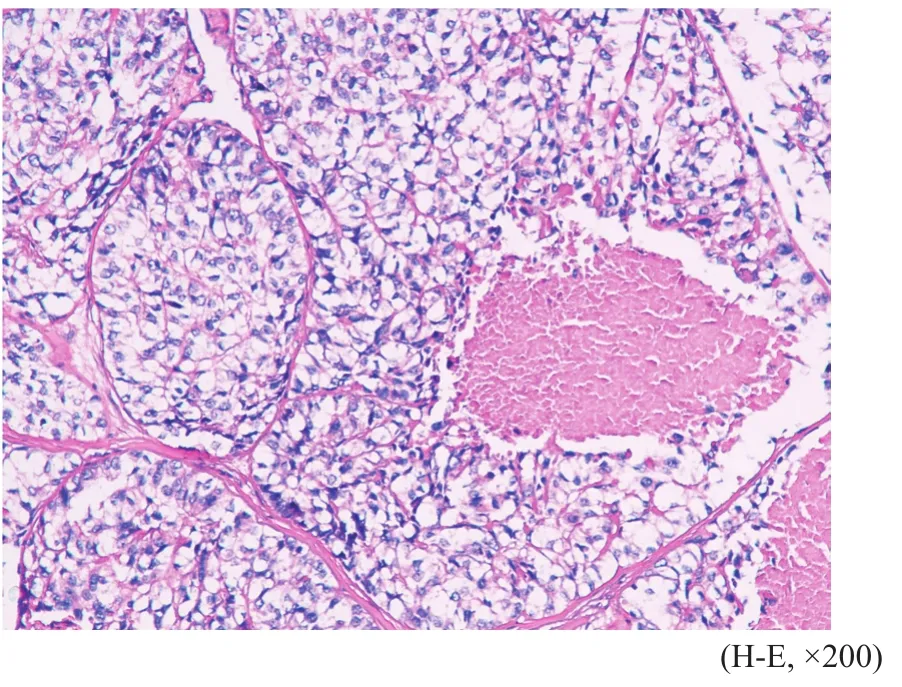
图 1 透明细胞的细胞质丰富透明Fig. 1 Clear cells with abundant hyaline cytoplasm
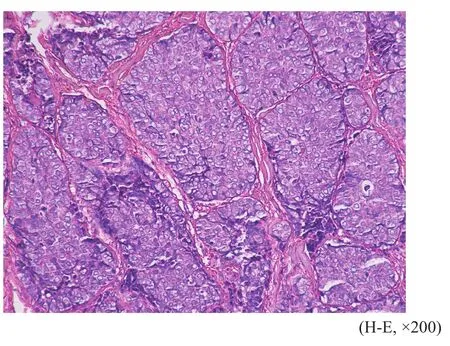
图 2 上皮样细胞呈巢团样排列Fig. 2 Epithelioid cells arranged in nest
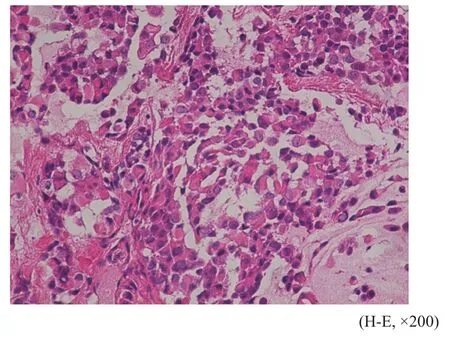
图 3 浆细胞样细胞核偏位Fig. 3 Plasmacytoid cells with o ff set nuclei
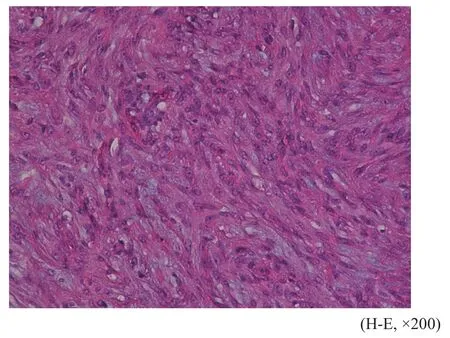
图 4 梭形细胞交错排列Fig. 4 Spindle cells arranged in staggered pattern
2.4 免疫表型
12例均CK表达阳性,7例S-100表达阳性,7例EMA表达阳性,4例SMA表达阳性,8例calponin表达阳性,11例p63表达阳性,5例vimentin表达阳性,9例Ki-67表达阳性,增殖指数为2%~40%,平均为15%(表2)。
2.5 随访
术后平均随访时间为27个月(2~78个月),10例未见局部复发及远处转移,1例经化疗后3个月死亡,1例透明细胞MC患者于术后5个月因肾脏透明细胞癌死亡(表3)。
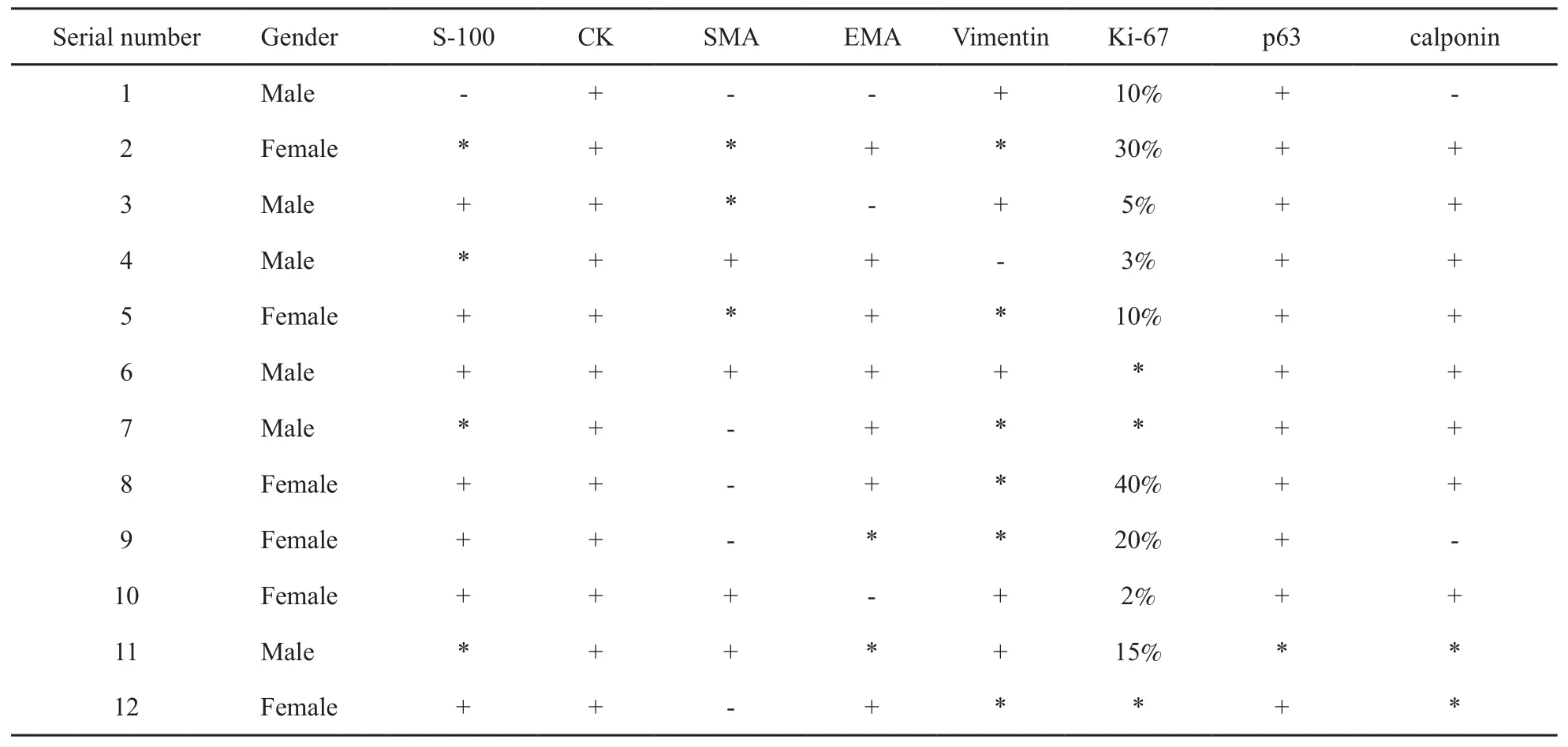
表 2 12例患者免疫组织化学表型表达情况Tab. 2 The expression of immunohistochemical phenotype of the 12 cases
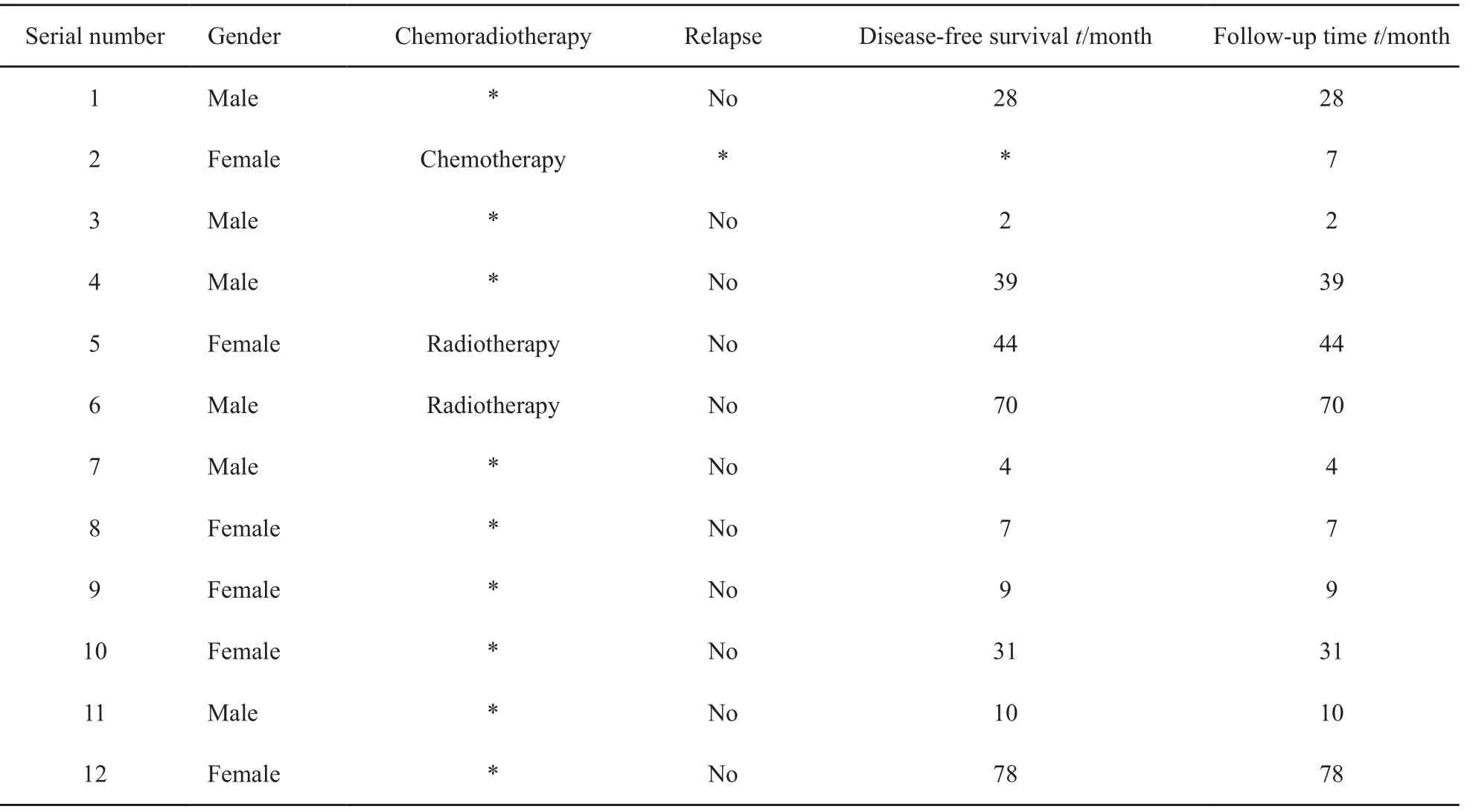
表 3 12例患者随访情况Tab. 3 The following-up of the 12 cases
3 讨 论
涎腺肌上皮瘤约占涎腺肿瘤的1%,MC发病率一般不超过所有涎腺肿瘤的0.5%[2]。除发生于涎腺外,还可见于上腭、颊黏膜、牙龈、磨牙后区、咽部、鼻咽部、口咽、咽旁、喉、鼻腔、上颌窦、泪腺、颞下窝、肺部、气管、皮肤、乳腺及会阴部等部位[3]。MC倾向发生于中、老年人群,通常多见于50岁以上者[3]。有研究显示,涎腺及大涎腺发生MC的平均年龄分别是56和55岁[4-5]。Xiao等[6]的研究显示,涎腺MC发病的平均年龄为61.7岁,男女比例约为1∶1,腮腺是涎腺MC多发部位。本研究结果显示,涎腺MC发病的平均年龄为48.9岁,比相关文献报道的年龄小,这可能与研究对象及样本量有关。本研究中男、女患者数均为6例,7例发生于腮腺,5例发生于小涎腺,腮腺为多发部位,与文献报道一致。
肌上皮细胞是位于基底膜和润管上皮或涎腺腺泡间的一类特殊的细胞群,同时具有肌上皮细胞和上皮细胞的生物学功能。MC的肿瘤细胞形态表现多样,包括梭形细胞、浆细胞样细胞、上皮细胞及透明细胞等,有时也可见多种细胞形态共存[7]。Zhao等[8]认为MC的诊断通常需要具备肿瘤明确表现为恶性和肌上皮来源的唯一性两个基本条件。恶性判断的依据有浸润性、区域坏死及细胞异形性。肿瘤坏死预示患者的无病生存期短[9],缺乏肿瘤坏死的远处转移发生率低[10]。Skelton等[11]认为分化差的涎腺恶性肿瘤有坏死、核多形性和核分裂等恶性表现,但对于分化好的涎腺恶性肿瘤(包括MC和基底细胞腺癌),其缺乏核多形性和坏死。因此,有包膜或神经周围侵犯生长对肿瘤恶性性质的判定非常重要。本研究的12例患者中,肿瘤均呈浸润性生长,多无包膜或包膜不完整,肿瘤细胞多以透明细胞为主,少数以上皮样细胞和梭形细胞为主,细胞异型性明显,细胞核染色质粗,核膜厚,有的患者核仁明显,4例患者伴有坏死,组织学表现与文献报道一致[12]。
由于涎腺肌上皮细胞存在较大的变异性,因此确诊需结合免疫组织化学检查。采用包括S-100蛋白、SMA及vimentin等肌上皮源性标志物进行染色,肿瘤性肌上皮细胞染色阳性。此外,MC对EMA反应阳性,而对MAGE和CEA反应阴性,这些免疫标志物有助于MC的确诊[12]。本研究结果显示,上皮标志物CK和EMA的表达阳性率较高,肌上皮标志物中p63、S100及calponin表达阳性率较高,而SMA表达阳性率较低,因此,在MC免疫诊断中,p63、S100及Calponin等在标志物的诊断灵敏度方面显示出明显优势。Nagao等[13]的研究提示,Ki-67大于10%时可诊断为MC。本研究的9例Ki-67阴性患者中6例指数大于10%,最高可达40%,3例指数为2%~5%,与文献报道有所差别。
MC的典型临床表现是起病隐匿,多表现为无痛性包块,患者就诊时肿块往往已经较大,意味着病史已有数月甚至数年之久,依据肿瘤的发病部位和范围可伴随出现其他症状。疾病早期无明显恶性表现,肿物生长缓慢,质地中等,边界清楚,无明显功能障碍。随着疾病的发展,晚期肿瘤可广泛侵及周围组织或沿神经生长,导致组织器官功能障碍,如面瘫、唇舌麻木、吞咽困难及疼痛等[3]。通常认为,MC复发及向肺、肝及骨等远处转移常见,但局部淋巴结转移少见[11]。颌下腺MC比腮腺MC更易出现局部复发及远处转移,发生颈淋巴结转移的患者比没有发生颈淋巴结转移的患者的生存时间明显缩短[5-6]。
因为MC少见,因此对于该病的治疗没有形成明确的治疗指南。手术是MC主要的治疗手段。考虑到MC局部复发及侵袭生长倾向,手术应尽可能有足够的安全边界。对于肿瘤已经侵犯神经的患者,一般应予以切除[14]。如果有关区域淋巴结转移的信息不足,对于腮腺、颌下腺T3-4N0患者应考虑行选择性颈淋巴结清扫术[3]。对于口腔内小涎腺肿瘤,由于其恶性度低,手术应于正常组织边界行局部扩大切除[15],而对于淋巴结转移概率小的患者不需行颈淋巴结清扫术[3];但对于有颈淋巴结转移临床证据者,则需行颈淋巴结清扫术[16]。刘绍严等[17]认为是否行颈清扫术应当取决于患者术前的影像学资料,若CT或超声检查高度怀疑存在颈部淋巴结转移,则应当行颈淋巴结清扫术;但对于cN0期的患者,则无需行颈淋巴结清扫术。本研究的11例完整切除手术患者均为N0期,未行颈淋巴结清扫术,10例随访至今未发生淋巴结及远处转移。
对于手术边界太近或不完全者考虑放疗[11]。术后放疗适用于高度恶性、肿瘤残留、神经周围侵犯、软组织浸润、淋巴结转移及复发肿瘤的挽救性手术[10]。Yang等[18]的研究显示,对复发性颌下腺MC的治疗,2个周期的顺铂+氟尿嘧啶方案和4个周期顺铂+多柔比星+环磷酰胺方案化疗效果不明显,而复合腺病毒-p53药物联合放疗使病灶明显缩小,5年随访显示肿瘤无复发。Miccio等[19]的研究显示,辅助放疗可以延长Ⅲ、Ⅳ级MC患者的生存期。本研究中2例术后辅以放疗,无局部复发及远处转移发生。1例行多西他赛120 mg(第1天)+顺铂40 mg (第1~3天)化疗4个周期后3个月死亡。本研究中12例患者术后平均随访时间为27个月,10例存活,生存率为83.3%。
综上所述,由于涎腺MC发病率低,目前大规模患者研究较少,对其诊断及治疗尚未形成统一共识。本研究也存在患者数量少的局限性,希望能对涎腺MC的认识、诊断和治疗起到一定的补充作用。
[1] SEIFERT G, BROCHERIOU C, CARDESA A, et al. WHO international histological classification of tumours: tentative histological classification of salivary gland tumours[J]. Pathol Res Pract, 1990, 186(5): 555-581.
[2] 李 栋, 徐国刚, 林彦涛. 颌下腺肌上皮癌一例[J]. 海南医学, 2015, 26(2): 300-301.
[3] VILAR-GONZÁLEZ S, BRADLEY K, RICO-PÉREZ J, et al. Salivary gland myoepithelial carcinoma[J]. Clin Transl Oncol, 2015, 17(11): 847-855.
[4] SAVERA A T, SLOMAN A, HUVOS A G, et al. Myoepithelial carcinoma of the salivary glands: a clinicopathologic study of 25 patients[J].Am J Surg Pathol, 2000, 24(6): 761-774.
[5] SU Y X, ROBERTS D B, HANNA E Y, et al. Risk factors and prognosis for myoepithelial carcinoma of the major salivary glands[J]. Ann Surg Oncol, 2015, 22(11): 3701-3707.
[6] XIAO C C, BAKER A B, WHITE-GILBERTSON S J, et al. Prognostic factors in myoepithelial carcinoma of the major salivary glands[J].Otolaryngol Head Neck Surg, 2016, 154(6): 1047-1053.
[7] SEHGAL S, GOYAL P, SINGH S, et al. Fine-needle aspiration cytology of myoepithelial carcinoma of salivary gland: Diagnostic challenge to cytopathologist[J]. J Cytol, 2013, 30(3): 207-210.
[8] ZHAO F, ZHU H, HUANG Y. Myoepithelial carcinoma inside of maxilla bone: a case report[J]. Mol Clin Oncol, 2013, 1(2): 315-317.
[9] PASSADOR-SANTOS F, GRÖNROOS M, IRISH J, et al. Clinicopathological characteristics and cell cycle proteins as potential prognostic factors in myoepithelial carcinoma of salivary glands[J]. Virchows Arch, 2016, 468(3): 305-312.
[10] KONG M, DRILL E N, MORRIS L, et al. Prognostic factors in myoepithelial carcinoma of salivary glands: a clinicopathologic study of 48 cases[J].Am J Surg Pathol, 2015, 39(7): 931-938.
[11] SKELTON E, JEWISON A C, RAMESAR K, et al. Myoepithelial carcinoma of the parotid: a rare tumour that may provide diagnostic difficulty[J]. BMJ Case Rep, 2015,DOI:10.1136/bcr-2014-206163.
[12] 周 娟, 江 倩, 牛玉明. 颌下腺原发性肌上皮癌 1 例[J].广东医学, 2016, 37(3): 435-435.
[13] NAGAO T, SUGANO I, ISHIDA Y, et al. Salivary gland malignant myoepithelioma: A clinicopathologic and immunohistochemical study of ten cases[J]. Cancer, 1998, 83(7): 1292-1299.
[14] YU G, MA D, SUN K, et al. Myoepithelial carcinoma of the salivary glands: behavior and management[J]. Chin Med J (Engl), 2003, 116(2): 163-165.
[15] YANG S, LI L, ZENG M, et al. Myoepithelial carcinoma of intraoral minor salivary glands: a clinicopathological study of 7 cases and review of the literature[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2010, 110(1): 85-93.
[16] 刘绍严, 倪 松, 朱一鸣, 等. 颌下腺肌上皮癌诊治分析[J]. 中国医刊, 2015, 50(6): 28-29.
[17] 刘绍严, 倪 松, 朱一鸣, 等. 17例腮腺肌上皮癌的诊治分析[J]. 中华肿瘤杂志, 2015, 37(5): 392-394.
[18] YANG L, CHEN X, WANG H, et al. Recurrent myoepithelial carcinoma of the submandibular gland treated by rAd-p53 combined with radiotherapy: a case report[J]. Oncol Lett, 2016, 12(2): 915-917.
[19] MICCIO J A, OLADERU O T, YANG J, et al. Myoepithelial carcinoma: the role of radiation therapy. a case report and analysis of data from the surveillance, epidemiology, and end results (SEER) registry[J]. J Pediatr Hematol Oncol, 2016, 38(4): 274-278.
Diagnosis and treatment analysis of 12 cases of salivary myoepithelial carcinoma
CAO Peilong1, ZHANG Shaoqiang2, ZHAO Jiyuan2, YAN Jinfeng2, YAO Xiaobao2, ZHANG Pengfei2, LIU Lifeng2
(1. Department of Pathology, First Affiliated Hospital of Xi’an Jiao Tong University, Xi’an 710061, Shaanxi Province, China; 2. Department of Otorhinolaryngology and Head-Neck Surgery, First Affiliated Hospital of Xi’an Jiao Tong University, Xi’an 710061, Shaanxi Province, China)
LIU Lifeng E-mail: LLF969@163.com
Background and purpose: Salivary gland myoepithelial carcinoma (MC) is a rare malignant salivary gland neoplasm, and its diagnosis and treatment remain controversial. This study aimed to discuss the clinical features, pathological manifestation, immunohistochemical phenotype and therapy in order to make progress in diagnosis and treatment of salivary gland MC. Methods: The clinical data of 12 cases of salivary gland MC from Jan. 2010 to Jun. 2016 were analyzed. The average age of the 12 cases was (48.9±12.2) years. Microscopic changes were analyzed after the sections were stained with routine H-E and immunohistochemical methods. 11 cases
radical surgery only, and 2 cases received postoperative radiotherapy. One case with incomplete resection was administered with 4 cycles of docetaxel+cisplatin chemotherapy regimen (120 mg docetaxel on day 1 and 40 mg cisplatin on days 1-3, every 28 days). Results: Seven cases occurred in parotid glands and 5 occurred in minor salivary glands. The common size of MC was between 2 and 5 centimeters. Tumors in section appeared off white or grey pink, the capsules were intact, the boundaries were unclear, and necrosis and liquescence existed. Clear cells were predominant in MC, while epithelioid, plasmacytoid, and spindle cells also existed. Cell atypia was obvious and necrosis and liquescence were shown in 4 cases. CK, S-100, EMA, SMA, calponin, p63, Vim and Ki-67 were expressed in 12, 7, 7, 4, 8, 11, 5 and 9 cases, respectively. Ki-67 labelling index was 2%~40%, and 15% was the average. The follow-up time was 2-78 months. Local recurrence and metastasis were not detected in 10 cases whounderwent extended resection, and 1 case died of renal myoepithelial carcinoma 5 months after operation. One case died 3 months after chemotherapy. Conclusion: The histological changes of myoepithelial carcinoma cells are diverse. Pathological methods and the immunohistochemical examination of CK, p63, Ki-67, S-100, Vim, calponin, EMA and SMA are helpful for improving the diagnosis rate. Surgery with tumour-free margins is the main treatment for myoepithelial carcinoma. Neck dissection is not necessary for the cases without local lymphatic metastasis.
Myoepithelial carcinoma; Salivary gland; Diagnosis; Immunohistochemistry; Treatment
10.19401/j.cnki.1007-3639.2017.07.009
R739.87
A
1007-3639(2017)07-0575-06
2017-02-15
2017-04-29)
刘利锋 E-mail: LLF969@163.com

