BRAF和EGFR抑制剂联合用于BRAF突变型复发转移性结直肠癌PDXs模型的研究
王 英,马 晗,李文涛,何新红
复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海200032
BRAF和EGFR抑制剂联合用于BRAF突变型复发转移性结直肠癌PDXs模型的研究
王 英,马 晗,李文涛,何新红
复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:结直肠癌患者中BRAF基因突变的概率为5%~15%,临床预后明显差于无突变者。该研究将BRAF与表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂联合用于BRAF V600E突变型复发转移性结直肠癌的患者来源异种移植(patient-derived xenografts,PDXs)模型,观察其安全性、可行性及疗效。方法:2016年1月—2016年12月,复旦大学附属肿瘤医院34例疑似结直肠癌术后复发或转移的患者利用CT引导下的穿刺活检方法获取组织标本,建立复发转移性结直肠癌的PDXs模型,筛选BRAF突变者传代培养至F2代进行药物实验,实验组分为BRAF抑制剂组(A组)、EGFR抑制剂组(B组)、BRAF和EGFR抑制剂联合组(C组)及安慰剂对照组(D组)。给药3周后处死实验动物,统计建模成功率及抑瘤率。结果:34例患者中共23例病理证实为结直肠癌复发或转移,成功建立16个PDX模型,建模成功率为69.6%(16/23)。共筛选出4例BRAF V600E基因突变者,成功建立4个BRAF突变型复发转移性结直肠癌的PDXs模型。实验组无明显药物毒性相关性死亡,实验组抑瘤率分别为21.57%、21.61%和66.81%,差异有统计学意义(P<0.05)。结论:CT引导下的穿刺活检建立复发转移性结直肠癌的PDXs模型成功率高,针对EGFR和BRAF的双重打击治疗安全、可行,能够明显提高BRAF突变型结直肠癌的疗效。
结直肠癌;复发转移;BRAF突变;患者来源异种移植模型
在全球范围内,结直肠癌是发病率位于第3位、死亡率位于第4位的恶性肿瘤,严重威胁人类健康。结直肠癌中BRAF基因突变的概率为5%~15%[1-3],与高甲基化肿瘤亚型有关,并且有高侵袭性、低分化和治疗耐药等特点[4],临床预后明显差于无突变者。患者来源异种移植(patient-derived xenografts,PDXs)模型是将患者的肿瘤接种到免疫缺陷的小鼠体内用于制作模型,是肿瘤研究的有效工具。本研究基于CT引导下的穿刺活检获取组织标本建立复发转移性结直肠癌的PDXs模型,筛选BRAF V600E突变型进行药物实验,探索BRAF与表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂联合用于BRAF V600E突变型复发转移性结直肠癌的安全性、可行性及疗效,为解决临床治疗难题奠定研究基础。
1 材料和方法
1.1 患者入组与穿刺活检
收集2016年1月—2016年12月复旦大学附属肿瘤医院结直肠癌根治术后影像学提示复发和(或)转移需行穿刺活检明确诊断的患者资料,保留用于常规病理诊断包括基因检测的组织量后,剩余的标本用于PDXs动物模型的建立(表1)。穿刺活检术前每例患者均签署受试者知情同意书,经复旦大学附属肿瘤医院伦理委员会批准通过。
CT引导下同轴套管针(购自美国Argon Medical Devices公司)穿刺活检获取结直肠癌复发或转移灶组织标本,每例患者取材2~3次,最后1次取材后采用明胶海绵封堵穿刺针道,防止出血及针道种植转移。临床病理诊断所需的组织标本保存于4%甲醛溶液中,剩余组织置于含有0.9%NaCl溶液的无菌培养皿中,4 ℃恒温冰箱储存,6 h内完成实验动物接种。

表 1 患者资料Tab. 1 Characteristics of the patient
1.2 建立PDXs模型
实验动物选取雌性BABL/c裸鼠,3~5周龄,体质量约15 g,均购自上海斯莱克实验动物有限责任公司,饲养于华中师范大学脑功能研究所无特定病原体动物房。
固定裸鼠,暴露腹侧,以75%乙醇消毒右前肢腋下周围皮肤,无菌镊夹取组织标本装入套管针鞘,轻轻牵拉皮肤,同轴套管针刺入皮下,轻推针芯将组织推至腋下血供丰富处,退出套管针,消毒穿刺点。每3 d观测肿瘤生长情况,接种部位发现明显肿瘤生长为接种成功(F0代),超过2个月仍未发现接种部位有肿瘤生长为接种失败。按照V=1/2×长×宽2计算肿瘤体积,当肿瘤体积达到150 mm3左右时,颈椎脱臼法处死实验动物,取出肿瘤组织,留取1/5液氮冻存,1/5用于送病理检测,剩余用于传代至F2代。选择BRAF基因突变者用于本实验药物研究。记录实验动物生长情况和肿瘤生长曲线。
1.3 分组与给药
4例BRAF基因突变者传至F2代时各有20只裸鼠。实验组分为BRAF抑制剂组(A组)、EGFR抑制剂组(B组)、BRAF和EGFR抑制剂联合组(C组)及安慰剂对照组(D组)。A组:维罗菲尼25 mg/kg,灌胃,每天1次;B组:西妥昔单抗20 mg/kg,尾静脉注射,每周2次;C组:维罗菲尼25 mg/kg,灌胃,每天1次,联合西妥昔单抗20 mg/kg,尾静脉注射,每周2次;D组:安慰剂(0.9%NaCl溶液)10 mL/kg,尾静脉注射,每天1次。各组给药情况见表2。
每3天观察裸鼠状态,以游标卡尺测量肿瘤大小、计算肿瘤体积,电子秤测量并记录裸鼠体质量。当肿瘤体积达到80~100 mm3开始给药,开始用药后3周为实验终点。到达实验终点后,杀死小鼠,剥离肿瘤,计算抑瘤率,评价各组疗效。抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积×100%。当每个治疗组(n=5)至少有一半裸鼠存活至实验终点时,认为结果是可解释的、可接受的。
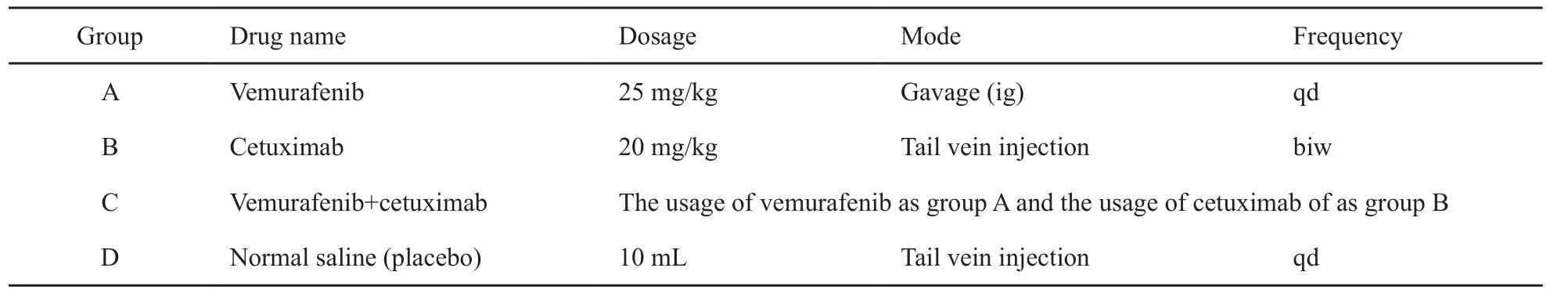
表 2 实验动物分组与给药Tab. 2 Grouping and drug administration of the experimental animal
1.4 统计学处理
2 结 果
2.1 患者情况
本研究共入组34例患者,穿刺活检术后均未出现严重并发症。男性25例,女性9例;年龄29~81岁,平均(59±9.8)岁。原发肿瘤直肠癌20例,结肠癌14例。穿刺取材部位盆腔15例,肝脏12例,肺5例,椎体1例,髂骨1例。23例病理证实为结直肠癌根治术后复发或转移,基因检测发现BARF突变型4例、野生型19例。
2.2 PDXs肿瘤生长及建模情况
PDXs原代模型接种成功者可于15~30 d内在接种部位触及明显结节,质硬、活动度差。2~3个月肿瘤体积可以达到传代要求。肿瘤传代后生长速度明显快于上一代。
本研究中23位患者成功建立16个PDXs模型,建模成功率为69.6%(16/23)。基因检测发现BARF突变型4例,均成功建立PDXs模型。BARF野生型肿瘤生长较快、不均质,传代时可见瘤块内坏死组织较多、质地疏松;BARF突变型肿瘤生长较慢,肿瘤内部坏死少、均质、致密,呈鱼肉样(图1)。
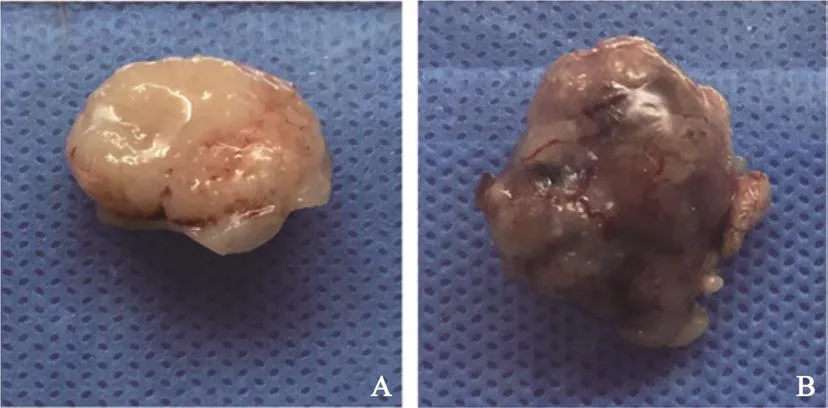
图 1 BRAF突变型和野生型复发转移性结直肠癌肿瘤组织标本Fig. 1 The tumor specimen of BRAF mutant and wild recurrent and metastatic colorectal cancer
2.3 实验动物一般情况
各组均有一半以上的小鼠存活至实验终点。各组体质量变化差异无统计学意义(P>0.05)。在达到实验终点前,A组有2只裸鼠死亡,B组1只裸鼠死亡,C组1只裸鼠死亡,D组1只裸鼠死亡。其余实验动物均于实验终点时间处死。
2.4 肿瘤体积变化与疗效评估
按照公式V=1/2×长×宽2计算肿瘤体积。实验过程中,D组肿瘤体积持续增大,第15天开始肿瘤体积增长明显加快,给药后A、B组肿瘤体积增长减缓,体积大小与D组差异有统计学意义(P<0.05),但A、B组间差异无统计学意义(P>0.05),C组给药后第15天肿瘤体积开始缩小,体积大小与各组差异均有统计学意义(P<0.05,图2)。实验终点时各组肿瘤平均体积为753.03、752.60、318.59和960.12 mm3,实验组抑瘤率分别为21.57%、21.61%和66.81%。
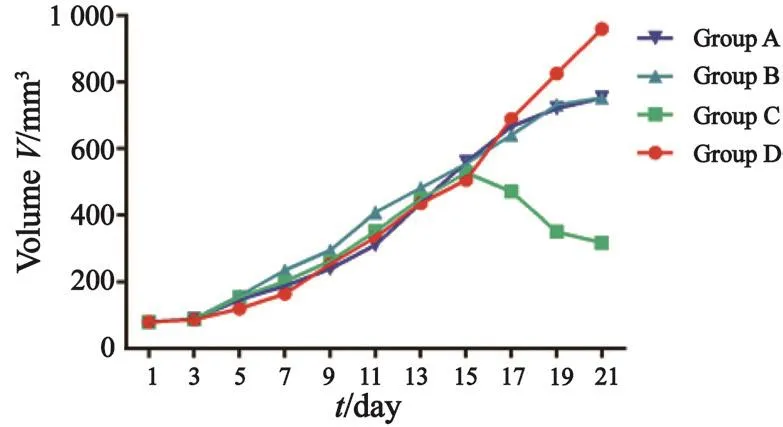
图 2 各组分别处理后3周内的肿瘤体积变化Fig. 2 The tumor volume of each group during 3 weeks after respective treatment
3 讨 论
与无突变的结直肠癌相比,BRAF突变型结直肠癌患者的年龄偏大[5],女性居多[3,6],微卫星不稳定可能性大、组织级别高,淋巴结转移率和局部晚期发生率高,总生存期短,尤其在高微卫星不稳定者[7]。本研究发现,BRAF野生型肿瘤生长较快、不均质,传代时可见瘤块内坏死组织较多、质地疏松;BRAF突变型肿瘤生长较慢,肿瘤内部坏死少、均质、致密,呈鱼肉样。这种现象一定程度上从形态学角度解释了BRAF突变型结直肠癌侵袭性高、治疗不敏感及易耐药的特点,但具体机制还有待进一步研究。
BRAF突变型转移性结直肠癌患者对EGFR靶向抑制剂帕尼单抗和西妥昔单抗敏感性较差,且预后不良,中位生存期仅为6~9个月[8]。而BRAF V600E突变型肿瘤对BRAF靶向治疗的响应率也不尽相同[9]。在BRAF突变型黑色素瘤中单独靶向抑制BRAF或联合其下游效应器MEK抑制剂可获得高达80%的响应率[10-11]。携带BRAF突变的黑色素瘤对维罗非尼的响应率为60%[12]。然而,转移性结直肠癌患者的Ⅰ期临床研究显示,BRAF抑制剂维罗非尼单药治疗时无临床获益[1]。
Prahallad等[13]研究发现,EGFR的阻断与BRAF V600E抑制剂有着很强的协同作用。机制上,BRAF V600E抑制剂会引起EGFR的快速反馈活化,导致其在BRAF V600E抑制剂的存在下持续增殖。而黑色素瘤细胞表达低水平的EGFR,因此不受这种反馈激活。
在本研究中,西妥昔单抗和维罗菲尼的联合疗效很好,90%以上的裸鼠肿瘤呈现了消退。维罗菲尼单药应用时,初期疗效甚至优于西妥昔单抗单药组和两药联用组,而随着用药时间的延长,疗效则逐渐减弱。该结果与我们的设想一致,突变的BRAF基因会影响抗EGFR治疗,而抑制了BRAF的突变后,EGFR抑制剂恢复其响应率。本实验为联合BRAF和EGFR抑制剂治疗这类肿瘤的可行性提供了基础研究依据,进一步的信号通路研究有待继续开展。
PDXs模型是基于未经筛选和未经培养的患者肿瘤标本所建立的,拥有与患者相同的遗传背景和组织形态学特征。已有研究证实,PDXs具有相对稳定的基因组,基于PDXs施行的疗效研究可以更真实的反映患者肿瘤的药物反应,患者和PDXs的反应有极高的一致性[14]。PDXs另一个显著的特征是可基于一个患者发展出许多相同的PDXs,可为靶向治疗和化疗的筛选提供便利,不论是单一药物或是药物组合,均可筛选出最有效的药物。临床上由于预期寿命和不良反应限制,仅允许有限的几个不同药物在患者身上尝试。因此,在最初的几次尝试中选择最有效的治疗方法在癌症治疗中至关重要。PDXs可将相同的肿瘤复制到大量的小鼠体内,为测试治疗靶点的潜在效能提供动物模型,不论是单药还是药物组合,均可同时进行。
复发转移性结直肠癌比原发灶具有更高的侵袭性和异质性,其主要治疗方式是辅助性化疗联合分子靶向治疗,大部分患者不具备手术切除的条件,因此,无法从这部分患者中获取肿瘤标本用于建立PDXs模型。由于这些患者在原发灶术后均接受过一定程度的化疗,有一定的化疗耐药性,而分子靶向治疗费用高昂且响应率较低[15]。同时,由于个体间差异,无论是传统化疗药物还是靶向药对患者的疗效都不尽相同,导致复发转移性结直肠癌患者的生存期望较低。这部分患者需要更为精准、更个性化的治疗方案,在筛选这些治疗方案的过程中PDXs肿瘤模型可发挥巨大的作用。在以往的研究中,由于取材困难,复发转移性结直肠癌PDXs难以成型,无法满足基础研究和临床的需求。本研究首次采用CT引导下的穿刺活检取材建立复发转移性结直肠癌的PDXs模型,其适应证广泛、风险低,解决了这一难题。
PDXs也有许多缺点不能忽视[16],如PDXs无法代表患者群体特征,PDXs的建模时间长使PDXs更多应用于实验研究而不是临床,尤其在那些疾病进展快、生存期短的肿瘤中,如非小细胞肺癌和胰腺癌[17-18]等。有关BRAF突变型结直肠癌的研究众多,但目前还未转化成实际的临床获益。挖掘BRAF突变的价值,探索相关耐药机制及信号通路仍需进一步开展。
[1] KOPETZ S, DESAI J, CHAN E, et al. Phase Ⅱ pilot study of vemurafenib in patients with metastatic BRAF-mutated colorectal cancer [J]. J Clin Oncol, 2015, 33(34): 4032-4038.
[2] DAVIES H, BIGNELL G R, COX C, et al. Mutations of the BRAF gene in human cancer [J]. Nature, 2002, 417(6892): 949-954.
[3] 朱晓丽, 蔡 旭, 张 玲, 等. 中国结直肠癌患者中KRAS与BRAF基因突变特征及其临床病理相关性[J]. 中华病理学杂志, 2012, 41(9): 584-589.
[4] The Cancer Genome Atlas Network. Comprehensive molecular characterization of human cancer[J]. Nature, 2002, 487(7407): 330-337.
[5] SAMOWITZ W S, SWEENEY C, HERRICK J, et al. Poor survival associated with the BRAF V600E mutation in microsatellite-stable colon cancers [J]. Cancer Res, 2005, 65(14): 6063-6069.
[6] GONSALVES W I, MAHONEY M R, SARGENT D J, et al. Patient and tumor characteristics and BRAF and KRAS mutations in colon cancer, NCCTG/Alliance N0147 [J]. J Natl Cancer Inst, 2014, 106(7): dju106.
[7] JANG M H, KIM S, HWANG D Y, et al. BRAF-mutated colorectal cancer exhibits distinct clinicopathological features from wild-type BRAF-expressing cancer independent of the microsatellite instability status[J]. J Korean Med Sci, 2017, 32(1): 38-46.
[8] DI NICOLANTONIO F, MARTINI M, MOLINARI F, et al. Wild-type BRAF is required for response to panitumumabor cetuximab in metastatic colorectal cancer [J]. J Clin Oncol, 2008, 26(35): 5705-5712.
[9] HYMAN D M, PUZANOV I, SUBBIAH V, et al. Vemurafenib in multiple nonmelanomacancers with BRAF V600 mutations[J]. N Engl J Med, 2015, 373(8): 726-736.
[10] FLAHERTY K T, PUZANOV I, KIM K B, et al. Inhibition of mutated, activated BRAF in metastatic melanoma [J]. N Engl J Med, 2010, 363(9): 809-819.
[11] LONG G V, STROYAKOVSKIY D, GOGAS H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma [J]. N Engl J Med, 2014, 371(20): 1877-1888.
[12] PAO W, MILLER V A, POLITI K A, et al. Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain [J]. PLoS Med, 2005, 2(3): e73.
[13] PRAHALLAD A, SUN C, HUANG S, et al. Unresponsiveness of colon cancer to BRAF (V600E) inhibition through feedback activation of EGFR [J]. Nature, 2012, 483(7387): 100-103.[14] ZHANG X M, CLAERHOUT S, PAATT A, et al. A renewable tissue resource of phenotypically stable, biologically and ethnically diverse, patient-derived human breast cancer xenograft models [J]. Cancer Res, 2013, 73(15): 4885-4897.
[15] SIA D, MOEINI A, LABGAA I, et al. The future of patientderived tumor xenografts in cancer treatment [J]. Pharmacogenomics, 2015, 16(14): 1671-1683.
[16] HIDALGO M, BRUCKHEIMER E, RAJESHKUNAR N V, et al. A pilot clinical study of treatment guided by personalized tumorgrafts in patient with advanced cancer [J]. Mol Cancer Ther, 2011, 10(8): 1311-1316.
[17] TENTLER J J, TAN A C, WEEKES C D, et al. Patient-derived tumour xenografts as models for oncology drug development[J]. Nat Rev Clin Oncol, 2012, 9(6): 338-350.
[18] SIOLAS D, HANNON G J. Patient-derived tumor xenografts: transforming clinical samples into mouse models [J]. Cancer Res, 2013, 73(17): 5315-5319.
BRAF inhibitor combined with EGFR inhibitor for PDXs model of BRAF mutant recurrent and metastatic colorectal cancer
WANG Ying, MA Han, LI Wentao, HE Xinhong
(Department of Interventional Radiology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
HE Xinhong E-mail: hxhdoct@hotmail.com
Background and purpose: The incidence of BRAF mutation ranged from 5% to 15% among colorectal cancer according to previous studies, and was associated with poor survival. To evaluate safety, feasibilityand efficiency of BRAF inhibitor combined with epidermal growth factor receptor (EGFR) inhibitor for patient-derived xenografts (PDXs) of BRAF mutant recurrent and metastatic colorectal cancer. Methods: From Jan. 2016 to Dec. 2016, a total of 34 colorectal cancer patients were performed CT guided biopsy because of recurrence or metastasis indicated by image examination. PDXs models of recurrent and metastatic colorectal cancer were established by biopsy specimen. Screened the BRAF V600E mutant and cultivated to F2 generation for drug administration. The experimental group: BRAF inhibitor (Group A), EGFR inhibitor (Group B), BRAF and EGFR inhibitor (Group C). The control group: placebo (Group D). After three weeks, the efficiency was evaluated by tumor inhibition rate. Results: Twenty-three of the patients were con firmed recurrence or metastasis by pathology. Sixteen PDXs models were established, with success rate of 69.6% (16/23). Four BRAF V600E mutant patients were screened and PDXs models were established. There was no obvious drug toxicity related death in experimental group. The tumor inhibition rate of experimental group was21.57%、21.61% and 66.81%, respectively. Group C had the most signi ficant reduction of tumor volume (P<0.05). Conclusion: Combination of BRAF and EGFR inhibitor had high safety, feasibility and efficiency in PDXs of BRAF mutant recurrent and metastatic colorectal cancer.
Colorectal cancer; Recurrence and metastasis; BRAF mutation, Patient-derived xenografts model
10.19401/j.cnki.1007-3639.2017.07.003
R735.3+4
A
1007-3639(2017)07-0533-05
2017-03-25
2017-06-18)
国家重点研发计划(2016YFC0106203)。
何新红 E-mail: hxhdoct@hotmail.com

