ING4和CD34蛋白在人前列腺癌组织中的表达及其相关性研究*
夏中友张宗平李云祥张萌伍季**
1.南充市中心医院,川北医学院第二临床学院泌尿外科(四川南充 637000);2. 川北医学院
ING4和CD34蛋白在人前列腺癌组织中的表达及其相关性研究*
夏中友1张宗平1李云祥1张萌2伍季1**
1.南充市中心医院,川北医学院第二临床学院泌尿外科(四川南充 637000);2. 川北医学院
目的 探讨ING4及CD34蛋白在人前列腺癌组织中的表达及相关性。方法 采用免疫组织化学ElivsionTM Plus二步法检测28例人前列腺癌及32例良性前列腺增生组织中ING4及CD34的表达情况,分析其结果与前列腺癌病理分级及危险等级关系。结果 ING4基因蛋白在人前列腺癌组织中的阳性表达率明显低于良性前列腺增生组织,且随肿瘤病理分级、PSA及临床分期的增加而降低。而CD34标记的微血管密度(microvessle density,MVD)在前列腺癌组织中表达明显较良性前列腺增生组织高,其MVD值随肿瘤病理分级及危险等级增加而升高。前列腺癌组织中ING4表达与MVD值呈负相关,r值为-0.827,相关性具有统计学意义(P<0.05)。结论 ING4基因蛋白在人前列腺癌组织表达异常,可能参与了肿瘤的发生及进展,同时可以作为前列腺癌临床评价诊断、指导治疗的辅助指标之一。
ING4; CD34; 前列腺癌; 免疫组织化学
ING4(inhibitor of growth family memember 4)基因作为ING家族(inhibitor of growth family)的新成员,已被认为是一种II型肿瘤抑制因子。ING4的C端与其他ING成员具有高度的同源性,具有一个核定位信号序列(nuclear localization sequence,NLS)及一个植物同源结构域(planthomeodomain,PHD)[1]。ING4参与基因的调节、细胞循环的调控及血管生成,从而抑制肿瘤细胞的生长及侵袭。研究表明MVD为评价实体肿瘤血管生成的金标准, CD34的阳性率高、表达强,其敏感性和稳定性最好,可作为检测MVD的首选标记物。本实验采用免疫组化检测前列腺癌组织中ING4蛋白的表达及CD34标记的MVD,并结合两者的相关数据探讨其在前列腺肿瘤发生发展中的相关性。
材料及方法
一、临床资料
(一)实验组
选择南充市中心医院(川北医学院第二临床学院)病理科2012年1月至2014年12月经尿道前列腺切除术(TURP)并有完整临床资料的石蜡标本,包括前列腺癌28例,年龄在59~86岁,平均为72岁。按照Gleason评分系统的前列腺癌病理分级,中分化(Gleason 5~6分)3例,低分化(Gleason 7~10分)25例。根据2014年中国泌尿外科指南中前列腺危险因素等级将前列腺癌分为低危(Gleason评分≤6分、PSA<10ng/mL、≤T2a期)、中危(Gleason评分7分、PSA 10~20ng/mL、T2b期)及高危(Gleason评分≥8分、PSA>20ng/mL、≥T2c期),其中低危组3例、中危组6例、高危组19例。
(二)对照组
良性前列腺增生(benign prostatic hyperplasia, BPH)蜡块标本32例,年龄在59~88岁,平均为73岁。
二、主要试剂
鼠抗人ING4蛋白多克隆抗体(美国Abcam公司)稀释浓度为l:150;鼠抗人CD34单克隆抗体(福州迈新生物技术开发公司);鼠兔通用即用型MaxvisionTm二抗及DAB显色试剂(福州迈新生物技术开发公司)。
三、方法
(一)切片制备
4μm切片,用于免疫组织化学显色。将切片置于病理组织漂烘仪50℃烘干。
(二)免疫染色
经脱蜡、水化、抗原修复,余下步骤按EliVisionTMplus两步法试剂盒操作。用已知正常睾丸组织阳性切片作阳性对照,用PBS代替一抗作阴性对照。
四、结果判定
(一)观察者要求
要求观察者在临床和病理资料不知晓的情况下进行观察,两位观察者重复观察同一张病理切片进行结果判定。
(二)ING4阳性染色结果
ING4 阳性表达以细胞核和(或)细胞质内出现棕黄色颗粒为准;使用半定量的评分系统来评估抗体的染色效果,计数 5 个高倍视野或 500 个细胞。按染色强度计分:0 分为无色,1 分为淡黄色,2 分为棕黄色,3 分为棕褐色;按阳性细胞所占百分比计分:0 分为阴性,1分为阳性细胞数 ≤10% ,2 分为阳性细胞数 11%~50% ,3分为阳性细胞数 51%~75%,4分为阳性胞数>75% ;染色强度计分与阳性细胞所占百分比计分乘积:0~2 分为(-),3~5 分为(+),6 ~9分为(+ +),10~12分为(+ + +)。
(三)CD34阳性染色结果
CD34抗体染色微血管密度(MVD)计数标准:以与背景有明显区别的任何一个棕色染色内皮细胞或细胞丛计数为一个血管,只要结构不相连续,分支结构也可计数为1个血管。首先在×100光镜下寻找肿瘤组织中血管密度最高的区域,然后在×200光镜下计数4个视野的微血管数,求其平均值作为该区域平均微血管数。将CD34标记的MVD值均数90界定为区分MVD高低的标准。
五、统计分析
用SPSS13.0软件进行统计分析,P<0.05具有统计学意义,P<0.01具有显著意义。计数资料采用x2检验;计量资料以±s表示,用t检验;各阳性指标的相关性分析采用用Spearman等级相关分析。
结果
一、ING4在BPH及PCaa组织中的表达
ING4主要表达于细胞核,在胞质及间质中同样有少许表达。BPH中ING4主要表达于细胞核中,而PCa组织中胞浆染色较明显,在分化较好的PCa中有少许胞核着色(见图1、图2和图3)。ING4在BPH及PCa中阳性表达率分别为93.75%、50.00%,差异具有统计学意义(P<0.05),见表1。在病理分级中中分化PCa中阳性表达率为100%,低分化PCa中阳性表达率为41.66%。PCa中PSA值为<10ng/mL、10~20ng/mL及PSA大>20ng/mL,其ING4阳性表达率分别为100%、85.71%、23.53%,差异具有统计学意义(P<0.05),见表2。随PCa临床分期增加,ING4表达率呈下降趋势,分别为100%、76.92%、8.33%,差异具有统计学意义(P<0.05),见表3。

图1 ING4 在BPH组织中的表达(IHC×200)
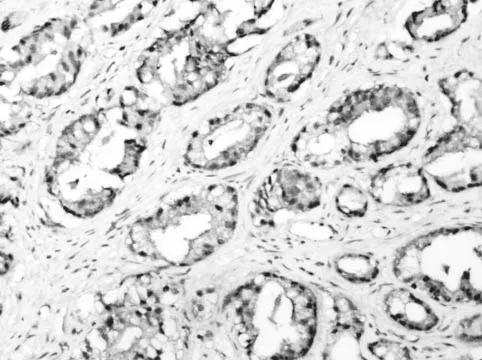
图2 ING4 在中分化PCaa组织中的表达(IHC×200)
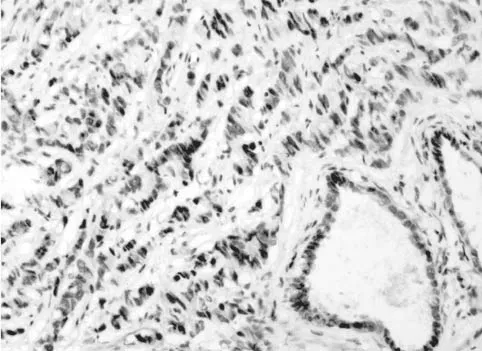
图3 ING4 在低分化PCaa组织中的表达(IHC×200)

表1 ING4 在BPH及PCaa中的染色结果

表2 ING4 在不同病理分级及不同PSA的PCaa中的染色结果
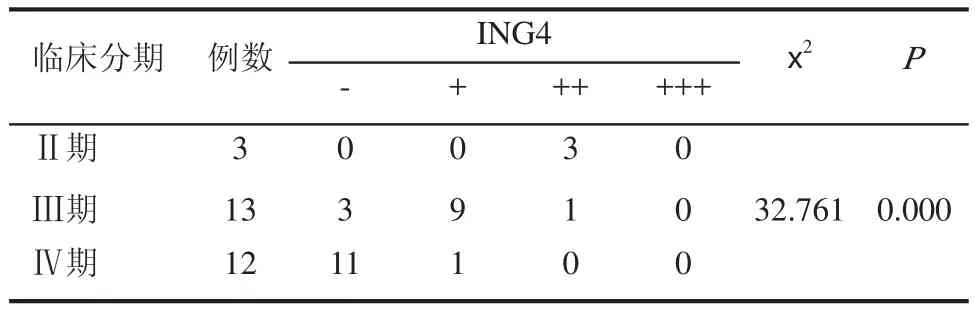
表3 ING4 在不同临床分期前列腺癌组织中的表达
二、CD34标记的MVD在BPH组织及PCaa组织中的表达
CD34主要标记血管内皮细胞,其主要表达于细胞浆中,本实验中CD34标记的微血管密度按DIMITRIOS[24]标准,PCa组织中微血管密度明显高于BPH组织(见图4、图5、图6),在BPH中微血管密度≥90的占32.26%,PCa中微血管密度≥90的占78.57%,且在癌组织区域其血管密度更为密集,两者间比较具有明显差异(P<0.05),见表4。PSA值为<10ng/mL、10~20ng/mL及PSA大>20ng/mL的前列腺癌组织中CD34标记的MVD值分别为72.92±16.26、90.42±6.38、121.30±34.71,差异具有统计学意义(P<0.05),见表5。病理分级中,中分化与低分化PCa中MVD值分别为72.92±12.26、114.84±33.68,两者之间差异具有统计学意义(P<0.05)。随PCa临床分期增加,MVD值呈升高趋势,分别为72.92±16.26、98.73±14.47、132.69±39.73,差异具有统计学意义(P<0.05),见表6。

图4 在BPH组织中CD34的表达(IHC×200)

图5 在中分化PCa组织中CD34的表达(IHC×200)

图6 在低分化PCaa组织中CD34的表达(IHC×200)

表4 CD34标记的MVD在良性前列腺增生及前列腺癌中的表达

表5 CD34 标记的MVD在不同病理分级及不同PSA前列腺癌中的表达

表6 CD34 在不同临床分期前列腺癌组织中的表达
三、PCaa组织中ING4蛋白表达与CD34标记的MVD值之间相关性
随着PCa病理分级及危险等级的增加,ING4基因表达逐渐降低,而CD34标记的MVD值逐渐增加,等级相关分析示:在PCa组织中ING4的表达与CD34标记的MVD值呈负相关,r值为-0.827,差异具有统计学意义(P<0.05),见表7。

表7 ING4 与CD34在PCa组织中表达的相关性
讨论
前列腺癌(prostate cancer, PCa)是西方国家最常见的男性恶性疾病,美国癌症协会2015年统计结果显示前列腺癌居男性癌症发病率首位,死亡率居第二位[2]。在我国前列腺癌发病率相对较低,但近年来也呈增高趋势,且大部在初诊时已进入晚期或发生转移[3]。手术、放疗及激素辅助治疗对于局限性前列腺癌疗效较理想,其5年生存率达到95%;而发生骨转移或远处器官转移的晚期前列腺癌病人,以及激素非依赖性前列腺癌,上述治疗不佳,且5年生存率低于28%[4],因此需寻求新的治疗策略及辅助治疗措施改善临床结果。对于肿瘤远处转移相关机制尚不清楚。
随着对癌症发生及进展机制的深入研究,更多具有生长抑制及细胞凋亡作用的基因相继被发现。生长抑制因子ING基因家族成为肿瘤生长抑制基因的研究热点。20世纪90年代Garkavtsev[5]等克隆出ING1基因,通过细胞转染方式检测其在乳腺癌中表达是降低的,并推测该基因可能对肿瘤细胞存在抑制作用。随后相继发现了ING2、ING3、ING4及ING5基因,并被确认为肿瘤抑制基因[5,6]。ING4基因在2004年Nature杂志上正式确认为一种重要的肿瘤抑制因子[5]。国内外文献报告在宫颈癌[7]、结肠癌[8]、肺癌[1]等肿瘤中ING4表达降低或缺失,并与肿瘤临床分期、病理分级及淋巴结转移密切相关,表明ING4基因可能在肿瘤发生及发展中具有重要作用。本实验研究同样发现在PCa组织中ING4表达明显低于BPH组织,差异具有统计学意义(P<0.05),且随肿瘤病理分级、危险等级(结合Gleason评分、PSA及临床分期结果)而增加,ING4表达随之降低。我们还发现在BPH组织中ING4主要表达于细胞核,而PCa中主要为胞浆着色,且随肿瘤恶性程度增加,其细胞浆着色越浅,甚至在低分化PCa组织中存在ING4表达的缺失,这与Wang等[1]在肺癌研究中相符。ING4基因在肿瘤细胞浆表达存在差异的原因可能与ING4突变体ING4-V2表达有关,由于ING4-V2变异体缺乏完整的NLS区域,NLS区的突变可以转移ING4的核定位区,导致其在肿瘤细胞浆中表达增加。
ING4基因抑制肿瘤生长的机制可能与以下有关:(1)ING4基因激活P21/waf1启动子,调节P53功能,促进细胞凋亡[9];(2)ING4与NF-κB的p65亚基发生结合,从而抑制NF-κB转录活性,以及通过PHD区域在缺氧下抑制HIF-1α活性,间接降低了IL-8 的表达,导致新生血管形成减少[10,11];(3)抑制由原癌基因MYCN 或 MYC 过度表达引起的细胞间接触抑制的丧失[12];(4)ING4在肿瘤中的低表达及其功能的丢失使FasL在肿瘤细胞中高表达,从而帮助黑色素瘤细胞逃脱免疫监视,进而诱导T淋巴细胞的凋亡以及导致Fas表达的下降,使肿瘤避免T淋巴细胞的攻击。另外,其也能够增强Fas/FasL的表达,从而促进其下游分子如Caspase-8和Bid促凋亡蛋白的表达,最终激活凋亡的外源路径[13]。
大部分实体肿瘤的生长完全依赖于血管。CD34表达于早期淋巴造血干细胞、祖细胞、血管内皮细胞、胚胎纤维母细胞和某些神经组织的细胞,近些年研究已经证实CD34在正常及肿瘤的血管内皮细胞中都有表达,是与肿瘤微小血管形成密切相关的抗原,已成为目前较为敏感的血管标记物[14]。研究发现,在口腔黑色素瘤[15]、甲状腺癌等[16]肿瘤中MVD值均高于正常组织,随临床分期增加及分化程度的降低肿瘤组织中微血管计数升高,并且MVD值较高的肿瘤预后较差,提示MVD值可作为判断肿瘤患者预后的一个指标。本实验以CD34标记的MVD在PCa中明显高于BPH,微血管密度随病理分级的增加及危险等级的增加而增加,表明PCa侵袭性越强其MVD值越高,这与之前的研究是相符合的。已有研究发现在结肠癌、乳腺癌中ING4基因表达与MVD呈负相关,随肿瘤临床分期及病理分级增加,其MVD值越高,而ING4蛋白表达呈下降趋势[7,8]。本实验同样得出在前列腺癌组织中ING4基因的表达与MVD呈负相关,随PCa病理分级及危险等级增加,ING4表达下降,而MVD值逐渐增加。这表明ING4在调节血管形成通路中可能具有潜在的作用,参与了肿瘤的侵袭及转移。
肿瘤的的发生及发展是多基因、多因素作用的结果,本实验发现ING4在PCa组织中表达减少或缺失,以及与MVD表达呈负相关,可得出ING4的缺失对肿瘤血管的生成具有促进作用,其可能参与了前列腺癌的发展。目前对于ING4在调节血管形成的具体分子机制仍不清楚,但我们认为对ING4基因研究可为今后前列腺癌的临床诊断及治疗提供理论依据及方向。
1Wang QS, Li M, Zhang LY, et al. Down-regulation of ING4 is associated with initiation and progression of lung cancer. Histopathology 2010; 57(2):271-281
2Siegel RL, Fedewa SA, Miller KD, et al. Cancer statistics for Hispanics/Latinos, 2015. Ca A Cancer Journal for Clinicians 2015; 65(6): 457-480
3曹希亮, 高江平. 治疗晚期前列腺癌药物治疗研究进展.解放军医药杂志 2013;25(2): 59-63.
4刘俊, 胡卫列, 宋波. 雄激素非依赖性前列腺癌发生机制研究进展. 中国男科学杂志 2009; 23(8): 66-69
5Garkavtsev I, Kozin SV, Chernova O, et al. The candidate tumor suppressor protein ING4 regulates brain tumor growth and angiogenesis. Nature 2004;428(6980): 328-332
6Shiseki M, Nagashima M, Pedeux RM, et al. p29ING4 and p28ING5 bind to p53 and p300, and enhance p53 activity. Cancer Res 2003;63(10):2373-2378
7Yuan J, Han YL, Wang TY, et al. The expression of inhibitor of growth 4 is reduced in cervical cancer tissues. Eur Rev Med Pharmacol Sci 2016;20(15):3178-3185
8Chen Y, Huang Y, Hou P, et al. ING4 suppresses tumor angiogenesis and functions as a prognostic marker in human colorectal cance. Oncotarget 2016; 7(48):79017-79031
9Shiseki M, Nagashima M, Pedeux RM, et al. p29ING4 and p28ING4 bind to p53 and p300 and enhance p53 activity. Cancer Res 2003; 63: 2373-2378
10Shi X, Hong T, Walter KL, et al. ING2 PHD domain links histone H3 lysine 4 methylation to active gene repression. Nature 2006; 442(7098): 96-99
11赵树鹏, 靳彩玲, 赵新利, 等. 星形细胞瘤组织中生长抑制因子4和缺氧诱导因子-1α的表达及其临床意义. 中华医学杂志 2015; 95(43): 3533-3536
12Gunduz M, Nagatsuka H, Demircan K, et al. Frequent deletion and down-regulation of ING4, a candidate tumor suppressor gene at 12p13, in head and neck squamous cell carcinomas.Gene 2005;356: 109-117
13Zhao D, Liu X, Zhang Y, et al. Reduced expression and prognostic implication of inhibitor of growth 4 in human osteosarcoma. Oncol Lett 2016; 11(4):2869-2874.
14Zhang Y, Xu Y, Ma J, et al. Adrenomedullin promotes angiogenesis in epithelial ovarian cancer through upregulating hypoxia-inducible factor-1α and vascular endothelial growth factor. Sci Rep 2017;16(7):40524
15Simonetti O, Lucarini G, Rubini C, et al. Microvessel density and VEGF, HIF-1a expression in primary oral melanoma:correlation with prognosis. Oral Dis 2013; 19(6): 620-627
16Gulubovaa M, Ivanovaa K, Ananieva J, et al. VEGF expression, microvessel density and dendritic cell decrease in thyroid cancer. Biotechnol Biotechnol Equip 2014; 28(3): 508-517
(2017-01-11收稿)
Expressions of ING4 and CD34 protein in human prostate cancer and their clinical signif cance*
Xia Zhongyou1, Zhang Zhongping1, Li Yunxiang1, Zhang Meng2, Wu Ji1**
1. Department of Urology,Second Clinical College of North Sichuan Medical College,Nanchong Central Hospital of Sichuan Province, Nanchong 637000, China; 2. North Sichuan Medical College
Objective To investigate the expressions of ING4 and CD34 protein in prostate cancer (PCa) and explore their clinical significance. Methodss The expressions of CD34 and ING4 in 28 prostate cancer tissues and 32 benign prostatic hyperplasia tissues were examined by immunohistochemistry, and the correlation between the results and the pathological grade and dangerous grade of prostate cancer was further analyzed. Resultss The positive expression rate of ING4 gene in prostate cancer tissues was signif cantly lower than that of benign prostatic hyperplasia tissues, and ING4 expression decreased as tumor pathological grade, PSA level and clinical stage developed. MVD (microvessle density) in prostate cancer tissues was signif cantly higher than that of benign prostatic hyperplasia tissues, and MVD value increased as tumor pathological grade and risk level increased. ING4 was negatively correlated with the MVD(r = -0.827), which was statistically signif cant (P<0.05). Conclusion Abnormal expression of ING4 may contributed to the occurrence and progression of prostate cancer , and it can be an indicator for prostate cancer diagnosis and treatment.
s ING4; CD34; prostate cancer; immunohistochemistry
:10.3969/j.issn.1008-0848.2017.02.002
R 737.25
资助:南充市科技局资助项目(14A0071)
**通讯作者,E-mail: Wuji2168@sina.com

