靶向YWHAE基因shRNA慢病毒表达质粒的构建及功能验证
张晓艳, 温春燕, 吕玉华, 陈 豪, 佘菲菲
靶向YWHAE基因shRNA慢病毒表达质粒的构建及功能验证
张晓艳, 温春燕, 吕玉华, 陈 豪, 佘菲菲
目的 构建靶向YWHAE基因的shRNA慢病毒表达质粒,并验证其对AGS胃癌细胞增殖的影响。 方法 设计并合成5对针对人YWHAE基因的shRNA序列,分别克隆入pLentiLox3.7(pLL3.7)慢病毒表达质粒,接着将重组的慢病毒表达质粒和包装质粒PHR、包膜质粒VSVG一起采用磷酸钙法转染293T细胞包装慢病毒,收集制备的慢病毒感染AGS细胞,用抗生素Puromycine进行筛选。Western-blot检测感染细胞YWHAE蛋白的表达。选取干扰效率最高的慢病毒表达质粒,针对性设计siRNA的点突变引物,重叠延伸PCR法扩增获得点突变的YWHAE基因,克隆入pcDNA3.1/myc-His(-)A载体,构建YWHAE点突变的表达质粒,转染YWHAE沉默效果最好的AGS细胞株,Western-blot检测转染细胞YWHAE蛋白的回复表达。采用MTS法检测YWHAE-shRNA慢病毒对AGS细胞增殖的影响。 结果 5对针对人YWHAE基因的shRNA序列构建的慢病毒中,pLL3.7-siYWHAE-5包装成的慢病毒抑制AGS细胞的YWHAE蛋白表达的效果最明显,仅为对照组相对表达量的(0.269±0.083)倍;pLL3.7-siYWHAE-5包装的慢病毒,其干扰效应可经由YWHAE点突变表达质粒回复。与对照组比较,YWHAE-shRNA组AGS细胞增殖能力明显下降。 结论 成功构建了靶向YWHAE基因的shRNA慢病毒表达质粒,获得YWHAE基因表达显著下调的AGS细胞株;探明YWHAE表达的下调可有效抑制AGS细胞的增殖,提示YWHAE在胃癌中的致癌潜能。
慢病毒属; RNA干扰; 胃肿瘤; 细胞增殖
在全球高发肿瘤中,胃癌位居第4位,死亡率居癌症死亡率的第2位,严重威胁人类的健康,探讨胃癌的发病机制成为当前研究的热点[1]。酪氨酸3-单加氧酶/色氨酸5-单加氧酶激活蛋白ε肽(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein, epsilon, YWHAE)是14-3-3蛋白家族的ε亚型,是生物进化中最保守的蛋白之一[2]。在胃癌的相关研究中,YWHAE扮演的角色目前尚存在争议。幽门螺杆菌是公认的致癌原,Nagappan等用该菌感染Gulo-/-(L-gulono-gamma-lactone oxidase基因缺失)小鼠,在胃组织中检测到YWHAE高表达[3-4]。Gong等通过免疫组织化学染色发现,YWHAE在胃癌组织中高表达[5]。但Leal等发现,YWHAE蛋白在胃癌组织中的表达明显低于癌旁组织[6]。在胃癌组织中,YWHAE究竟是抑癌还是促癌,单纯从蛋白的表达水平上判定存在一定的局限性。从实质上探讨YWHAE的功能作用以明确YWHAE与胃癌的关系,从而探明YWHAE在胃癌的发生发展中所起的作用,对胃癌的防治有重大的意义。本研究拟构建靶向YWHAE基因shRNA慢病毒表达质粒,建立YWHAE表达下调的胃癌细胞模型,并检测其对细胞增殖的影响,为调控YWHAE在胃癌中的相关功能的深入研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 质粒、菌株和细胞株 pLentiLox3.7(pLL3.7)、PHR和VSVG(消化道恶性肿瘤教育部重点实验室保存);pcDNA3.1/myc-His(-)A、大肠杆菌Stable3和DH5α(美国Invitrogen公司);人胃腺癌上皮细胞系AGS(中国中科院上海细胞库);293T细胞(美国ATCC公司)。
1.1.2 试剂 胎牛血清(FBS,德国PAN公司);Ham’s-F12培养液(美国HyClone公司);DMEM高糖培养液和Puromycine(美国Gibco公司);XhoI、HpaI、EcoR I、XbaI和KpnI(美国NEB公司);高保真DNA聚合酶(美国Invitrogen公司);Western及IP细胞裂解液、BCA法定量试剂(中国Beyotime公司);anti-14-3-3ε(T-16)(美国Santa Cruz公司);Myc-Tag (9B11) Mouse mAb(美国CST公司);goat anti-mouse IgG-AP(德国Merck公司);anti-β-actin(美国Sigma公司);FuGENE 6 Transfection Reagent和Cell Titer 96 AQueous One Solution Reagent(美国Promega公司)。
1.2 方法
1.2.1 细胞培养 人胃腺癌上皮细胞系AGS培养于含10% FBS的Ham’s-F12培养液中,293T细胞培养于含10% FBS的DMEM高糖培养液中。二者均置于37 ℃、体积分数为0.05的CO2、饱和湿度的细胞培养箱中孵育培养,2~3 d换液传代1次。
1.2.2 重组慢病毒pLL3.7-YWHAE-shRNA表达质粒的构建 根据GenBank数据库提供的YWHAE(NM_006761.4)基因编码序列,利用美国Invitrogen公司提供的在线RNA干扰序列设计软件及BLOCK-iTTMInducible H1 Lentiviral RNA System手册中提供的设计规则,按照正义链模板:5′-T-(GN18)-(TTCAAGAGA)-(81NC)-TTTTT
TC-3′,反义链与正义链互补,并在其5′端加入XhoI酶切位点(TCGAG),设计5对针对人YWHAE基因的shRNA序列引物,1对无义的阴性对照序列引物由上海Invitrogen生物公司合成,具体序列如下(F:正义链;R:反义链)。将合成的引物退火,形成双链DNA oligo,克隆入经XhoI和HpaI双酶切后的pLL3.7慢病毒表达质粒中,构建重组的pLL3.7-YWHAE-shRNA表达质粒和pLL3.7-NC-shRNA阴性对照质粒,转化大肠杆菌感受态细胞Stable3,挑取重组阳性菌落抽提质粒行双酶切及测序(福州铂尚生物技术有限公司)鉴定。
siYWHAE-1:
F:5′-TGCTGAGCAGTTGTCCGCGTTTCAAGAGAACGCGGACAACTGCTCAGCTTTTTTC-3′
R:5′-TCGAGAAAAAAGCTGAGCAGTTGTCCGCGTTCTCTTGAAACGCGGACAACTGCTCAGCA-3′
siYWHAE-2:
F:5′-TGCAGTTGTCCGCGTGCGCATTCAAGAGATGCGCACGCGGACAACTGCTTTTTTC-3′
R:5′-TCGAGAAAAAAGCAGTTGTCCGCGTGCGCATCTCTTGAATGCGCACGCGGACAACTGCA-3′
siYWHAE-3:
F:5′-TGGAAGGAGGCTGCGGAGAATTCAAGAGATTCTCCGCAGCCTCCTTCCTTTTTTC-3′
R:5′-TCGAGAAAAAAGGAAGGAGGCTGCGGAGAATCTCTTGAATTCTCCGCAGCCTCCTTCCA-3′
siYWHAE-4:
F:5′-TGAAGAAAGCTATAAGGACTTTCAAGAGAAGTCCTTATAGCTTTCTTCTTTTTTC-3′
R:5′-TCGAGAAAAAAGAAGAAAGCTATAAGGACTTCTCTTGAAAGTCCTTATAGCTTTCTTCA-3′
siYWHAE-5:
F:5′-TGAGGAGAAGACAAGCTAAATTCAAGAGATTTAGCTTGTCTTCTCCTCTTTTTTC-3′
R:5′-TCGAGAAAAAAGAGGAGAAGACAAGCTAAATCTCTTGAATTTAGCTTGTCTTCTCCTCA-3′
siRNA-NC:
F:5′-TGTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGACTTTTTTC-3′
R:5′-TCGAGAAAAAAGTCTCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTTCGGAGACA-3′
1.2.3 慢病毒的包装 用磷酸钙转染法转染293T细胞进行慢病毒包装。具体步骤如下:转染前1天,将293T细胞铺于35 mm板中,当密度达到汇合度60%~70%即可进行转染。在转染前1 h,用新鲜无血清的DMEM培养液进行细胞换液。按下列剂量配制转染试剂体系:质粒(pLL3.7 2 μg,PHR 1.5 μg,VSVG 1 μg),2.5 mol/L的CaCl210 μL,补充水至100 μL,混匀,再加入2×HBS 100 μL,静置20~30 min。将混合物混匀后均匀滴到293T细胞中,轻轻摇动,置培养箱内培养8 h。更换新鲜的完全培养液,并加NEAA(100×) 20 μL,继续培养至48 h(从转染时开始计算时间),收集上清分装入EP管中,6 500 r/min离心5 min,吸取上清,用0.45 μm滤膜过滤,收集滤液即病毒液。
1.2.4 慢病毒感染AGS细胞 将AGS细胞以汇合度为50%~60%均匀铺于35 mm板,培养14~16 h。将收集到的病毒液均匀滴加至AGS细胞中,轻轻摇匀,放置培养箱培养。24 h后换新鲜完全培养液。待细胞汇合度为80%~90%时,将细胞从35 mm板消化转移至2个6 cm板(一板用于筛选细胞株,一板用于验证表达情况),培养液分别补足至5 mL,加抗生素Puromycine,用最低致死量0.5 μg/mL筛选。待6 cm板细胞汇合度为80%~90%,转移至10 cm板,继续用最低致死量的Puromycine培养1周。1周后抗生素剂量减半,再筛选1周(时间从感染开始计算),收集细胞,冻存于-80 ℃。
1.2.5 YWHAE-shRNA 慢病毒干扰细胞蛋白表达功能的鉴定 Puromycine筛选结束后,各感染组收集部分细胞,用Western及IP细胞裂解液分别提取总蛋白,BCA法定量测定蛋白浓度后,取等量蛋白进行Western-blot验证[一抗anti-14-3-3ε(T-16),1∶200稀释;二抗goat anti-mouse IgG-AP,1∶2 000稀释;内参anti-β-actin,1∶2 000稀释],观察慢病毒介导的RNAi对AGS细胞YWHAE表达的沉默效果。用Image J 1.48软件分析蛋白条带的灰度,并以β-actin为内参,计算YWHAE蛋白的表达量。
AGS-siYWHAE细胞YWHAE蛋白相对表达水平=YWHAE表达量siYWHAE-5组/YWHAE表达量siNC组
1.2.6 YWHAE-shRNA慢病毒干扰细胞蛋白表达功能的回复验证 为了证明实验筛获的YWHAE-shRNA慢病毒对细胞YWHAE的干扰未出现off-target效应(脱靶效应),进一步采用干扰回复实验进行验证。
1.2.6.1 YWHAE点突变质粒pcDNA3.1-myc-YWHAEm的构建 根据GeneBank上公布的YWHAE基因(NM_006761.4),设计扩增YWHAE基因(768 bp)的引物。
上游:
YWHAE-F:5′-CCGCTCGAGGCCACCATGGATGA
TCGAGAGGATCTG-3′(下划线为XhoI位点,序列5′端加上GCCACC增强翻译效率)
下游:
YWHAE-R:5′-CGGGGTACCCTGATTTTCGTCTTC
CA-3′(下划线为KpnI位点)
同时,设计含针对siYWHAE-5干扰序列的点突变(下划线标记)。
正向:
Fm:5′-GGCGGCGAGGATAAACTGAAGATGATTC
GGGAATATCGGCAAA-3′
反向:
Rm:5′-CTTCAGTTTATCCTCGCCGCCCTTGTTTT
CTTCTTTCTGTTC-3′
引物由福州铂尚生物技术有限公司合成。利用重叠延伸PCR法,以pGADT7-YWHAE(本实验室保存)作为模板,使用引物YWHAE-F和Rm以及Fm和YWHAE-R分别扩增YWHAE基因上游及下游片段。扩增参数为:94 ℃预变性5 min;94 ℃变性30 s→55 ℃退火30 s→72 ℃延伸20 s(上游片段)或40 s(下游片段),共25个循环;最后72 ℃延伸10 min。以YWHAE基因上游及下游片段为模板,使用引物YWHAE-F和YWHAE-R扩增YWHAE点突变基因的全长(YWHAEm)。扩增参数为:94 ℃预变性5 min;94 ℃变性30 s→55 ℃退火30 s→72 ℃延伸1 min,共25个循环;最后72 ℃延伸10 min。进而将YWHAEm克隆入pcDNA3.1/myc-His(-)A载体中,构建pcDNA3.1-myc-YWHAEm表达质粒,转化大肠杆菌感受态细胞DH5α,挑取重组阳性菌落抽提质粒行PCR、双酶切及测序鉴定。
1.2.6.2 pcDNA3.1-myc-YWHAEm蛋白表达验证及干扰回复验证 用FuGENE 6 Transfection Reagent将pcDNA3.1-myc-YWHAEm分别转染入AGS野生株、AGS-siNC和AGS-siYWHAE细胞株。48 h后提取细胞蛋白,BCA定量,进行Western-blot检测目的蛋白的表达[一抗Myc-Tag (9B11) Mouse mAb,1∶1 000稀释和anti-14-3-3ε(T-16);二抗goat anti-mouse IgG-AP;内参anti-β-actin],观察在YWHAE-shRNA慢病毒干扰的AGS 细胞中YWHAE表达的回复效果。
1.2.7 MTS法检测YWHAE-shRNA慢病毒对AGS细胞增殖的影响 将YWHAE沉默效果最好的AGS细胞株(AGS-siYWHAE)和对照组细胞株(AGS-siNC)分别以每孔2×103个细胞接种于96孔板,每组设3个复孔,连续培养5 d。实验结束前1 h,吸弃细胞培养液,每孔加入100 μL培养液和20 μL Cell Titer 96 AQueous One Solution Reagent,在37 ℃、体积分数为0.05的CO2环境下孵育1 h。在酶标仪上用490 nm波长测定各孔吸光度(OD)值,以空白孔调零,实验重复5次。以OD值为纵轴、作用时间为横轴绘制AGS细胞增殖曲线。
增殖抑制率=(1-ODsiYWHAE组/ODsiNC组)×100%
2 结 果
2.1 重组慢病毒pLL3.7-YWHAE-shRNA表达质粒的鉴定 慢病毒载体pLL3.7含有限制性核酸内切酶XhoI和HpaI的酶切位点,用于插入退火产物。5对针对人YWHAE基因的shRNA序列和1条无义的阴性对照序列的正义链和反义链,退火形成双链DNA oligo,各自退火产物的两端中均有一端为XhoI的粘性末端,另一端为平齐末端。故将退火产物克隆入pLL3.7载体中,获得的重组质粒pLL3.7-YWHAE(或NC)-shRNA中还保留XhoI位点,而HpaI位点已被破坏,借助这种特性可对初筛的重组质粒进行酶切鉴定:即重组构建成功后,当质粒用EcoR I和XbaI酶切,可切开得到约1 800 bp的片段;而用EcoR I和HpaI酶切则无法获得双酶切效果(图1)。将经双酶切初筛的质粒进一步送测序验证,成功构建了具有正确序列的重组质粒,分别为pLL3.7-siYWHAE-1,pLL3.7-siYWHAE-2,pLL3.7-siYWHAE-3,pLL3.7-siYWHAE-4,pLL3.7-siYWHAE-5和pLL3.7-siNC。
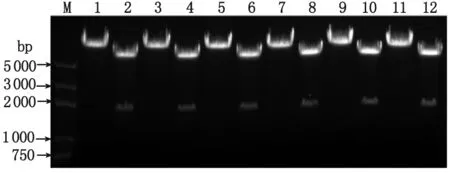
1,2:pLL3.7-siYWHAE-1质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;3,4:pLL3.7-siYWHAE-2质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;5,6:pLL3.7-siYWHAE-3质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;7,8:pLL3.7-siYWHAE-4质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;9,10:pLL3.7-siYWHAE-5质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;11,12:pLL3.7-siNC质粒EcoR I/Hpa I及EcoR I/Xba I双酶切;M:5 kb DNA Marker.图1 重组质粒pLL3.7-YWHAE-shRNA双酶切鉴定Fig 1 Double digestion analysis of the recombinant plasmid pLL3.7-YWHAE-shRNA
2.2 YWHAE-shRNA 慢病毒干扰细胞蛋白表达功能的鉴定 慢病毒表达质粒(pLL3.7-siYWHAE-1,pLL3.7-siYWHAE-2,pLL3.7-siYWHAE-3,pLL3.7-siYWHAE-4,pLL3.7-siYWHAE-5和pLL3.7-siRNA-NC)和包装质粒PHR、包膜质粒VSVG转染293T细胞,转染24 h后,即可观察到细胞病理现象。在转染后48 h收集病毒感染AGS细胞,用含Puromycine的完全培养液筛选细胞。筛选结束后,提细胞总蛋白进行Western-blot验证。结果显示,5对针对人YWHAE基因的shRNA序列构建的慢病毒中,pLL3.7-siYWHAE-5包装成的慢病毒抑制AGS细胞YWHAE蛋白表达的效果最明显,仅为对照组表达量的(0.269±0.083)倍(图2),该稳定细胞株命名为AGS-siYWHAE细胞。
2.3 重组YWHAE点突变pcDNA3.1-myc-YWHAEm表达质粒的鉴定 以pGADT7-YWHAE为模板,利用重叠延伸PCR法扩增定点突变的YWHAEm基因,并克隆入pcDNA3.1/myc-His(-)A载体,获得的重组质粒经PCR鉴定,可见约768 bp的DNA条带(图3)。重组质粒经XhoI和KpnI双酶切后,可见约5 500和768 bp2条DNA条带,分别与载体质粒和目的基因大小相符(图3),进一步测序证实YWHAEm基因正确插入pcDNA3.1/myc-His(-)A载体中。

n=3. A:Western-blot鉴定YWHAE-shRNA慢病毒对AGS细胞YWHAE蛋白表达的影响;B:AGS-siYWHAE细胞YWHAE蛋白相对表达水平. 与siNC组比较,☆:P<0.05.图2 YWHAE-shRNA慢病毒对AGS细胞YWHAE蛋白表达的影响Fig 2 Effect of YWHAE-shRNA lentivirus on the expression of YWHAE protein in AGS cells
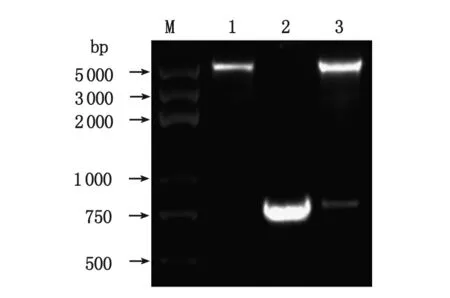
1:pcDNA3.1/myc-His(-)A质粒Xho I/Kpn I双酶切;2:以pcDNA3.1-myc-YWHAEm为模板PCR扩增点突变的YWHAE基因;3:pcDNA3.1-myc-YWHAEm质粒Xho I/Kpn I双酶切;M:5 kb DNA Marker.图3 pcDNA3.1-myc-YWHAEm质粒的PCR及双酶切鉴定Fig 3 PCR identification and double digestion analysis of the recombinant plasmid pcDNA3.1-myc-YWHAEm
2.4 pcDNA3.1-myc-YWHAEm对YWHAE- shRNA慢病毒干扰的回复验证 将pcDNA3.1-myc-YWHAEm和pcDNA3.1/myc-His(-)A(对照)分别转染AGS细胞,经Western-blot显示,pcDNA3.1-myc-YWHAEm转染组用Myc-Tag (9B11) Mouse mAb可检测到目的蛋白条带,分子量大小与预期相符(约38 kDa)(图4);而对照组未见特异性条带,即YWHAE点突变质粒pcDNA3.1-myc-YWHAEm可经转染在AGS细胞中表达YWHAE。将pcDNA3.1-myc-YWHAEm质粒转染AGS-siYWHAE细胞,经Western-blot显示,与转染pcDNA3.1/myc-His(-)A的AGS-siYWHAE细胞比较,转染后AGS-siYWHAE细胞中YWHAE表达明显上调,与AGS-siNC细胞内源性YWHAE相近(图5)。表明YWHAE-shRNA慢病毒对AGS细胞表达YWHAE的干扰实验是成功的,未出现off-target效应,细胞可经转染pcDNA3.1-myc-YWHAEm重组质粒回复干扰。

图4 YWHAEm蛋白在AGS细胞中的表达Fig 4 YWHAEm protein expression in AGS cells
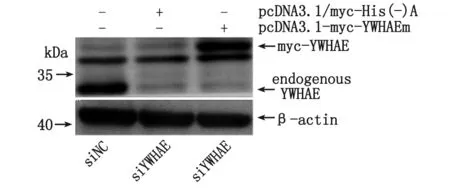
图5 YWHAEm蛋白在AGS-siYWHAE细胞中的回复表达Fig 5 YWHAEm protein re-established expression in AGS-siYWHAE cells
2.5 YWHAE-shRNA 慢病毒对AGS细胞增殖功能的影响 用MTS比色法检测AGS-siYWHAE和AGS-siNC(对照)1~5 d的细胞增殖情况,结果显示,AGS-siYWHAE组与AGS-siNC组比较,从第2天开始,细胞增殖就出现差异,第3~5天这种差异逐渐加大,增殖抑制率分别为23.6%,23.6%和20.8%,AGS-siYWHAE组的增殖受到显著抑制(图6)。表明YWHAE-shRNA慢病毒感染使AGS细胞YWHAE表达下调后,AGS细胞的增殖能力明显受到抑制。
3 讨 论
本研究成功构建了YWHAE-shRNA慢病毒表达质粒。在构建YWHAE-shRNA慢病毒表达质粒前期,考虑到在目的基因上选择不同起始位点的片段为模板所构建的RNAi载体对目的基因的抑制率可能会不同,课题组分别针对人YWHAE基因的5′非编码区(UTR5)和开放读码框(ORF)设计了5个基因片段来构建相应表达质粒。筛选结果发现,针对UTR5设计的2个片段干扰效果不明显,推测可能UTR5存在丰富的调控蛋白结合区域,而这些调控蛋白的结合可能影响到RNA诱导沉默复合体(RNA-induced silencing complex, RISC)与mRNA的结合,从而影响了siRNA的干扰效果;针对ORF设计的3个片段均能达到一定的下调靶基因表达的作用,并且片段5的干扰抑制效率最高[YWHAE的相对表达量为对照组的(0.269±0.083)倍]。进而课题组设计含针对siYWHAE-5干扰序列的点突变引物,构建了YWHAE点突变(同义突变)表达质粒,并将后者转染筛获的细胞株,顺利回复了YWHAE的表达,表明课题组筛获的YWHAE- shRNA慢病毒对细胞YWHAE的干扰未出现脱靶效应,成功构建了由shRNA慢病毒表达质粒介导的YWHAE表达下调的AGS胃癌细胞模型,可用于后续的实验。

n=5. YWHAE-shRNA慢病毒感染使AGS细胞的增殖能力明显受到抑制. 与siNC组比较,☆:P<0.05.图6 YWHAE-shRNA慢病毒对AGS细胞增殖的影响Fig 6 Effect of YWHAE-shRNA lentivirus on the proliferation of AGS cells
与Gong等采用shRNA质粒转染筛选YWHAE表达下调的SGC7901细胞相比[5],本研究采用慢病毒载体感染筛选YWHAE表达下调的AGS细胞具有自身的优势:(1)慢病毒载体源于人类免疫缺陷病毒-1,能感染非分裂期细胞和分裂期细胞,宿主范围广;(2)病毒感染细胞的效率通常比质粒转染细胞的效率高;(3)当感染细胞时,病毒的基因可整合到宿主细胞的基因组中,随细胞分裂传给子代,表达稳定;(4)病毒自身的致病基因已被剔除,难以重组野生病毒株,应用较为安全。因此,本研究用慢病毒载体表达YWHAE-siRNA能在胃癌细胞中高效、安全、稳定持久地发挥干扰下调YWHAE基因表达的作用,并且不仅可用于后续的细胞实验,还可用于动物体内的实验研究。此外,Gong等采用的shRNA质粒为商品化的试剂,不仅成本高,而且具体序列未公布,使得干扰回复实验的开展受限[5]。
在YWHAE与胃癌的相关研究中,Yan等通过在SGC7901胃癌细胞中过表达YWHAE,发现YWHAE可激活ERK/MAPK信号通路,导致细胞增殖[7]。Gong等在下调YWHAE表达的SGC7901细胞中发现了抑制细胞增殖的现象[5]。本课题组借助MTS法检测,发现课题组构建的YWHAE-shRNA慢病毒介导AGS细胞YWHAE表达下调后,细胞的增殖能力也明显受到抑制。由此表明,YWHAE在胃癌细胞中具有促进细胞增殖的功能,很可能促进了胃癌的发生发展。但是关于YWHAE在胃癌发生发展中的作用目前仍观点不一。例如,Leal团队研究发现,YWHAE蛋白在胃癌组织中的表达明显的低于癌旁组织,提示YWHAE可能是种抑癌蛋白[6]。遗憾的是,该团队并未进一步探讨YWHAE在胃癌细胞内的功能机制。在胃癌的发生发展中不仅发生细胞增殖异常,而且在细胞凋亡、侵袭转移、血管生成等多方面都可能发生异常,YWHAE是促癌还是抑癌,则还有待更多体内外实验的深入验证。
本研究成功构建YWHAE-shRNA慢病毒表达质粒,建立YWHAE表达下调的AGS胃癌细胞模型,探明YWHAE表达下调对AGS细胞增殖的影响,为调控YWHAE在胃癌细胞内的功能研究和动物体内实验的开展奠定了基础。
[1] Van Cutsem E, Sagaert X, Topal B,etal. Gastric cancer[J].Lancet, 2016,388(10060):2654-2664.
[2] Aitken A. 14-3-3 proteins: a historic overview [J].SeminCancerBiol, 2006,16(3):162-172.
[3] Chen S Y, Zhang R G, Duan G C. Pathogenic mechanisms of the oncoprotein CagA inH.pylori-induced gastric cancer [J].OncolRep, 2016,36(6):3087-3094.
[4] Nagappan A, Park H S, Park K I,etal.Helicobacterpyloriinfection combined with DENA revealed altered expression of p53 and 14-3-3 isoforms in Gulo-/-mice [J].ChemBiolInteract, 2013,206(2):143-152.
[5] Gong X, Yan L, Gu H,etal. 14-3-3ε functions as an oncogene in SGC7901 gastric cancer cells through involvement of cyclin E and p27kip1[J].MolMedRep, 2014,10(6):3145-3150.
[6] Leal M F, Calcagno D Q, Demachki S,etal. Clinical implication of 14-3-3 epsilon expression in gastric cancer [J].WorldJGastroenterol, 2012,18(13):1531-1537.
[7] Yan L, Gu H, Li J,etal. RKIP and 14-3-3ε exert an opposite effect on human gastric cancer cells SGC7901 by regulating the ERK/MAPK pathway differently [J].DigDisSci, 2013,58(2):389-396.
(编辑:何佳凤)
Construction and Function Identification of Short Hairpin RNA Lentiviral Expression Plasmid Targeting YWHAE
ZHANG Xiaoyan, WEN Chunyan, LYU Yuhua, CHEN Hao, SHE Feifei
Key Laboratory of Ministry of Education for Gastrointestinal Cancer, Fujian Key Laboratory of Tumor Microbiology, Fujian Medical University, Fuzhou 350122, China
Objective To construct a short hairpin RNA (shRNA) lentiviral expression plasmid targeting YWHAE (Tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein, epsilon) gene and then detect the effect of shRNA on the proliferation of AGS cells. Methods Five shRNA interference sequences targeting YWHAE gene were designed, synthesized and cloned into the pLentiLox3.7(pLL3.7) expression vector. Then the expression plasmids, PHR and VSVG were co-transfected into 293T cells using calcium phosphate to package virus. AGS cells were infected with the extracted virus, and screened with Puromycine. Silencing effect was verified via Western-blot. The lentiviral expression plasmid with the best silence of YWHAE was selected, then YWHAE gene with point mutation was constructed by overlap-extension PCR, and cloned into pcDNA3.1/myc-His(-)A vector. The pcDNA3.1-myc-YWHAEm was transfected into AGS cells with the best silence of YWHAE, then re-expression of YWHAE was detected by Western-blot. MTS assay was used to detect the proliferation of AGS cells. Results Among the five packaged lentivirus, the pLL3.7-siYWHAE-5 lentivirus were selected with the best effect. The relative level of YWHAE protein expression [(0.269±0.0 83)-fold] of AGS cells infected with the selected virus was significantly lower than that of AGS cells infected with the pLL3.7-siNC lentivirus. After pcDNA3.1-myc-YWHAEm was transfected into the AGS cells with the best silence of YWHAE, however YWHAE protein expression were re-established. Compared to negative control group (infected with NC-shRNA lentivirus), cell proliferation in YWHAE-shRNA group was significantly inhibited. Conclusion The recombinant shRNA lentivirus targeting the YWHAE gene was constructed successfully, and the AGS cells with knock-down of YWHAE were obtained. Knocking down YWHAE gene has noticeable effects on the proliferation inhibition of AGS cells, which implies YWHAE may be a putative oncoprotein in AGS cells.
lentivirus; RNA interference; stomach neoplasms; cell proliferation
2017-03-07
国家自然科学基金(81271784);福建省教育厅项目(JA12150);福建医科大学重大科研项目基金(09ZD018);福建医科大学苗圃科研基金(2010MP029)
福建医科大学 消化道恶性肿瘤教育部重点实验室,福建省肿瘤微生物重点实验室,福州 350122
张晓艳,女,讲师,医学博士
佘菲菲. Email: shefeifei@yeah.net
R394.2; R735.2
A
1672-4194(2017)03-0139-07

