辣椒两种雄性不育系中可溶性蛋白质及可溶性糖的变化关系
黄 巍缪 武
(1.湖南省蔬菜研究所, 长沙 410125; 2. 湖南兴蔬种业有限公司, 长沙 410125;3.湖南湘研种业有限公司, 长沙 410100)
辣椒两种雄性不育系中可溶性蛋白质及可溶性糖的变化关系
黄 巍1,2缪 武3
(1.湖南省蔬菜研究所, 长沙 410125; 2. 湖南兴蔬种业有限公司, 长沙 410125;3.湖南湘研种业有限公司, 长沙 410100)
了解辣椒两种雄性不育系在花粉败育过程中可溶性蛋白质及可溶性糖的变化规律,以期为辣椒雄性不育系不育机理的研究提供参考。以辣椒细胞核雄性不育(GMS)G06-77-2AB及细胞核质互作雄性不育(CMS)系C06-77-2A为材料,用Lowry法和蒽酮法对蛋白质和糖进行测定并分析比较。结果表明:辣椒两种不同类型不育系花蕾发育的各个时期,可溶性蛋白质的含量不论是细胞核质互作不育系(C06-77-2A)还是细胞核雄性不育系(G06-77-2A)均明显低于其可育系(G06-77-2B),但是两种不育系之间没有明显规律可循。花蕾发育的各个时期,两种不同类型不育系可溶性糖含量均低于可育系,细胞核质互作不育系(C06-77-2A)明显低于细胞核雄性不育系(G06-77-2A)。两种雄性不育系在花蕾发育的各个时期,可溶性蛋白质和可溶性糖含量均低于可育系,两种不育系间无明显规律可循。
辣椒;CMS;GMS;可溶性蛋白质;可溶性糖
AbstractThe changes of the soluble protein and soluble sugar in the process of pollen abortion of the two-type male sterile lines were understood in this study so as to provide reference for the research of sterile mechanism of male sterile line in hot pepper. With a pepper genic male sterile (GMS) line G06-77-2 AB and a caryoplasm interaction male sterile (CMS) line C06-77-2 A as materials, Lowry method and anthrone method were used for the measure and comparison of the protein and sugar. The results showed that, in each development period of buds of the two types of pepper male sterile line, either the CMS line (C06-77-2A) or the GMS line (G06-77-2A) had the soluble protein content of buds signifcantly lower than its fertile line (G06-77-2B), but there was no clear rule to fnd between the two types of male sterile lines. And the soluble sugar content of buds of the two sterile lines was signifcantly lower than that of its fertile line, and the soluble sugar content of the CMS line (C06-77-2A) was signifcantly lower than that of the GMS line (G06-77-2A). The two types of male sterility had soluble protein and soluble sugar content lower than the fertile line at various stages of fower bud development, and there was no clear rule between the two sterile lines.
Key wordshot pepper; CMS; GMS; soluble protein; soluble sugar
蛋白质和糖是细胞组成中的重要物质,对小孢子的发生过程极为重要。刘齐元等[1]研究表明:雄性不育烟草花蕾中的可溶性蛋白质含量都比其相应保持系的低,而且随着花蕾的发育,这种差距还有扩大的趋势。邓明华等[2]研究表明:辣椒随着花蕾的发育,不育系中花蕾蛋白质的含量在大花蕾和中花蕾时期均低于小花蕾时期,而保持系花蕾中蛋白质的含量则在大花蕾时期明显高于中花蕾和小花蕾时期。谢冰等[3]在对辣椒核型雄性不育小孢子发育时期发现,可溶性蛋白质含量从小孢子母细胞期以后不育系明显低于可育系。刘齐元等[1]研究表明:烟草雄性不育系花蕾中可溶性糖含量在小花蕾和中花蕾时期比其相应的保持系略高,而在大花蕾阶段则又都比其相应的保持系略低,表现出一致的趋势。郭丽娟等[4]对茄子雄性不育系的可溶性糖、淀粉、氨基酸分析研究表明:随着花蕾的发育,不育系可溶性糖高于保持系。邓明华等[2]研究辣椒花蕾的发育过程中,不育系大花蕾时期的可溶性糖含量明显低于前两期,而保持系可溶性糖含量一直呈上升趋势。
本试验以辣椒细胞核雄性不育系G06-77-2AB及细胞核质互作雄性不育系C06-77-2A为试材,寻找其花蕾发育各个时期可溶性蛋白质及糖的含量变化规律,并与其可育系G06-77-2B进行比较,从而为辣椒雄性不育系不育机理的研究提供参考。
1 材料和方法
1.1 材料
试验材料为高辣椒红色素细胞核雄性不育系G06-77-2A,细胞核质互作雄性不育系C06-77-2A及两个不育系的保持系G06-77-2B (G06-77-2B既是细胞核雄性不育系G06-77-2A的可育株,也是细胞核质互作雄性不育系C06-77-2A的保持系)。材料均通过了多代选育,农艺学性状相似,其育性稳定,遗传背景清楚。
1.2 方法
1.2.1 田间栽培与管理 材料于2013年9月下旬播种于海南三亚试验基地,前茬水稻,辣椒采用条播,每667 m2施氮、磷、钾含量均为16%的俄罗斯复合肥50 kg,菜饼50 kg、磷50 kg及钾肥10 kg作底肥。10月下旬定植,椒苗6 ~ 7叶真叶,定植7 d后每667 m2追施挪威复合肥5 kg。田间管理和病虫害防治同一般大田辣椒。材料于翌年1月中下旬陆续现蕾,1月25 ~ 30日初花。
1.2.2 辣椒两种雄性不育系C06-77-2A及G06-77-2AB花蕾分级 根据花蕾大小和外部形态特性将试验各材料花蕾分为8个等级,如表1所示,以期研究花蕾外部形态与小孢子发育时期的关系。

表1 辣椒不同级别花蕾形态特征与小孢子发育的关系
1.2.3 蛋白质含量测定 采用Lowry法[5]进行蛋白质含量测定。
试验方法:花蕾雄蕊鲜样经液氮研磨后,采用0.02 M的磷酸液提取。含量测定采用Lowry法[5]进行,其原理是首先在碱性溶液中形成铜 — 蛋白质复合物,然后这一复合物还原磷钼酸-磷钨酸试剂(Folin - 酚试剂),产生钼蓝和钨蓝的深蓝色复合物,这种深蓝色复合物在745 ~ 750 nm处有最大的吸收峰,颜色的深浅(吸收值大小)与蛋白质浓度成正比。可根据750 nm处的光吸收值大小,计算蛋白质含量。
①溶液A的配制:100 mL,称量0.5 g CuSO4•5H2O、1 g Na3C6H5O7•2H2O,加超纯水至100 mL,高压锅灭菌后,室温保存。
②溶液B的配制:1 L,称量20 g Na2CO3、4 g NaOH,加超纯水至1 L,高压锅灭菌后,室温下长期保存。
③溶液C的配制:51 mL,用微量移液枪取1 mL溶液A,用量筒量取50 mL溶液B,混匀后即可使用。注意该试剂只能使用一天,过期失效,必须现配现用。
④溶液D的配制:20 mL,吸取10 mL Folin -酚试剂、10 mL超纯水,混匀后即可使用,该试剂可在冰箱中长期保存。
⑤标准蛋白质溶液的配制:用电子天平称量2.5 mg牛血清白蛋白,加超纯水100 mL,配制成25 μg/mL的溶液,贮藏于冰箱中备用。
⑥标准曲线的制作:取14只1.5 mL离心管分成两组,分别加入0、10、20、40、60、80、100 μL标准蛋白质溶液,用超纯水补足至1 mL,加入500 μL溶液C混匀,于20 ~ 25℃浴锅中放置10 min,再加入50 μL溶夜D ,立即振荡摇匀,在20 ~25℃浴锅保温30 min,然后放置在室温下,待生成的颜色稳定后,在紫外可见光分光光度计上,测定750 nm处的OD值。取两组测定的平均值,以蛋白质浓度为横坐标,OD值为纵坐标,绘制标准曲线。
⑦样品测定:取0.1 mL样品的可溶性蛋白质提取液(用0.02 M的磷酸缓冲液),同时以0.1 mL水为对照,按上述制作标准曲线的步骤,依次加入500 μL溶液C,保温,再加入50 μL溶液D,再保温,待颜色稳定后测750 nm处的OD值。根据OD值,在标准曲线图上算出样品的可溶性蛋白质含量。
1.2.4 可溶性糖含量测定 采用蒽酮法[6]进行可溶性糖含量测定。
制作标准曲线:取6支大试管,按表2所示配置一系列不同浓度的葡萄糖溶液。在每支试管中立即加入蒽酮试剂0.5 mL,再用酸式滴定管加入浓硫酸5 mL,摇匀,反应10 min,在620 nm波长下比色。以标准葡萄糖浓度做横坐标,以消光值做纵坐标,作出标准曲线。
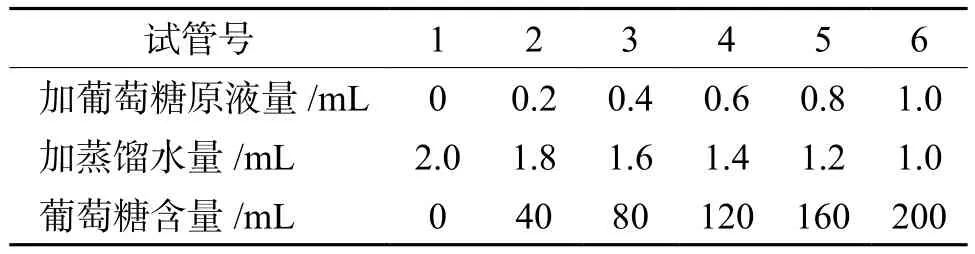
表2 不同浓度葡萄糖溶液的配制
将辣椒材料剪碎至2 mm以下,准确称取1 g,放入50 mL锥形瓶中,加沸水25 mL,在水浴中加盖煮沸10 min,冷却后过滤,滤液收集在50 mL量瓶中,水洗后定容至刻度。取1 mL待测样,加入1 mL蒸馏水,混匀,加入0.5 mL蒽酮试剂,再加入5 mL浓硫酸,摇匀。10 min后在620 nm下测其消光值,并从标准曲线上查出葡萄糖的含量。
2 试验结果
2.1 辣椒两种不育系类型不育系和可育系中蛋白质含量比较
雄性不育系C06-77-2A、G06-77-2AB不同发育时期的花蕾中可溶性蛋白含量的测定见图1。图1结果表明:细胞核质互作不育系C06-77-2A随着花蕾的发育,可溶性蛋白质呈不断降低的趋势,基本呈直线关系,且一直低于保持系G06-77-2B的水平;而G06-77-2A及G06-77-2B花蕾中可溶性蛋白含量的变化趋势则表现出先降低,然后升高,再降低的趋势,第一个拐点出现在花蕾时期4时,第二个拐点出现在花蕾时期6时,且细胞核不育系G06-77-2A可溶性蛋白质含量一直低于可育系G06-77-2B,并且从花蕾时期2开始,达到显著水平。
两种类型雄性不育系之间比较,在花蕾时期4之前,细胞核质互作不育系C06-77-2A可溶性蛋白质含量下降的速度远远快于细胞核雄性不育系G06-77-2A,前者下降3.2倍,后者下降仅1.8倍;花蕾时期4之后,G06-77-2A可溶性蛋白质含量缓慢升高,接近时期5的时候,含量再次超过了C06-77-2A,最后两者变化趋于平稳(图1)。
2.2 辣椒两种不育系类型不育系和可育系中可溶性糖含量比较
辣椒两种不育系类型不育系和可育系可溶性糖含量随花蕾发育而变化,如图2所示。首先,两种不育系类型与其相应的可育系,整个花蕾发育过程中可溶性糖含量先上升,然后下降,均在花蕾时期4即减数分裂后期出现第1个拐点,含量达到最高,之后均略有下降,但是可育系G06-77-2B在花蕾时期7后出现第2个拐点,含量略有上升,两种不育系均一直缓慢下降,直到花粉成熟。其次,可育系G06-77-2B明显高于细胞核质互作不育系C06-77-2A,差异显著;可育系G06-77-2B各时期较细胞核不育系G06-77-2A高,但没有达到显著差异。对两种不育系进行比较后发现,细胞核雄性不育系G06-77-2A整个花蕾发育过程中,可溶性糖均高于细胞核质互作不育系C06-77-2A,经统计分析,差异达到显著水平。
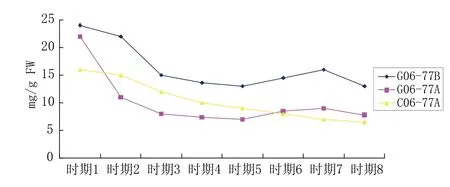
图1 辣椒C06-77-2A与G06-77-2AB花蕾中可溶性蛋白含量
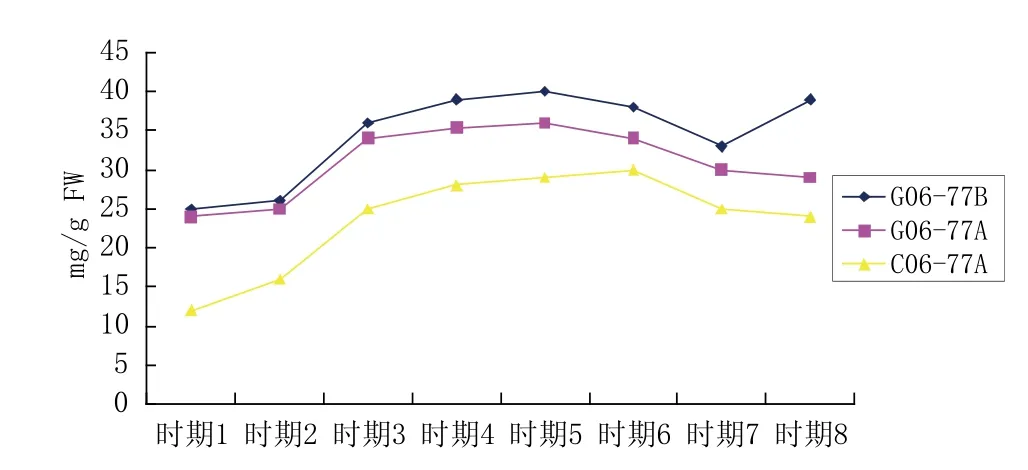
图2 辣椒C06-77-2A与G06-77-2AB花蕾中可溶性糖含量
3 讨论
3.1 不育系中可溶性蛋白含量变化趋势
在生物界大多数遗传信息最终表现为蛋白质,植物界小孢子形成和花粉发育各个时期都有特异的蛋白质合成。本研究中发现,在辣椒两种不同类型不育系花蕾发育的各个时期,花蕾的可溶性蛋白质的含量,无论是细胞核质互作不育系(C06-77-2A),还是细胞核雄性不育系(G06-77-2A)均明显低于其可育系(G06-77-2B);但是两种不育系之间没有明显规律可循。如果把花蕾的可溶性蛋白质含量输入DPS分析软件,进行成对数据的t测验,则两种不同类型雄性不育系与其可育系之间,花蕾的可溶性蛋白质含量也存在显著性差异,差异达5%显著水平,但是两种不育系之间差异没有达到显著水平。
3.2 不育系中可溶性糖含量变化趋势
花蕾中的可溶性糖含量也与可溶性蛋白质含量有相似的趋势,花蕾的各个时期,两种不同类型不育系可溶性糖含量均低于可育系,细胞核质互作不育系(C06-77-2A)明显低于细胞核雄性不育系(G06-77-2A)。如果把可溶性糖含量输入DPS分析软件,进行成对数据的t测验,则两种不同类型雄性不育系与其可育系之间,两种不育系可溶性糖方面,细胞核雄性不育系(G06-77-2A)与细胞核质互作不育系(C06-77-2A)差异达到1%的显著水平;细胞核质互作不育系(C06-77-2A)与可育系(G06-77-2B)之间也存在极显著差异,差异也达1%显著水平,但是细胞核雄性不育系(G06-77-2A)与可育系(G06-77-2B)之间差异不是很显著。
[1] 刘齐元,朱肖文,刘飞虎,舒文英,崔爱花,赵婷. 烟草雄性不育花蕾发育过程中几种物质含量的变化[J]. 江西农业大学学报,2007,29(3):336-340
[2] 邓明华,邹学校,周群初,刘志敏,文锦芬. 辣椒细胞质雄性不育系与保持系生化特性研究[J]. 湖南农业大学学报(自然科学版),2002,28(6):492-494
[3] 谢冰,王志源,蒋健箴. 辣椒核型雄性不育小孢子发育时期生化特性的初步研究[J]. 中国农业大学学报,1999, 4(5):103-106
[4] 郭丽娟,申书兴,张成合,陈雪平,武占会. 茄子雄性不育系的可溶性糖、淀粉、氨基酸分析[J]. 河北农业大学学报,2007,27(4):34-36,92
[5] 汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,2000:47
[6] 赵世杰,刘华山,董新纯. 植物生理学实验指导[M]. 北京:中国农业科技出版社,1998
Relationship between Two Male Sterile Lines and Changes of Soluble Protein and Soluble Sugar in Hot Pepper
HUANG Wei1,2MIAO Wu3
(1. Hunan Institute of Vegetables, Changsha 410125, China; 2. Hunan Xingshu Seed Industry Co., Ltd., Changsha 410125, China; 3. Hunan Xiangyan Seed Industry Co., Ltd., Changsha 410100, China)
2017-05-28
黄巍(1978-),男,助理研究员,主要从事蔬菜品种选育及新品种推广

