过表达CUEDC2人脑胶质瘤细胞系U251的构建
唐传喜,刘鑫峰,李风,高殿帅
(徐州医科大学,江苏徐州221004)
·论著·
过表达CUEDC2人脑胶质瘤细胞系U251的构建
唐传喜,刘鑫峰,李风,高殿帅
(徐州医科大学,江苏徐州221004)
目的 构建过表达CUE结构域蛋白2(CUEDC2)的人脑胶质瘤U251细胞系。方法 PCR扩增CUEDC2基因全长序列,将其连接于GV358载体质粒。酶切鉴定GV358-CUEDC后采用慢病毒包装三质粒系统(GV358-CUEDC2、Helper 1.0、Helper 2.0)转染293T细胞。转染48、72 h后收集病毒上清并感染U251细胞。将U251细胞分为空白对照组、过表达CUEDC2组、空载体组。空白对照组不进行感染操作,过表达CUEDC2组、空载体组分别感染GV358-CUEDC和GV-vector。流式筛选后采用实时荧光定量PCR法检测U251细胞中的CUEDC2 mRNA,采用Western blotting法检测CUEDC2蛋白。结果 GV358-CUEDC酶切结果显示在900 bp处有一条明显条带,CUEDC2测序结果与GenBank数据库比对完全一致。流式筛选感染GV358-CUEDC慢病毒的U251细胞,得到阳性率95%以上的U251细胞。U251细胞在感染GV358-CUEDC2及GV-vector病毒后荧光显微镜下均可见绿色荧光。空白对照组、空载体组、过表达CUEDC2组U251细胞中CUEDC2 mRNA相对表达量分别为5.290±0.663、0.823±0.059、1,CUEDC2蛋白相对表达量分别为0.48±0.020、0.51±0.015、0.92±0.150,过表达CUEDC2组CUEDC2 mRNA及蛋白相对表达量均高于空载体组和空白对照组(P均<0.01)。结论 成功构建了过表达CUEDC2的人脑胶质瘤U251细胞系。
胶质瘤;胶质母细胞瘤;CUE结构域蛋白2;慢病毒
胶质母细胞瘤(GBM)是一种中枢系统常见的恶性肿瘤,近30年来发生率逐年递增[1]。尽管手术切除及术后放化疗等综合治疗方法不断更新,该病预后仍不乐观。GBM呈浸润性生长,与周围组织无明显分界,手术很难完全切除[2]。研究发现,胶质瘤干细胞(GSCs)的存在是胶质瘤发病、放化疗耐受、复发和转移的根源[3];且JAK1-STAT3通路的过度激活在其中起着重要作用[4]。如何阻滞或减缓胶质瘤干细胞生长是当前研究热点之一。CUE结构域蛋白2(CUEDC2)是一个包含CUE结构域的功能未知的蛋白质,分子量约为32 kDa,由287个氨基酸组成。CUEDC2在人体所有组织器官中均有表达,在大脑、心脏、睾丸中高表达[5],在多种肿瘤中也有异常表达。在高级别的胶质瘤中,尤其是GBM中,CUEDC2表达低于正常脑组织,而关于CEUDC2在胶质瘤及GSCs中的调节机制尚未有报道。为此,我们构建了过表达CUEDC2基因的人脑胶质瘤U251细胞系,为后续研究奠定了实验基础。
1 材料与方法
1.1 主要实验材料 目的基因CUEDC2(870 bp,NM_024040),载体质粒GV358(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin,上海吉凯基因公司),293T细胞系、U251细胞系(中科院细胞库),DH5α感受态(天根生化公司)。RNA提取试剂TRIzol、反转录试剂盒、质粒提取试剂盒(PromeIga公司),琼脂糖凝胶回收试剂盒(天根生化公司),DNA Marker(Fermentas公司、捷瑞公司),限制性内切酶AgeI(NEB公司),DMEM高糖培养基、胎牛血清(Hyclone公司),Lipofectmine2000(Invitrogen公司),NC膜(VICMED生物公司),蛋白裂解液(南京凯基生物有限公司),CUEDC2抗体(Proteintech公司)。
1.2 CUEDC2基因扩增 以含有CUEDC2基因的cDNA库为模板,扩增CUEDC2基因序列。上游引物序列为5′-GGGTCAATATGTAATTTTCAGTG-3′,下游引物序列为5′-CCTTATAGTCCTTATCATCGTC-3′。引物有上海吉凯生物合成提供。PCR反应条件:98 ℃预变性5 min、98 ℃变性10 s、56 ℃退火10 s、72 ℃延伸90 s,共30个循环;72 ℃保温8 min,4 ℃保存。琼脂糖凝胶电泳鉴定并分离产物,DNA凝胶回收试剂盒回收并纯化CUEDC2片段。
1.3 携带CUEDC2基因的慢病毒载体GV358-CUEDC的构建 使用AgeⅠ对GV358载体进行酶切,使其线性化,对载体酶切产物进行琼脂糖凝胶电泳,回收目的条带。GV358载体和CUEDC2基因酶切产物进行连接反应,于冰水浴中配制反应体系(ddH2O 2.5 μL,5×CE Ⅱ Buffer 2 μL,酶切后的载体DNA 2.5 μL,纯化后的PCR产物片段2 μL,Exnase Ⅱ 1 μL),于37 ℃反应30 min,随后置于冰水浴中冷却5 min。
1.4 GV358-CUEDC重组子筛选及鉴定 将10 μL“1.3”中的反应产物加入到100 μL感受态细胞中,冰上放置30 min,42 ℃热激90 s,冰水浴孵育2 min。加入LB培养基,置于37 ℃摇床振荡培养1 h。取适量菌液均匀涂布在含有相应抗生素的平板上,在恒温培养箱中倒置培养12~16 h。在超净工作台中,用无菌枪头挑单个菌落至20 μL鉴定体系,置于PCR仪中进行反应。反应体系包括ddH2O 9.2 μL,2×Taq Plus Master Mix 10 μL,上、下游引物各0.4 μL,单个菌落。反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃ 5 min。将PCR产物进行凝胶电泳。将阳性转化的重组子接种于含相应抗生素的LB培养基,摇菌扩增后,取适量菌液测序。
1.5 GV358-CUEDC慢病毒包装 慢病毒包装系统包括GV358-CUEDC2、病毒包装辅助质粒Helper1.0、Helper2.0。慢病毒颗粒的包装采用脂质体介导的瞬时转染方法进行。转染前24 h用胰蛋白酶消化对数生长期的293T细胞,调整细胞密度为5×106/15 mL,重新接种于10 cm细胞培养皿,置于37 ℃、5% CO2培养箱内培养。待细胞密度为70%~80%时即可用于转染,转染前2 h更换为无血清培养基。将GV358-CUEDC载体质粒 20 μg、Helper1.0载体质粒15 μg、Helper2.0载体质粒10 μg的混合液缓慢滴加至293T细胞的培养液中,混匀,于37 ℃、5% CO2培养箱中培养,6 h后弃培养基,换成含10%血清培养基继续培养48~72 h。之后收集病毒上清,离心去细胞碎片,用0.45 μm滤器过滤,于超速离心管中4 ℃条件下25 000 r/min离心2 h。
1.6 GV358-CUEDC感染U251细胞 将U251细胞培养于含10% FBS的高糖DMEM培养基中,取对数生长期U251细胞接种于6孔板中,待融合约60%左右进行病毒感染。将U251细胞分为空白对照组、过表达CUEDC2组、空载体组,空白对照组不进行感染操作,过表达CUEDC2组、空载体组分别感染GV358-CUEDC和GV-vector(均携带GFP基因)。感染24 h后更换为正常培养基继续培养。待细胞数量足够,收集细胞进行流式分选。
1.7 U251细胞中CUEDC2 mRNA及蛋白检测 采用实时荧光定量RCR法检测各组细胞中的CUEDC2 mRNA。CUEDC2基因上游引物序列为5′-CTGAGCGATGCCAGGAAC-3′、下游引物序列为5′-CACCGAACAGGTAGGGAACAC-3′,内参GAPDH上游引物序列为5′-TGACTTCAACAGCGACACCCA-3′、下游引物序列为5′-CACCCTGTTGCTGTAGCCAAA-3′。反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环35次,72 ℃10 min,4 ℃保存,以2-ΔΔCt表示目的基因相对表达量。将筛选后的细胞收集加蛋白裂解液进行总蛋白提取,测定各组蛋白浓度后,配置10%的SDS-PAGE,常规电泳,转膜,封闭,加入一抗CUEDC2、β-actin,4 ℃过夜,孵育二抗2 h,Odyssey扫描条带,利用Image J软件分析条带灰度值,用CUEDC2灰度值比内参actin灰度值表示目的蛋白相对表达量。
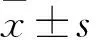
2 结果
2.1 GV358-CUEDC2质粒鉴定结果 成功构建GV358-CUEDC2质粒酶切结果显示有900 bp处有一条明显条带。经PCR扩增鉴定,所挑取得菌落全为阳性转化子(见图1)。对挑取的阳性克隆菌测序,测序结果与GenBank数据库比对完全一致。
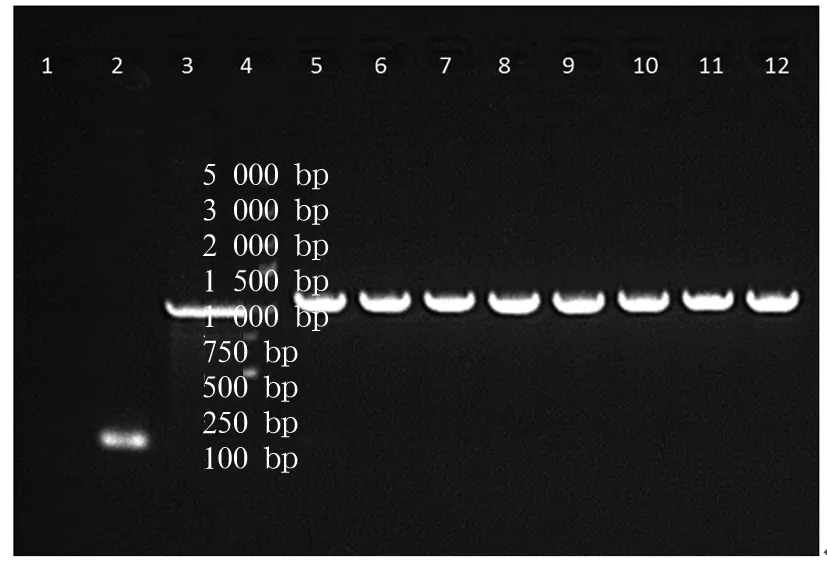
图1 GV358-CUEDC2质粒PCR扩增产物琼脂糖凝胶电泳图
2.2 慢病毒GV358-CUEDC2包装制备及感染U251细胞情况 GV358-CUEDC2/GV358-vector、Helper 1.0、Helper 2.0共转染293T细胞24 h后可见荧光,48 h后细胞内绿色荧光表达明显增强(见图2)。收集感染48、72 h时的上清液,浓缩病毒后4 ℃暂存,感染目的细胞U251,72 h后收集细胞做流式分选并经流式分析,结果显示空白对照组感染率为8.8%,感染病毒组感染率为99.8%,可认为流式分选后获得较纯的细胞系。U251细胞在感染GV358-CUEDC2及GV-vector病毒后荧光显微镜下均可见绿色荧光(见图3)。
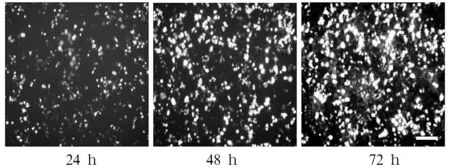
图2 GV358-CUEDC2转染293T细胞24、48、72 h后荧光显微镜下观察结果
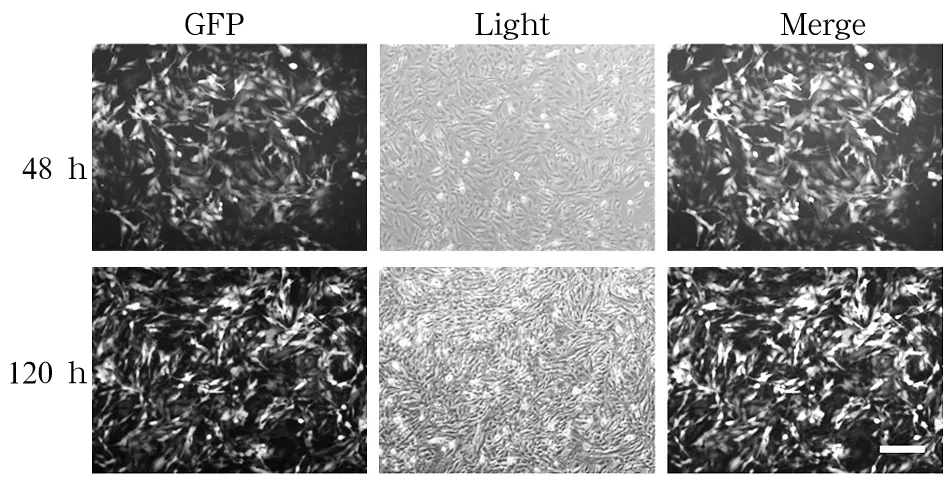
图3 感染GV358-CUEDC2的U251细胞经流式筛选后荧光显微镜下观察结果
2.3 各组U251细胞中CUEDC2 mRNA及蛋白相对表达量 空白对照组、空载体组、过表达CUEDC2组U251细胞中CUEDC2 mRNA相对表达量分别为1、0.823±0.059、5.290±0.663,CUEDC2蛋白相对表达量分别为0.48±0.020、0.51±0.015、0.92±0.150,过表达CUEDC2组CUEDC2 mRNA及蛋白相对表达量均高于空载体组和空白对照组(P均<0.01)。
3 讨论
CUEDC2是近年新发现的一种蛋白,作为多功能蛋白,其在肿瘤发生发展中所起到的作用也备受争议。有研究表明,CUEDC2可促使APC/Cdc20更早活化[6],可以推动细胞周期进展,引发染色体错误分裂进而引起肿瘤发生[7]。目前已发现慢性髓性白血病、肝癌、肺腺癌等肿瘤细胞中CUEDC2蛋白表达下调,进而影响肿瘤的生长、转移或细胞周期。在乳腺癌中,CUEDC2可促使雌激素受体和孕激素受体降解,导致肿瘤对激素治疗不敏感[7]。在肺腺癌中,CUEDC2表达下调者临床预后更差、生存期更短[8]。研究[4]表明JAK1-STAT3通路过激活是肿瘤发生的重要因素,有学者[9]报道CUEDC2参与了该通路激活的调控。
GBM临床常规治疗后易复发,难以根治。GBM生物学特性是呈浸润性生长,与周围组织无明显分界,手术很难以完全切除[2]。随着对肿瘤研究的深入,肿瘤干细胞[10]开始引起学者们的关注。肿瘤干细胞是一簇兼具正常干细胞特征和诱导肿瘤发生能力的小细胞团,首次发现是在血液病中[11],后在多种实体肿瘤中陆续被分离发现[12, 13]。GSCs被认为参与了胶质瘤放化疗耐受,同时被视为肿瘤发生根源所在[14]。有报道称JAK1-STAT3、NF-κB、Notch、Wnt[15]等信号通路参与肿瘤干细胞的干性维持。对GSCs相关基因及蛋白进行分析,寻找其干性维持的分子机制,对恶性胶质瘤的分子治疗相关研究有很大帮助[16]。对Oncomine数据深入分析后,我们发现CUEDC2的表达量与胶质瘤的级别有相关性。而在胶质瘤中,CUEDC2蛋白的作用及其机制尚未明确。为进一步分析CUEDC2在胶质瘤诊断和预后评估中的应用价值,我们决定在体外和体内分别对CUEDC2在胶质瘤中的生物学作用及其机制开展研究。
应用慢病毒感染结合流式分选可获得高纯度的稳定细胞系,能够使细胞免于高浓度抗生素长期筛选导致的非特异表达,从而更好地保护细胞状态,便于研究目的基因CUEDC2的功能。同时我们前期已经比较了正常人星形胶质细胞(HA)和胶质瘤细胞系中CUEDC2的表达情况,构建稳定过表达CUEDC2的U251细胞系对后续探讨CUEDC2在胶质瘤细胞中的功能及具体机制有重要价值。
我们所构建的携带CUEDC2基因的慢病毒载体质粒,酶切结果显示在900 bp和9 000 bp左右分别有两条明显的条带,证明成功将目的基因和病毒载体连接在一起。流式筛选感染GV358-CUEDC慢病毒的U251细胞,得到阳性率95%以上的U251细胞,可认为流式分选后获得较纯的细胞系。U251细胞在感染GV358-CUEDC2及GV-vector病毒后荧光显微镜下均可见绿色荧光,说明GV358-CUEDC2成功感染U251细胞。过表达CUEDC2组CUEDC2 mRNA及蛋白相对表达量均高于空载体组和空白对照组,进一步佐证过表达CUEDC2的U251细胞系构建成功。
综上所述,本研究成功构建了过表达CUEDC2的U251细胞系,能为后续各种胶质瘤生物学行为实验提供源源不断的细胞供给,探索CUEDC2在脑胶质瘤发生发展中的作用。
[1] Chen R, Cohen AL, Colman H. Targeted therapeutics in patients with high-grade gliomas: past, present and future[J]. Curr Treat Options Oncol, 2016,17(8):42.
[2] Helseth R, Helseth E, Johannesen TB, et al. Overall survival, prognostic factors, and repeated surgery in a consecutive series of 516 patients with glioblastoma multiforme[J]. Acta Neurol Scand, 2010,122(3):159-167.
[3] Chen J, McKay RM, Parada LF. Malignant glioma: lessons from genomics, mouse models, and stem cells[J]. Cell, 2012,149(1):36-47.
[4] Yu H, Jove R. The STATs of cancer--new molecular targets come of age[J]. Nat Rev Cancer, 2004,4(2):97-105.
[5] Man J, Zhang X. CUEDC2: an emerging key player in inflammation and tumorigenesis[J]. Protein Cell, 2011,2(9):699-703.
[6] Zhang WN, Zhou J, Zhou T, et al. Phosphorylation-triggered CUEDC2 degradation promotes UV-induced G1 arrest through APC/C(Cdh1) regulation[J]. Proc Natl Acad Sci U S A, 2013,110(27):11017-11022.
[7] Pan X, Zhou T, Tai YH, et al. Elevated expression of CUEDC2 protein confers endocrine resistance in breast cancer[J]. Nat Med, 2011,17(6):708-714.
[8] Sun L, Bai L, Lin G, et al. CUEDC2 down-regulation is associated with tumor growth and poor prognosis in lung adenocarcinoma[J]. Oncotarget, 2015,6(24):20685-20696.
[9] Zhang WN, Wang L, Wang Q, et al. CUEDC2 (CUE domain-containing 2) and SOCS3 (suppressors of cytokine signaling 3) cooperate to negatively regulate Janus kinase 1/signal transducers and activators of transcription 3 signaling[J]. J Biol Chem, 2012,287(1):382-392.
[10] Williams ED, Williams GT. Cancer, somatic mutation and stem cells[J]. J Theor Biol, 2000,205(1):165-166.
[11] Shih SC, Prag G, Francis SA, et al. A ubiquitin-binding motif required for intramolecular monoubiquitylation, the CUE domain[J]. EMBO J, 2003,22(6):1273-1281.
[12] Kim CF, Jackson EL, Woolfenden AE, et al. Identification of bronchioalveolar stem cells in normal lung and lung cancer[J]. Cell, 2005,121(6):823-835.
[13] Noh MS, Jun BH, Kim S, et al. Magnetic surface-enhanced Raman spectroscopic (M-SERS) dots for the identification of bronchioalveolar stem cells in normal and lung cancer mice[J]. Biomaterials, 2009,30(23-24):3915-3925.
[14] Abou-Antoun TJ, Hale JS, Lathia JD, et al. Brain Cancer Stem Cells in Adults and Children: Cell Biology and Therapeutic Implications[J]. Neurotherapeutics, 2017,14(2):372-384.
[15] Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001,414(6859):105-111.
[16] Tu, Y, Zhong Y, Fu J, et al. Activation of JAK/STAT signal pathway predicts poor prognosis of patients with gliomas[J]. Med Oncol, 2011,28(1):15-23.
Establishment of human glioma U251 cell line with overexpression of CUEDC2
TANGChuanxi,LIUXinfeng,LIFeng,GAODianshuai
(XuzhouMedicalUniversity,Xuzhou221004,China)
Objective To construct human glioma U251 cell line with overexpression of CUE domain containing 2 (CUEDC2). Methods Full-length CUEDC2 gene fragment was amplified by RT-PCR and linked to GV358 plasmid vector. After identifying GV358-CUEDC, we transfected and packaged it using lentivral packaging system (GV358-CUEDC2, Helper 1.0, and Helper 2.0) into renal epithelial cells (293T) by lipofectamin 2000 in order to obtain the LV-CUEDC2 lentivirus. After 48 and 72 h, we collected the virus supernatant and infected the U251 cells. Cells were divided into the blank control group (without any infection), LV-CUEDC2 group (transfected with GV358-CUEDC), and LV-vector group (transfected with GV-vector).After Flow cytometry sorting, Western blotting and real-time fluorescent quantitative PCR were used to detect the mRNA and protein expression levels of CUEDC2. Results GV358-CUEDC digestion showed that there was an obvious band at 900 bp. CUEDC2 sequencing results were consistent with the GenBank database. The results of flow cytometry confirmed the positive rate up to 95%. LV-CUEDC2 group and LV-vector group cells showed green fluorescence under fluorescence microscope after infection with GV358-CUEDC2 and GV-vector. The CUEDC2 mRNA levels of the blank control group, LV-vector group and LV-CUEDC2group were 5.290±0.663, 0.823±0.059, and 1, respectively. The CUEDC2 protein expression levels of the three groups were 0.48±0.02, 0.51±0.015, and 0.92±0.15, respectively. The CUEDC2 protein and mRNA expression levels of LV-CUEDC2 group were both higher than those of the other groups (bothP<0.01). Conclusions We successfully constructed the human glioma U251 cell line with CUEDC2 overexpression.
glioma; glioblastoma; CUE domain containing 2; lentivirus
唐传喜(1992-)男,硕士研究生,主要研究方向为神经胶质瘤的发生发展。E-mail: 972251692@qq.com
高殿帅(1965-),男,博士,教授,主要研究方向为神经胶质瘤的发生发展。E-mail: gds@xzhmu.edu.cn
10.3969/j.issn.1002-266X.2017.27.001
R739.41
A
1002-266X(2017)27-0001-04
2017-01-04)

