NiO/ZnO-Al2O3-SiO2吸附剂反应吸附脱硫机理
李凯,赵基钢,沈本贤,凌昊
NiO/ZnO-Al2O3-SiO2吸附剂反应吸附脱硫机理
李凯,赵基钢,沈本贤,凌昊
(化学工程联合国家重点实验室(华东理工大学),上海200237)
对比考察了N2和H2载气下NiO/ZnO-Al2O3-SiO2吸附剂对模拟汽油的吸附脱硫效果。与H2气氛下的脱硫效果相比,N2载气下吸附剂也具有明显脱硫效果,吸附剂表面积炭导致其脱硫效率降低,从而推断出NiO可以直接进行反应吸附脱硫反应。对不同载气和还原条件下反应前后吸附剂进行XRD、H2-TPR、TOPT和XPS等表征结果表明:反应吸附条件下,吸附剂载体表面NiO难以被还原成单质Ni,说明H2气氛下反应吸附过程中吸附剂中的NiO与单质Ni可能共同参与反应,反应后吸附剂上NiS存量极少。根据以上研究结果,提出了NiO为活性中心的反应吸附脱硫机理。
反应吸附;脱硫;载气;NiO;机理
引 言
基于反应吸附原理的S Zorb汽油脱硫技术具有低辛烷值损耗、操作条件温和、耗氢量少、深度脱硫效果好等优点。美国ConocoPhillips石油公司开发的S Zorb工艺脱硫技术吸附剂于1999年实现工业化,2001年4月Borger炼油厂该工艺工业示范装置开始开工生产。中国石化北京燕山分公司于2007年引进S Zorb技术建成了国内首套S Zorb装置并投产后,中国石化整体收购了S Zorb技术。随后,中国石化又迅速组织了新一代S Zorb技术的研究与开发,中国石化石油化工科学研究院和中国石化工程建设公司等相关单位完成了S Zorb吸附剂国产化、性能提升和相关工程改造,国产化装置运行周期全部超过原引进装置,充分证明了新一代S Zorb技术的可靠性和先进性[1]。
在S Zorb技术引进后,我国在此技术上再创新的研究也取得了较多的成果。徐广通等[2-5]发现吸附剂制备时所采用的铝源不同会影响吸附剂中锌铝尖晶石的生成与否,而锌铝尖晶石一旦生成将会导致S Zorb吸附剂活性下降。Lin等[6-7]发现反应中水蒸气的存在会导致吸附剂中生成硅酸锌,硅酸锌的存在也将使S Zorb吸附剂活性下降。龙军等[8]研究了ZnO的引入使得吸附剂脱硫性能提升的原因,并从化学反应原理的角度作出了解释,认为引入的ZnO会迅速与过程中生成的H2S发生反应生成ZnS,H2S浓度降低一方面避免了其与汽油中的烯烃生成硫醇的副反应,使吸附剂脱硫率提高;另一方面,生成的ZnS会将S固定住,使吸附剂硫容增大。此外,研究还表明ZnO的储硫能力会影响吸附剂的脱硫活性[9]。
反应吸附脱硫机理方面,尹海燕[10]以γ-Al2O3为载体,研究了其上负载的活性金属成分Ni和Cu对有机硫脱除的方式,认为含硫化合物,特别是噻吩类型硫与此类活性金属负载型吸附剂作用时,是利用了含硫有机化合物中的硫原子上的孤对电子与吸附剂中的活性金属以垂直的方式吸附,而非平面式吸附。Mittendorfer等[11-13]通过DFT计算研究了噻吩分子在Ni(100)表面初步的吸附状态,指出噻吩分子以一定角度平行吸附在金属态Ni(100)表面结合能最小更有利于吸附,S原子在C—S键断裂后会进入Ni原子空隙形成NiS。刘卉等[14-15]认为噻吩硫与金属反应吸附方式很可能同时兼具平面吸附与垂直吸附两者,并采用范德华修正后的DFT研究了多种金属(100)表面吸附噻吩硫的活性,筛选出了脱硫性能最佳的负载金属为Ni和Co,并认为噻吩硫是依靠S原子上孤对电子或噻吩内π电子云与该金属d层电子的相互作用,进而达到金属吸附S的目的。Huntley等[16]认为Ni可能插入噻吩S—C键内形成金属六元环中间产物,再进行下一步脱硫步骤。此外,Ryzhikov等[17-18]认为金属Ni单质是反应吸附中促使噻吩分解的活性物质,噻吩在金属Ni上的吸附分解为主要控制步骤,ZnO最终转化为ZnS。Wang等[19]发现NiO/ZnO-Al2O3-SiO2反应吸附脱硫过程中同时存在着加氢和氢转移过程。Lin等[6]讨论氧化硅源和氧化锌的颗粒大小对吸附剂脱硫性能的影响,发现L型氧化硅源与适中粒径的氧化锌所制备的S Zorb吸附剂经水蒸气老化处理后具有较高活性。
为了验证上述机理,本文对比考察了以N2和H2为载气下的NiO/ZnO-Al2O3-SiO2反应吸附汽油脱硫过程。实验结果表明以N2为载气时该吸附剂具有明显脱硫活性。同时还对比了以H2为载气下还原吸附剂和未还原吸附剂的反应吸附脱硫性能,并采用XRD、EDS和XPS等表征手段分析吸附剂还原及反应后的变化,尝试验证和解释NiO/ZnO- Al2O3-SiO2反应吸附脱硫机理。
1 实 验
1.1 吸附剂的制备
Ca改性NiO/ZnO-Al2O3-SiO2吸附剂采用浸渍沉淀法进行制备[20-21],分为共沉淀法制备载体和浸渍法制备吸附剂两步进行。
(1)制备ZnO-Al2O3-SiO2载体:用天平称取一定量Al(NO3)3·9H2O、Zn(NO3)2·6H2O配制成溶液A,再称取一定量的Na2SiO3·9H2O、无水Na2CO3配制成溶液B。为析出沉淀载体,在室温下,将溶液A用蠕动泵以一定速率滴加至不断搅拌的溶液B中,此时溶液变浑浊,沉淀形成。滴加完成后,继续搅拌1 h。搅拌完成后,将混合液在室温下静置陈化,中途倒去上层清液并加去离子水至原来刻度,稍微搅拌再陈化,陈化时间共计2 h。陈化后倒去上层清液进行抽滤,并用去离子水洗涤滤饼至滤液呈中性,取滤饼在120℃下烘干后于马弗炉中500℃下焙烧4 h,即得载体。冷却后将其研磨至0.12 mm备用。
(2)制备Ca改性NiO/ZnO-Al2O3-SiO2吸附剂:用天平称取一定量Ca(NO3)2·4H2O和Ni(NO3)2·6H2O配制成溶液,向此溶液中加入已制备好研磨后的ZnO-Al2O3-SiO2载体,并在室温下搅拌2 h,形成均匀混合液。随后,称取过量无水Na2CO3配制成溶液,并将其用蠕动泵以一定速率滴加至持续搅拌的混合液中,使其中Ni2+和Ca2+沉淀。滴加完成后,继续搅拌2 h。搅拌完成后进行抽滤,并用去离子水洗涤滤饼至滤液呈中性,取滤饼在120℃下烘干后于马弗炉中500℃下焙烧2 h,冷却后将其研磨至0.12 mm,即得Ca改性NiO/ZnO-Al2O3-SiO2吸附剂。
1.2 还原与未还原吸附剂脱硫性能考察
模拟汽油脱硫过程考察在图1所示的自动小型固定床反应器上进行。实验的原料采用模拟汽油(正己烷+噻吩),其含硫量为800 μg·g-1。微型反应器内径为10 mm,恒温段为210 mm。
还原吸附剂反应吸附脱硫的具体操作步骤为:
(1)取2 g已制备好的粉末状吸附剂用0.25~0.45 mm的石英砂稀释至17 ml,装填至微型反应器恒温段。
(2)设定H2流量为150 ml·min-1,升温速率设定为10℃·min-1,待氢气压力升至2.0 MPa,反应器恒温段由室温升温至440℃,还原2 h。
(3)上述步骤结束后,调节载气压力将其上升为2.9 MPa,降低反应器温度至420℃、调节氢气流量为35 ml·min-1。待反应条件达到并稳定后,以0.5 ml·min-1的流速进料,每隔一定时间取样,样品密封后存放冰箱,待分析。
(4)反应结束后,停止进料,在载气保护下使设备降温,关闭反应装置,待设备冷却到常温后迅速取出吸附剂,在N2环境下密封保存用于检测。
未还原吸附剂的脱硫实验分为以H2为载气和以N2为载气进行,两者操作方式相同,只是载气不同,分别为高纯H2和高纯N2,且以两者作为载气反应时,吸附剂不先做任何预还原处理。
未还原吸附剂与还原吸附剂反应吸附脱硫的具体操作步骤差别为:按照同样方法将床层装填好后,不进行第(2)步操作,直接将H2或N2压力上升为2.9 MPa,将反应器温度以10℃·min-1的升温速率由室温升温至反应温度420℃。待反应条件达到并稳定后,调节H2或N2流量为35 ml·min-1。之后所有步骤不变,即未还原吸附剂反应步骤比还原吸附剂反应步骤仅缺少440℃下还原2 h这一操作;N2作为载气时,直接采用新鲜吸附剂进行反应操作,不做任何预处理。
样品中总硫含量的测定在Antek 9000NS荧光硫氮分析仪上进行,脱硫率用s表示,且按照式(1)进行计算
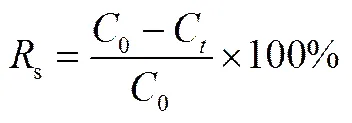
式中,0为原料油中的总硫含量,mg·L-1;C为反应进行到时刻时产物油中的总硫含量,mg·L-1。
吸附剂的动态穿透吸附硫容量按照式(2)进行计算

式中,breakthrough为吸附剂穿透吸附硫容量,mg·g-1;v为原料油进料流量,ml·min-1;为吸附剂的装填质量,g;0为原料油中的总硫含量,mg·L-1;s为脱硫率。
1.3 吸附剂表征
X射线衍射(XRD)表征:X射线衍射仪型号为D/max2550VB/PC。X射线管工作条件为:电压40 kV,电流100 mA,扫描角速度0.02(°)·s-1,衍射角扫描范围为10°~80°。
X射线能量色散谱(EDS)表征:能谱仪型号为美国EDAX公司生产的Falion 60S型,用于吸附剂表面元素的定性与半定量分析。
程序升温还原(TPR)表征:在型号为AutochemⅡ2920(Micromeritics, USA)的仪器上用H2吸附与脱附法测定吸附剂样品的还原性,用来研究还原过程中负载型金属催化剂中金属氧化物之间或者金属氧化物与载体之间的相互作用。
氢氧脉冲滴定分析(TOPT)表征:用来研究吸附剂的活性金属分散性,采用型号为Autochem Ⅱ2920(Micromeritics, USA)的分析仪进行测定分析。
X射线光电子能谱(XPS)表征:在型号为ESCALAB 250Xi的多功能光电子能谱仪上进行吸附剂表面元素的价态分析。
2 结果与讨论
2.1 不同载气下的吸附剂脱硫性能
以含硫量800 μg·g-1的模拟汽油(正己烷+噻吩)为原料,分别以N2或H2为载气(压力2.9 MPa),在反应温度420℃、H2与汽油体积比70、质量空速为9.9 h-1的条件下,对比考察吸附剂的脱硫效果,其中在H2载气中的反应又分为未进行还原步骤的反应和进行还原步骤的反应,结果如图2所示。
从图2中可以明显看出,未还原吸附剂以高纯N2作载气时,吸附剂具有明显的脱硫效果:在反应的初始阶段脱硫率接近以H2作载气的脱硫率,随着反应的继续进行,脱硫率逐渐降低,但在处理量达到100 ml·g-1时仍然具有30%的脱硫率。由于吸附剂未先做任何预还原操作,反应直接以高纯N2为载气,吸附剂中的NiO不可能被还原为单质Ni。因此可以推断在高纯N2载气中,吸附剂中的NiO主导着反应吸附脱硫过程。
图2中还可以看出,以H2作载气时,还原操作后的吸附剂与未还原的吸附剂脱硫效果相近,在处理量达120 ml·g-1时均未发生穿透。在反应的开始阶段,还原后的吸附剂脱硫率略低于未还原的吸附剂,随后脱硫率迅速增加到100%左右;而未还原吸附剂脱硫速度增加略显缓慢,但在第3个样品点时脱硫率也增加到100%附近。这说明吸附剂在H2气氛下440℃下还原2 h的操作对吸附剂的脱硫效果的提升基本无明显作用,还原吸附剂脱硫反应操作中的还原步骤并未起到应有效果。
从以上实验结果可以看出在N2载气中NiO主导着反应吸附脱硫过程,就脱硫效果而言,H2不是脱硫反应所必需的物质,但从吸附剂在N2载气中脱硫率随着反应的进行不断下降,H2载气中无论还原操作存在与否,脱硫率依然良好的趋势来看,H2的存在主要是避免吸附剂表面结焦而导致的吸附剂失活。
2.2 XRD
为考察所制备吸附剂中Ni元素形态在还原前后是否出现变化,采用XRD对新鲜吸附剂、还原后吸附剂和2.1中3种反应后的吸附剂进行表征,其中,还原后的吸附剂是采用实验固定床上进行原位还原操作而得到,即1.2中吸附剂反应吸附脱硫实验操作步骤(2),先采用高纯H2置换出固定床中空气,使整个床层置于高纯氢氛围中,并背压至2.0 MPa,待床层压力升至2.0 MPa,保持H2流量为150 ml·min-1,并将温度升至440℃后,在此条件下原位还原2 h,随后在H2保护下待床层温度降至常温,快速取出并在N2环境下密封保存,进行检测。表征结果如图3和图4所示。
从吸附剂制备方式可知,新鲜吸附剂中金属成分全部是以硝酸盐为原料,对应的金属离子在Na2CO3溶液加入后以碳酸盐或以水解后的氢氧化物沉淀形式存在。空气条件下,在马弗炉中500℃焙烧,载体与吸附剂中碳酸盐或氢氧化物分解为对应的金属氧化物,并以此形式存在于新鲜吸附剂中。
图3中新鲜吸附剂XRD谱图可知Ni与Zn都以金属氧化物形式存在。XRD谱图上没有检测到SiO2与Al2O3物相,说明SiO2与Al2O3以无定形形式存在于吸附剂中。新鲜与还原后吸附剂在2=43.2°,75.5°处均出现了NiO特征峰。还原后吸附剂中并未出现单质Ni(2=44.5°,51.4°,76.1°)的特征峰。Ryzhikov等[17]研究了H2预处理对Ni/ZnO吸附剂反应吸附脱除噻吩硫行为,认为H2对吸附剂中NiO的预还原对脱硫效果并没有提升,预还原反而会导致吸附剂形成Ni-Zn合金致使脱硫效果下降。文尧顺等[22]研究了反应吸附脱硫催化剂NiZnO/SiO2-Al2O3的还原过程,考察了还原温度、压力及还原时间对吸附剂的还原效果,发现在H2载气下,2.0 MPa,350℃下NiO并不能被还原为单质Ni,但仍有明显且较好的脱硫效果。上述实验结果也说明脱硫活性成分有可能为NiO。
图3的XRD结果表明,在440℃H2条件下还原后吸附剂XRD谱图上并未观察到任何Ni单质物相存在,表明吸附剂此温度下还原后NiO可能并未被还原成Ni单质。在Tang等[23]对NiO/ZnO吸附剂表征的XRD谱图中,无论是还原后还是反应后的NiO/ZnO吸附剂中均未发现单质Ni的物相存在,与本文有类似的实验结果。
图4中吸附剂经过3种不同条件下的脱硫反应后,吸附剂上均出现了ZnS特征衍射峰,表明吸附剂在高纯N2载气有脱硫能力,与图2中脱硫率结果一致。在H2载气中,无论进行还原操作与否,吸附剂在420℃,2.9 MPa的反应条件下反应后,XRD 谱图中均仍未出现明显的单质Ni的特征峰,说明该420℃,2.9 MPa的H2载气的反应条件,单质Ni可能并未被还原出来,且NiO的特征峰仍然明显,表明此时吸附剂中绝大部分Ni组分仍然以NiO的形式存在。以上结果都说明NiO也有着一定的脱硫作用。
结合图3与图4可以看出,新鲜吸附剂中ZnO的晶型弥散,在不同载气下反应后ZnO的特征峰均变弱,在2=27.25°,28.4°,47.6°处均出现了明显的ZnS特征峰,说明S元素会与ZnO结合,最终被固定在ZnS中,结果与Ryzhikov等[17]的研究结果一致。
2.3 EDS
为考察还原后与反应后吸附剂表面元素含量是否变化,对H2与N2载气中反应后的吸附剂进行分析,结果如图5所示。
图5中可以看出,在H2载气下,未还原与还原后的吸附剂反应后表面分别新增了6.55%(质量)和5.60%(质量)的S元素含量,均高于N2载气中反应后吸附剂表面新增的2.4%(质量)的S元素含量,这一结果和图2的脱硫率相吻合;N2气氛下反应后吸附剂表面新增的C元素含量达4.34%(质量),高于在H2载气下的未还原与还原后的两种吸附剂的表面积炭[分别为3.79%(质量)与3.61%(质量)],一方面说明H2载气可以明显抑制吸附剂的表面积炭,另一方面也说明了吸附剂在使用前是否还原并不影响吸附剂的表面积炭现象。

表1 吸附剂的Ni分散度TOPT表征
2.4 TOPT与TPR
为了分析新鲜吸附剂的还原情况,采用氢氧脉冲滴定法测定吸附剂活性金属分散度考察是否有单质Ni生成。表1列出了吸附剂的Ni金属分散度()、Ni比表面积(SANi)和Ni晶粒大小(MCS),由表1可知,NiO/ZnO-Al2O3-SiO2吸附剂的Ni金属单质分散度仅约为0.05%,比表面积仅0.3309 m2·g-1,几乎没有单质Ni。结合EDS谱图中吸附剂表面Ni元素含量百分比,相当于吸附剂表面Ni元素几乎全部为NiO形式存在。
为进一步确认吸附剂中脱硫作用的活性组分。对新鲜吸附剂进行H2-TPR表征实验,考察此吸附剂还原难易程度及还原温度。结果如图6所示。
从图6中结果可以看出,吸附剂只出现一个耗氢峰,特征峰温度约为598℃。由此可知,吸附剂NiO被还原的温度在600℃附近,而实验时所采用的S Zorb工艺条件下的还原温度只有440℃,在此温度下,粉末状NiO很难被还原成金属单质Ni。Shamskar等[24]研究了NiO在Al2O3表面上的还原情况,在H2-TPR表征中发现,不同焙烧温度(600~900℃)所制备而成的NiO/Al2O3固体粉末,随着焙烧温度的升高,所需还原温度也会随之升高。其在600℃下焙烧的NiO/Al2O3固体粉末TPR中所需还原温度超过700℃,本文吸附剂焙烧温度为500℃,TPR中还原温度约为600℃与其结论一致,440℃可能无法将吸附剂中NiO还原成单质Ni。
此外Escobar等[25]的研究认为,NiO的还原温度与其所依附的载体具有密切关系,NiO粒度越小,其与载体相互作用越强,就越难被还原,NiO团簇越大,越有机会接触到H2,从而发生还原反应。Tang等[23]在NiO/ZnO吸附剂的研究中,H2-TPR谱图中耗氢峰温度高达490℃,也超出440℃的还原温度。此外,结合XRD谱图发现,载体上所负载的NiO具有明显晶型,可见其尺寸相对较大,说明其被还原的可能性更高,但在H2-TPR图中并未发现在440℃下其有被还原趋势,可见,在440℃H2氛围下,NiO几乎难以被还原成单质Ni,反应脱硫过程中镍的形态仍为NiO。
S Zorb工艺[1]中再生器与反应器中间设置了还原器,再生后的吸附剂先经过还原器再进入反应器。从还原器的280℃左右操作温度来看,是无法将再生后的吸附剂进行还原的。多数实验[22-24]结果证明,镍负载型吸附剂在280℃下难以被还原成单质Ni。还原器的存在一是可以保证从再生器过来的再生吸附剂表面吸附的O2与N2完全脱除,置换成H2,并将再生吸附剂吹入反应器,还原器相当于在H2环境和O2环境中间的一道屏障,可以防止氧气串漏或者由于误操作直接进入氢气环境引起安全事故,在工程上保障了装置的操作安全性;二是可以使再生器过来的再生吸附剂中生成的Zn3O(SO4)2还原为ZnS和ZnO,提高吸附剂的穿透S容[26]。此外,该反应生成的H2O也可以及时排除,避免了H2O的存在降低吸附剂的使用效果和使用寿命。
2.5 XPS
采用XPS全谱图表征新鲜和还原后以及反应后的吸附剂,以C1s峰值285.4 eV来进行荷电校正,如图7所示。
从图7的XPS全谱图中可以看出,Zn、Ni、S均为2p能级,其中吸附剂无论是在H2还是N2载气中脱硫反应后,表面均有S元素存在,证明此吸附剂在H2与N2载气中均有固定S的功能。图中显示N2载气中反应后的吸附剂S峰较弱与N2载气下吸附剂的脱硫性能有关。为进一步分析此吸附剂中NiO在脱硫反应中的机理,本文对吸附剂中重要元素C、Ni、Zn、S作XPS窄谱分析,校正后各元素谱图如图8所示。
从图8中Ni元素的窄谱图中,新鲜吸附剂中位于855.1 eV与861.5 eV的谱峰属于NiO中Ni 原子2p3/2能级的分裂谱线;位于873.0 eV与879.7 eV的谱峰[27]属于NiO中Ni原子2p1/2能级的分裂谱线。值得注意的是,单质Ni的谱峰位于852.3 eV附近[28],比谱图中855.6 eV小得多,吸附剂进行还原操作后,谱图中并未出现单质Ni的谱峰,可见还原操作后并未有Ni单质生成或者单质Ni的生成量极其微少。另外,在H2与N2载气中脱硫反应之后,吸附剂的结合能在853.3 eV处均分裂出一个峰,根据Nesbitt等[29]的研究以及结合能表的查询结果[28],这个位置的谱峰是Ni元素在NiS中表现价态的峰。
从图8中C1s窄谱图中可以看出,在同一坐标下,反应后吸附剂中C1s峰强度明显比新鲜和还原后吸附剂的C1s峰强度大,说明采用模拟汽油脱硫后有积炭生成。又从全谱图中可以看出,C1s的峰强并不明显,说明生成的积炭含量并不多,与EDS结果一致。
在Zn的窄谱图中,新鲜吸附剂中位于1022.1 eV的谱峰属于ZnO中Zn原子的2p3/2能级,位于1045.1 eV的谱峰属于Zn的2p1/2能级,为Zn原子2p轨道的能级分裂峰。脱硫之后Zn2p的XPS谱峰位置向高结合能方向迁移,可能的解释是ZnO中Zn脱除O并与S元素结合,造成峰向高结合能方向偏移。此外S元素谱图中结合能为162.4 eV对应的谱峰为ZnS中的S2p[30]能级,也说明吸附剂反应后其中的ZnO向ZnS发生了转化,模拟汽油中脱除的S主要以ZnS的形式存在于吸附剂中,表明有部分ZnO向ZnS转化。
在S元素的窄谱图中,结合能为162.4 eV对应的谱峰为ZnS中的S2p[29],163.6 eV对应于NiS中的S2p[31],也说明中间产物NiS的存在。参考反应吸附脱硫过程[20-21]机理,在临氢条件下,形成的过渡态NiS会迅速与H2结合生成H2S,H2S再进一步与ZnO反应生成ZnS,由于此过程的速度非常快,所以在XRD谱图中并没有检测到非常明显的对应于NiS的特征峰。
2.6 NiO为有效成分的脱硫机理
Babich等[32]认为的含Ni吸附剂中单质Ni反应吸附脱硫的机理如图9所示。
图9中,新鲜吸附剂中NiO在H2载气下先被还原为单质Ni,然后单质Ni再与噻吩中S原子结合,进而进行脱硫步骤。根据本文以上分析和表征结果,可以认为吸附剂中的NiO也可以直接参与反应吸附脱硫。吸附剂中NiO进行反应吸附脱硫可能的机理如图10所示。
图10中吸附剂中NiO在未被还原的情况下负载在载体NiO/ZnO-Al2O3-SiO2表面,在一定的温度和压力下,噻吩中的S被NiO上的Ni原子吸附。由于Ni元素向S靠近,导致噻吩分子内一个C—S键大大弱化进而断裂。H2载气下,H2(N2载气下,为原料裂解产生的H2)与NiO中的O原子结合形成水脱去。S原子填补进入因脱水而失去O原子的Ni原子空隙,即NiO中脱除的O原子被噻吩中脱除的S原子所代替,形成NiS。随后NiS中S原子快速转移至载体中ZnO内,替换出的O原子进入Ni原子空隙内再次形成NiO。重新生成的NiO再次与噻吩分子进行反应,如此循环往复,进行脱硫反应。Mittendorfer等[11]经过DFT计算,认为Ni原子由于其空缺的d轨道,S原子在C—S键断裂后会进入Ni原子空隙形成NiS。Maldonado等[33]认为,NiO由于O原子的存在会降低其电子云密度,NiO的缺电子性会降低Ni原子表面的电子云密度,会使噻吩类硫化物中的硫原子与金属形成的S—Ni金属键强度受到影响,导致吸附剂脱硫能力降低,但其并未否认Ni2+的缺电子性。本文认为NiO的这种缺电子性仍然会吸引噻吩上比环上其他原子电负性较强的S原子,致使S原子进入NiO中Ni2+空隙,发生S、O原子的置换,从而进行后续反应步骤。
3 结 论
(1)吸附剂N2气氛下反应吸附脱硫结果表明:非临氢状态下的吸附剂中的NiO主导着反应吸附脱硫过程,说明H2气氛下反应吸附过程中吸附剂中的NiO与单质Ni可能共同参与反应。在420℃、氢气压力2.9 MPa、氢油体积比70、质量空速9.9 h-1的反应条件下,未进行还原操作的吸附剂同样具有较好的脱硫性能。
(2)XRD、H2-TPR和XPS等分析结果表明:在440℃下H2氛围中吸附剂中NiO难以被还原成单质Ni,也间接证明了吸附剂中NiO有一定的脱硫作用。在临氢环境下,不一定仅有单质Ni起到脱硫作用,而可能是NiO与单质Ni共同作用的结果。在此基础上建立了吸附剂中NiO可能的直接进行噻吩吸附反应脱硫的宏观反应步骤,新鲜和再生吸附剂无须进行H2还原活化操作,可直接脱除汽油中的含硫化合物。
References
[1] 侯晓明, 庄剑. S Zorb催化汽油吸附脱硫装置技术手册[M]. 北京: 中国石化出版社, 2013: 4, 19. HOU X M, ZHUANG J. Technical Manual of Adsorptive Desulfurization of Catalytic Gasoline[M]. Beijing: Sinopec Press, 2013: 4, 19.
[2] XU G T, DIAO Y X, ZOU K,Cause analysis of sorbent deactivation in S Zorb unit for gasoline desulfurization[J]. Petroleum Processing and Petrochemicals, 2011, 42(12): 1-6.
[3] 张欣, 徐广通, 邹亢, 等. S Zorb吸附剂中锌铝尖晶石形成原因的研究[J]. 石油学报(石油加工), 2012, 28(2): 242-247. ZHANG X, XU G T, ZOU K,Formation mechanism of gahnite in S Zorb sorbent[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2012, 28(2): 242-247.
[4] 付颖, 张欣, 邹亢, 等. PLS-XRD快速测量S Zorb再生剂中尖晶石含量[J]. 石油学报(石油加工), 2013, 29(3): 453-458. FU Y, ZHANG X , ZOU K,Fast determination of gahnite content in S Zorb regenerated sorbent by PLS-XRD[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2013, 29(3): 453-458.
[5] 张欣, 徐广通, 黄南贵. S Zorb吸附剂中硅酸锌的生成条件[J].石油学报(石油加工), 2013, 29(6): 619-625. ZHANG X, XU G T, HUANG N G. Formation conditions of willemite in S Zorb sorbent[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2013, 29(6): 619-625.
[6] LIN W, WANG L, TIAN H P. An analysis of the formation rate of zinc silicate of in S Zorb sorbents[J]. Petroleum Processing and Petrochemicals, 2011, 42(11): 1-4.
[7] XU H, YANG X Y, ZOU K,Effect of atmosphere on zinc silicate formation in S Zorb sorbent: an analysis of the formation rate of zinc silicate of in S Zorb sorbents[J]. Petroleum Processing and Petrochemicals, 2014, 45(6): 9-14.
[8] 龙军, 林伟, 代振宇. 从化学反应原理到工业应用(Ⅰ): S Zorb技术特点及优势[J].石油学报(石油加工), 2015, 31(1): 1-6. LONG J, LIN W, DAI Z Y. From detailed desulfurization mechanism to successful commercial application (Ⅰ): Features and advantages of S Zorb technology[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2015, 31(1): 1-6.
[9] 林伟. 氧化硅源和氧化锌颗粒大小对S Zorb吸附剂脱硫活性的影响[J]. 石油学报(石油加工), 2012, 28(5): 739-743. LIN W. Influence of silica precursor and particle size of zinc oxide on the desulfurization actirity of S Zorb sorbent[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2012, 28(5): 739-743.
[10] 尹海燕. 负载型金属氧化物反应吸附模型化合物及FCC汽油中硫化物的研究[D]. 青岛: 中国海洋大学, 2009. YIN H Y. Study on the reactive adsorption of sulfide from model compound and FCC gasoline on supported metaloxide[D]. Qingdao: Ocean University of China, 2009.
[11] MITTENDORFER F, HAFNER J. Initial steps in the desulfurization of thiophene/Ni(100)—a DFT study[J]. Journal of Catalysis, 2003, 214: 234-241.
[12] MITTENDORFER F, HAFNER J. A DFT study of the adsorption of thiophene on Ni(100)[J]. Surface Science, 2001, 492: 27-33.
[13] MITTENDORFER F, EICHLER A, HAFNER J. Structural, electronic and magnetic properties of nickel surfaces[J].Surface Science, 1999, 423: 1-11.
[14] 刘卉, 高金森, 赵亮. 吸附脱除噻吩类硫化物机理的研究进展[J]. 石油化工, 2010, 39(9): 1059-1065. LIU H, GAO J S, ZHAO L. Advances in adsorptive desulfurization mechanism for thiophene-type sulfide[J]. PetroChemical Technology, 2010, 39(9): 1059-1065.
[15] WANG L, ZHAO L, XU C,Screening of active metals for reactive adsorption desulfurization adsorbent using density functional theory[J]. Applied Surface Science, 2017, 399: 440-450.
[16] HUNTLEY D R, MULLINS D R, WINGEIER M P. Desulfurization of thiophenic compounds by Ni(111): adsorption and reactions of thiophene, 3-methylthiophene, and 2, 5-dimethylthiophene[J]. The Journal of Physical Chemistry, 1996, 100(50): 19620-19627.
[17] RYZHIKOV A, BEZVERKHYY I, BELLAT J P. Reactive adsorption of thiophene on Ni/ZnO: role of hydrogen pretreatment and nature of the rate determining step[J]. Applied Catalysis B: Environmental, 2008, 84(3/4): 766-772.
[18] BEZVERKHYY I, RYZHIKOV A, GADACZ G,Kinetics of thipphene reactive adsorption on Ni/SiO2and Ni/ZnO[J]. Catalysis Today, 2008, 130(1): 199-205.
[19] WANG G, WEN Y S, FAN J X,Reactive characteristics and adsorption heat of Ni/ZnO-SiO2-Al2O3adsorbent by reactive adsorption desulfurization[J]. Industrial and Engineering Chemistry Research, 2011, 50(22): 12449-12459.
[20] 高帅, 孟春, 周妮妮, 等. 钙改性NiO/ZnO-Al2O3-SiO2吸附剂反应吸附脱硫效果[J]. 华东理工大学学报(自然科学版), 2015, 41(4): 435-442.GAO S, MENG C, ZHOU N N,Reactive adsorption desulfurization of FCC gasoline over Ca-doped NiO/ZnO-Al2O3-SiO2adsorbents[J]. Journal of East China University of Science and Technology(Natural Science Edition), 2015, 41(4): 435-442.
[21] 周妮妮, 鞠峰, 高帅, 等. 钙改性NiO/ZnO-Al2O3-SiO2吸附剂成型后的反应吸附脱硫性能[J]. 华东理工大学学报(自然科学版), 2016, 42(5): 630-638.ZHOU N N, JU F, GAO S,Reactive adsorption desulfurization of gasoline overshaped Ca-doped NiO/ZnO-Al2O3-SiO2adsorbents[J]. Journal of East China University of Science and Technology(Natural Science Edition), 2016, 42(5): 630-638.
[22] 文尧顺, 王刚, 官中昊, 等. FCC汽油反应吸附脱硫催化剂NiZnO/SiO2-Al2O3的还原过程[J].石油学报(石油加工), 2015, 31(3): 760-768. WEN Y S, WANG G, GUAN Z H,Reduction process of NiZnO/SiO2-Al2O3catalyst for FCC gasoline reactive adsorption desulfurization[J].Acta Petrolei Sinica(Petroleum Processing Section), 2015, 31(3): 760-768.
[23] TANG M X, ZHOU L G , DUM X,A novel reactive adsorption desulfurization Ni/MnO adsorbent and its hydrodesulfurization ability compared with Ni/ZnO[J]. Catalysis Communications, 2015, 61: 37-40.
[24] SHAMSKAR F R, MESHKANI F, REZAEI M. Ultrasound assisted co-precipitation synthesis and catalytic performance of mesoporous nanocrystalline NiO-Al2O3powders[J]. Ultrasonics Sonochemistry, 2017, 34: 436-447.
[25] ESCOBAR J, REYES J A, VIVEROS T. Nickel on TiO2-modified Al2O3sol-gel oxides: effect of synthesis parameters on the supported phase properties[J]. Applied Catalysis A: General, 2003, 253(1): 151-163.
[26] 陈尧焕. 汽油吸附脱硫(S Zorb)装置技术问答[M]. 北京: 中国石化出版社, 2015: 17. CHEN Y H. Interigation and Reply of Adsorptive Desulfurization of Gasoline[M]. Beijing: Sinopec Press, 2015: 17.
[27] ERTL G, HIERL R, KNOEZINGER H,XPS study of copper aluminate catalysts[J]. Applications of Surface Science, 1980, 5: 49-94.
[28] 刘世宏, 王当憨, 潘承璜, 等. X射线光电子能谱分析[M]. 北京: 科学出版社, 1988: 319. LIU S H, WANG D H, PAN C H,X-Ray Photoelectron Spectroscopy Analysis[M]. Beijing: Science Press, 1988: 319.
[29] NESBITT H W, LEGRAND D, BANCROFT G M. Interpretation of Ni2p XPS spectra of Ni conductors and Ni insulators[J]. Physics and Chemistry of Minerals, 2000, 27(5): 357-366.
[30] 李亚玲, 王玉红, 甄崇礼. 纳米硫化锌的制备及光谱分析[J]. 光谱学与光谱分析, 2007, 27(9): 1890-1893. LI Y L, WANG Y H, ZHEN C L. Preparation and spectral analysis of nano zinc sulfide[J]. Scopy and Spectral Analysis, 2007, 27(9): 1890-1893.
[31] 王建祺. 电子能谱学(XPS/XAES/UPS)引论[M]. 北京: 国防工业出版社, 1992: 577. WANG J Q. Introduction of Electron Spectroscopy[M]. Beijing: National Defense Industry Press, 1992: 577.
[32] BABICH I V, MOULIJN J A. Science and technology of novel processes for deep desulfurization of oil refinery streams: a review[J]. Fuel, 2003, 82(6): 607-631.
[33] ARTURO J, MALDONADO H, YANG F H,Desulfurization of transportation fuels by adsorption[J]. Catalysis Review-Science and Engineering, 2004, 46(2): 111-150.
Mechanism of reactive adsorption desulfurization over NiO/ZnO-Al2O3-SiO2adsorbents
LI Kai, ZHAO Jigang, SHEN Benxian, LING Hao
(State Key Laboratory of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China)
The reactive adsorption desulfurization (RADS) of a model gasoline was investigated over a NiO/ZnO-Al2O3-SiO2adsorbent. N2and H2were used as carrier gases, and their desulfurization results were compared. Results showed that the adsorbent performed well when using N2as the carrier gas. Carbon deposition on the surface is the main reason of the drop of desulfurization efficiency. This indicates that NiO could directly react with sulfur compounds in gasoline without the presence of H2. Results of XRD, H2-TPR, TOPT and XPS showed that NiO is hard to be reduced under conditions of RADS. RADS process mainly depends on the reaction of NiO and Ni to remove sulfur compounds. At last, a possible RADS mechanism was presented and discussed.
reactive adsorption; desulfurization; carrier gas; NiO; mechanism
10.11949/j.issn.0438-1157.20170097
O 647.32
A
0438—1157(2017)08—3089—11
凌昊。第一作者:李凯(1990—),男,硕士研究生。
国家自然科学基金项目(21476081)。
2017-01-20收到初稿,2017-03-11收到修改稿。
2017-01-20.
Prof. LING Hao, linghao@ecust.edu.cn
supported by the National Natural Science Foundation of China (21476081).

