耐酸耐胆盐益生乳酸菌的筛选与鉴定
吕源玲
(江南大学食品学院, 江苏 无锡 214122)
耐酸耐胆盐益生乳酸菌的筛选与鉴定
吕源玲
(江南大学食品学院, 江苏 无锡 214122)
为了筛选出人源性的耐酸、耐胆盐的益生菌,利用含胆盐(0.2%)的5种选择性培养基(TPY、BHI、MRS、SL、乳酸杆菌选择性琼脂培养基),以溴甲酚紫为酸性指示剂,从婴儿粪便中初步筛选出42株耐胆盐的乳酸菌。根据菌株在pH 5.0,4.0,3.5的MRS液体培养基中培养时OD值的变化情况,筛选出3株具有较好酸耐受性的菌株。然后通过平板菌落计数方法测定筛选出的3株菌在pH 3.0条件下0~3 h存活率的变化情况,筛选出对酸和胆盐耐受能力最强且最稳定的菌株经16S rDNA分子生物学鉴定为Lactobacillusplantarum。该菌能够作为潜在的益生菌菌株用于后期深入地挖掘其益生功能。
乳酸菌;耐胆盐;耐酸;筛选;鉴定
作为人和动物肠道的正常菌群的益生乳酸菌,具有许多益生功效[1]。益生乳酸菌可以抑制腐败菌生长,提高人体免疫功能,延缓机体衰老,预防心血管疾病,还具有防癌、抗癌等功能[2]。
尽管益生乳酸菌具有很多有利于机体健康的功效,但是摄入益生菌制品并不意味着就可以获得这些功效。有报道[3]显示,不同人种的肠道菌群具有较大差异。而目前中国许多企业多以国外的菌种或非人类肠道来源的乳酸菌生产益生菌产品,没有考虑到不同人群对相同菌株的适应性的差异以及不同来源菌株对人体环境适应性的差异[4]。因此,在产品的开发和菌株的使用上可能存在一些盲点。
本试验旨在通过体外筛选出适合于亚洲人群的人源性的、对胃酸和胆汁具有一定耐受性的益生乳酸菌。从婴儿粪便分离获得大量的乳酸菌,并模拟胃肠道环境筛选出人源性耐酸、耐盐的益生乳酸菌,具有更加适应亚洲人群肠道环境、安全性高等优点,可以将其制成益生制剂直接应用于人体或应用于乳制品、禽畜饲养、水产养殖等领域,为进一步的乳酸菌生理功能的开发提供菌种资源储备。
1 材料与方法
1.1 材料、试剂与仪器
筛选来源:4名健康的婴儿,年龄为4~7个月,采样前1周内未服用过任何抗菌类药物;
石蕊、溴甲酚紫:分析纯,国药集团化学试剂有限公司;
MRS培养基、乳酸杆菌选择性培养基:生化试剂,青岛科园海博生物技术有限公司;
脑心浸液琼脂培养基:生化试剂,杭州天和微生物试剂有限公司;
TPY琼脂培养基:生化试剂,国药集团化学试剂有限公司。
酶标仪:imrk型,美国伯乐公司;
隔水式恒温培养箱:GHP-9160型,上海一恒科技有限公司;
基因扩增仪:Bio-rad S1000型,美国 Bio-Rad 公司;
电子显微镜:Quanta200型,美国FEI公司;
厌氧罐:3.380 102 AN AEROBIC型,德国Schutt Labortechnik GmbH公司;
凝胶成像仪:Gel Doc EZ型,美国伯乐公司。
1.2 试验方法
1.2.1 菌株的分离纯化 取5 g左右样品加入有玻璃珠的三角瓶中,加入90 mL 0.9 g/mL胰蛋白胨水进行稀释预处理,以300 r/min的速度振荡10 min。吸取1 mL粪便原液加入一支装有9 mL胰蛋白胨水的试管中,振荡混匀,作为10-1的稀释液,同样方法稀释至10-8。
采用稀释涂布平板法,将粪便原液及10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8稀释度的稀释液各取200 μL,均匀涂布于已含0.2%牛胆盐的TPY、BHI、MRS、SL、乳酸杆菌选择性琼脂培养基上。将平板倒置于厌氧罐(厌氧罐中放入含有10 g焦性没食子酸、25 g NaHCO3、250 mL蒸馏水的烧杯,并经过3次抽真空至-0.08 MPa、充氮气至0.02 MPa过程)中,放入37 ℃恒温培养箱中培养48 h。取出平板观察其生长情况,并挑出变红或变黄的菌落,制片并进行革兰氏染色,将油镜观察为紫色的革兰氏阳性菌在MRS平板上进行反复划线分离,倒置于厌氧罐中于37 ℃环境培养48 h。取出后挑取单菌落进行制片镜检,直至确定其纯化[5]。
1.2.2 石蕊牛奶试验 将纯化后的菌进行编号并挑取单菌落将其接种至MRS液体培养基中,37 ℃厌氧培养24~48 h制成菌液。将脱脂乳粉以1∶10 (g/mL)的比例与水混合溶解后,调pH值至7.2,以40∶1(体积比)的比例加入石蕊试剂,此时牛奶呈蓝紫色,分装后于115 ℃,20 min灭菌。以1%体积分数接种供试菌液于石蕊牛奶中,置于厌氧罐中于37 ℃环境培养48 h。取出观察,将产生凝乳现象并且能使牛奶变为粉红色的菌株初步确定为乳酸菌[6]。
1.2.3 耐酸试验 将保存的菌株接入MRS液体培养基中进行活化,并以一定顺序将菌液注入96孔板,每孔20 μL,再注入200 μL pH分别为5.0,4.0,3.5的MRS液体培养基,以250 r/min振荡5 min。置于37 ℃恒温箱进行厌氧培养,于0,4,6,8 h用酶标仪测量OD值。每个菌株至少做3个平行。使用OD值计算菌株在不同pH值培养基中的增长率:
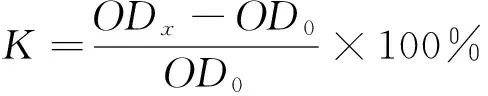
(1)
式中:
K——菌株增长率,%;
ODx——乳酸菌生长xh在600 nm下OD值;
OD0——乳酸菌生长0 h在600 nm下OD值。
1.2.4 菌株存活率计算 将得到的6株菌接种至MRS液体培养基,于37 ℃环境厌氧培养48 h,得到菌液。按5%体积分数将菌液接种至pH值为3.0的MRS液体培养基(MRS液体培养基经过115 ℃,20 min灭菌后,用浓度为0.1 mol/L的HCl调pH为3.0,分装试管),振荡。在0,1,2,3 h分别取出50 μL菌液至EP管中,加入450 μL 0.9 g/mL胰蛋白胨水进行稀释,以此类推制成10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8稀释度的菌液,每个稀释度分别取20 μL菌液在MRS平板上进行点种,倒置于厌氧罐中,放入37 ℃恒温培养箱中培养48 h,使用平板计数法测定活菌数并计算存活率,平行3次[7]。

(2)
式中:
R——菌株存活率,%;
N1——菌株处理后活菌数,CFU/mL;
N0——菌株初始活菌数,CFU/mL。
1.2.5 16S rDNA扩增方法 乳酸菌DNA的提取按照BIO BASICI INC.生产的基因组DNA提取试剂盒说明书的方法提取染色体DNA。用1%琼脂糖凝胶电泳检测片段大小是否正确,通过凝胶成像仪确定为乳酸菌后对其基因模块进行PCR扩增。PCR扩增采用50 μL体系,其中DNA模板1 μL,dNTP 5 μL、Taq酶1 μL、10×buffer 5 μL及基因模板2 μL,采用16S rDNA通用引物P1、P2,即R518(5'-ATT ACC GCG GCT GCT GG-3')和F357GC(5'- CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3')各1 μL,超纯水35 μL 。反应条件为:94 ℃ 2 min,95 ℃ 20 s→56 ℃ 30 s→72 ℃ 100 s进行30个循环,72 ℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR产物的片段大小是否正确[8-9]。将检验正确的样品4 ℃冰箱保存备用。
1.2.6 16S rDNA的序列测定及与标准株序列的比较 将PCR样品寄至上海华大生物工程有限公司测序,并通过登陆National Center for Biotechnology Information,运用Basic Local Alignment Search Tool软件将测序结果与Gene Bank中的标准菌株16S rDNA序列进行对比[10]。
2 结果与分析
2.1 耐胆盐菌株的分离
分离培养基MRS、SL、TPY、乳酸杆菌选择性琼脂培养基、脑心浸液琼脂培养基(BHI)均为以溴甲酚紫为酸性指示剂(pH 5.2~6.8,黄—紫)并且含胆盐的选择性培养基。因为乳酸菌分解代谢糖并且产酸,所以当菌落产酸时,培养基上就有颜色由紫色变为红色或黄色的菌落。挑取较大直径的红色或黄色的单菌落,对其进行革兰氏染色并镜检,筛选出G+。将在石蕊牛奶试验中能够凝乳并使蓝紫色牛奶变为粉红色的革兰氏阳性菌初步确认为乳酸菌[11]。
以下为几种典型的镜检结果,见图1。由镜检图片可观察出图1(b)、(i)及(g)的菌体为细长杆状。图1(d)显示的菌体与前者比较稍短且部分呈“Y”字形。而图1(a)中菌体为稍粗的杆状。从图1(c)、(e)、(f)及(h)中可观察出菌体为短杆状甚至接近球状。
2.2 耐胆盐菌在pH 5.0条件下的耐酸筛选结果
将分离出来的42株耐胆盐菌株接种到pH 5.0的MRS液体培养基,分别在0,4,6,8 h取样,用酶标仪检测在600 nm下的OD值,其中有10株菌的OD值增加。OD值变化的情况见图2。结果显示,10株待选菌株均能在pH 5.0环境下生长,OD值变化范围集中在6.71%~34.55%,其中EM5的增长率最大,达34.55%。由于菌株4-5、5-2的增长率较低,因此认为此2株菌其酸耐受能力不明显。最终选择8株菌进行pH 4.0的耐酸能力筛选。

图1 革兰氏染色结果(1 000×)

图2 pH 5.0环境下菌株生长情况
2.3 8株菌在pH 4.0条件下的耐酸筛选结果
从pH 5.0环境下筛选出的8株菌进行pH 4.0环境下的耐酸筛选。将8株菌接种至pH值已调至4.0的MRS液体培养基上,放入酶标仪测定其600 nm下0,4,6,8 h的OD值。筛选出在上述环境中能够生长的菌株共8株,OD值见图3。结果显示,8株菌在pH 4.0环境下均有生长。OD值变化范围集中在5.88%~54.58%,因此最终选择8株菌进行pH 3.5的耐酸能力筛选。同时,将此环境下菌株生长情况与pH 5.0培养基中试验菌株的生长情况进行比较,总体来说大部分菌株的OD值增长率呈减小趋势。
2.4 3株菌在pH 3.5条件下的耐酸筛选结果
由图4可知,在0~8 h在pH 3.5的MRS培养基中,筛选出在pH 3.5酸性环境下均能生长的3株菌,即5-5、EM5、EB 4。其中EM5在0~8 h内所增长的OD值幅度最大,达116.04%,说明它在pH 3.5条件下生长情况良好。以上3株菌对pH 3.5酸性具有一定耐受能力,有必要在pH 3.0的环境中继续培养,并作平板计数以测定0~3 h的活菌数和存活率,便于进一步作酸耐受性的评价。

图3 pH 4.0环境下菌株生长情况

图4 pH 3.5环境下菌株生长情况
2.5 3株乳酸菌的pH3.0 MRS培养液耐受性筛选试验结果
pH 3.0为耐受试验计划的最高酸度,不同菌株对酸的耐受性差异较大。经过pH 5.0,4.0,3.5的耐酸筛选后,筛选出的5-5、EM5、EB4。将供试菌株接入pH 3.0的MRS液体培养基中,37 ℃厌氧培养,分别于1,2,3 h取出部分菌液进行活菌计数并计算存活率。
由表1可知,不同菌株在pH 3.0环境中耐受性有较大差异,菌株对酸性环境耐受性随培养时间的延长而降低。在pH 3.0环境中生长1 h后,菌数下降都很明显,但是5-5菌株下降了5个数量级,而且在培养2 h后5-5菌株便不再存活,表明在较低酸性的环境不利于5-5的存活。EM5对酸的耐受性最强,在pH 3.0 MRS液体培养基中37 ℃厌氧保温3 h后存活率达到46%,EB4在2~3 h的存活率几乎为0,根据之前不同酸度下菌株的生长情况,选择对酸耐受性最强、最稳定的EM5作为分子生物学16S rDNA鉴定的对象。

表1 pH 3.0条件下存活菌数
2.6 扩增产物测序及分析
回收的扩增产物由上海华大生物工程有限公司测序。采用 BLAST将菌株EM5的16S rRNA序列进行比对,经比对后发现,与EM5 16S rDNA序列同源性最高者为Lactobacillusplantarum,相似性为99%,因此初步鉴定菌株EM5为一株植物乳杆菌(Lactobacillusplantarum)[12]。
3 结论
本研究从婴儿粪便中分离出42株耐胆盐的乳酸菌,对其进行了石蕊牛奶试验鉴定。以菌株的耐酸受性、OD值、存活率、活菌变化数等稳定性指标对菌株进行筛选,共筛选出在pH 3.5环境下能够生长的3株菌5-5、EM5、EB4。其中对酸和胆盐的耐受能力最强最稳定的是EM5,它在pH 3.0条件下培养1,2,3 h后的存活率分别为75%,64%,46%。对菌株进行16S rDNA鉴定,结果表明EM5与Lactobacillusplantarum同源性达到了99%[13-14]。
本研究发现EM5菌株对酸和胆盐的耐受性较高,具有进一步研究的可行性。由于该株乳酸菌是人源性的,具有公认的安全性,可以将其应用于乳制品、功能性益生菌制剂直接应用于人体,也可以制成其它市场所需的产品,为以后的乳酸菌生理功能的开发研究提供了新的菌种资源。
[1] SHIH F. Probiotics and prebiotics as functional food ingredients[J]. Nahrung Food, 2003, 47(5): 285-287.
[2] SEPPOS E Probiotics. An overview of beneficial efects[J]. Antonievan Leeuwenhoek, 2002, 82: 279-289.
[3] 张素霞. 酸乳中乳酸菌的筛选及乳酸发酵研究[J]. 乳业科学技术, 2007(5): 236-238.
[4] 刘燕. 高产胞外多糖乳酸菌菌株筛选与鉴定[J]. 乳业科学与技术, 2009(1): 21-25.
[5] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 84-100.
[6] 周雨霞, 王志峰, 柳翰凌, 等. 传统乳制品中潜在益生植物乳杆菌的体外筛选[J]. 中国乳品工业, 2006(2): 19-21.
[7] 高鹏飞, 孙志宏, 麻士卫, 等. 蒙古族儿童源益生特性双歧杆菌的筛选及鉴定[J] . 微生物学报, 2009, 49(2): 210-216.
[8] 汪川, 张朝武, 陈会超, 等. 两株耐酸耐胆盐人肠源菌株的鉴定及系统发育分析[J]. 四川大学学报, 2008, 39(2): 263-266.
[9] 张瑞强, 王红宁, 黄勇, 等. 牦牛肠道与粪便乳酸菌的分离鉴定及PCR-16S rDNA鉴定[J]. 中国兽医科学, 2006, 36(5): 381-385.
[10] CHEN Xia, SUN Zhi-hong, MENG He, et al. The acid tolerance association with expression of H+-ATPase in lactobacillus casei[J]. International Journal of Dairy Technology, 2009, 62(2): 272-279.
[11] 王兴洁, 魏超廖, 光敏, 等. 产γ-氨基丁酸乳酸菌的分离鉴定及发酵条件优化[J]. 食品与机械, 2016, 32(7): 40-44.
[12] 尹乐斌, 张臣飞, 孙菁, 等. 一株产细菌素乳酸菌的分离、鉴定及生物学特性研究[J]. 食品与机械, 2016, 32(3): 12-15.
[13] 许学伟, 吴敏, 阮红, 等. 嗜盐古生菌AJ4中BR蛋白基因部分片段和16S rRNA基因序列研究[J]. 中国生物化学与分子生物学报, 2004, 20(1): 55-60.
[14] 李丙超, 胡卫东, 唐文才, 等. 传统发酵香肠中菌种的分子生物学鉴定[J]. 食品与机械, 2015, 31(3): 20-22, 107.
Screening and identification ofLacticAcidBacteriawith acid and bile tolerance
LU Yuan-ling
(School of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China)
In order to screen human probiotics with the acid and bile resistant abilities, infant stool diluents were spread on five different selective ager plates including TPY, BHI, MRS and SL in this study. 42 strains of lactic acid bacteria with certain bile-tolerance were isolated by selective ager media for lactobacilli, supplemented with bile salt (0.2%) and bromcresol purple as an acid indicator. 3 strains of lactic acid bacteria with high acid tolerance were further selected from 42 strainsaccording to biomass of their cultured in the MRS liquid medium with pH 5.0, pH 4.0 and pH 3.5 respectively. Then the viability of these 3 strains in MRS medium with pH 3.0 was measured by plate colony count technique, resulting in one of them with the highest acid- and bile salt-tolerance. Then this strain was subsequently identified using 16S rRNA-based molecular biological approaches. The strain was molecularly identified to be.Lactobacillusplantarum. The strain could be used as a potential probiotic strain for late digging its probiotic function.
lactic acid bacteria; bile-tolerance; acid-tolerance; screening; identification
国家科技部863计划(编号:2007AA10Z353);江苏高校哲学社会科学重点基金项目(编号:2017ZDIXM035)
吕源玲 (1974—),女,江南大学工程师,硕士。 E-mail:383274108@qq.com
2017—03—02
10.13652/j.issn.1003-5788.2017.06.009

