肾移植术后患者西罗莫司血药浓度的测定
邹 静,肖洪涛,李晋奇,师健友,王 婷
(四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
肾移植术后患者西罗莫司血药浓度的测定
邹 静,肖洪涛,李晋奇,师健友,王 婷
(四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
目的 建立肾移植术后患者西罗莫司血药浓度的液相色谱-质谱联用(HPLC-MS)测定方法。方法选取服用FK506/CsA+西罗莫司+糖皮质激素三联免疫治疗的肾移植术后患者20例,采集西罗莫司谷浓度全血样本,以达那唑为内标,经沉淀蛋白及液液萃取处理后,经液相色谱分离,采用ESI离子源,以SIR正离子方式进行检测,检测离子为m/z 936.76(西罗莫司),m/z 338.26(内标)。同时将所建立的HPLC-MS法和微粒子酶免疫法(MEIA)分别测定肾移植患者全血西罗莫司浓度,评价两种分析方法测定结果的一致性。结果西罗莫司在0.2~100 μg/L范围内线性关系良好(r=0.9992),最低定量限为0.2 μg/L。日内、日间精密度均小于6%,方法学回收率为92.93%~102.98%。两种方法测得的数据相关系数为0.979(P<0.05),两组数据间存在相关性(n=20)。当西罗莫司浓度在1.9~11.1 μg/L时,两种方法测定的平均偏差为1.4 μg/L。结论本文建立的HPLC-MS测定方法快速、准确、灵敏、选择性高,适用于临床对西罗莫司的血药浓度监测;HPLC-MS法和MEIA法测定西罗莫司全血浓度存在相关性,同一份样本用MEIA测定的浓度均值比HPLC-MS法测定的值高。
西罗莫司;达那唑;高效液相色谱法-质谱联用;血药浓度监测;微粒子酶免疫法
西罗莫司(雷帕霉素)是由链霉菌属产生的大环内酯类抗生素,是一种疗效好、低毒、尚未发现有明显肾毒性的免疫抑制剂[1],因西罗莫司引起的可逆性副作用,如高脂血症、白细胞及血小板减少症、肺炎增加倾向等,在血药浓度由30 μg/L降至15 μg/L后均有好转[2],因此当器官移植后出现肝肾功能不全或他克莫司(FK506)、环孢霉素(CsA)不能达到理想的药物浓度时,西罗莫司是作为替换治疗或辅助治疗的最佳选择之一。
西罗莫司有效血药浓度范围窄,其口服生物利用度仅为14%~15%[3],且由于患者疾病状态、器官移植类型、年龄、剂量等因素在药物吸收和代谢上都可能存在个体差异,因此不易估计给药后的血药浓度。此外,治疗过程中的合并用药、影响细胞色素P4503 A酶系的药物都能引起血药浓度的改变。对大部分患者而言,药物的疗效、毒副作用与血药浓度成正相关,因此测定个体血药浓度以调整用药的剂量和次数、制定个体化治疗方案在临床上有着至关重要的意义。HPLC法测定西罗莫司浓度的方法已有文献报道[4~6]。但这些方法中有的采用较为昂贵的LC-MS/MS,有些尚需难以获得的特殊内标。本文建立用LC-MS法测定SRL的全血药物浓度,以满足医院对其进行血药浓度监测的日常需求。
1 资料与方法
1.1 一般资料
1.1.1 肾移植术后患者血药采集 2011年5月~7月选取服用FK506/CsA+西罗莫司+糖皮质激素三联免疫治疗的肾移植术后患者20例,年龄20~65周岁,处于肾移植稳定状态。患者口服西罗莫司剂量为1~2 mg/天,1次/天,西罗莫司血药浓度首次测定可在术后第7~10天后的谷值血药浓度,第1个月内每周测定1~2次,第2个月每周测定1次,之后每个月测定1次,采血时间为即将服西罗莫司前抽血。
1.1.2 试剂与仪器 西罗莫司测定试剂盒与西罗莫司质控及校准品系列,均为美国Abbott公司提供。Waters 2695高效液相色谱仪(美国 Waters公司),含系统控制器,四元低压梯度输液泵,全自动进样器,柱恒温箱,MassLynx4.0色谱数据工作站;色谱柱为Agilent Zorbax SB-C18(100×2.1 mm,3.5 μm);BP211D电子分析天平(德国沙多利斯公司);IMx分析仪(美国Abbott公司)。甲醇(色谱纯,美国Fisher公司),乙腈(色谱纯,美国Fisher公司);水为超纯水;对照品:西罗莫司对照品(批号:0709022P,纯度:99.5%,浙江省药品检验所);内标达那唑(I.S.)对照品(批号:100126-200402,供含量测定用,中国药品生物制品检定所)。
1.2 方法
1.2.1 色谱条件 流动相:H2O-乙腈-甲醇 (27:45:28,v/v);流速:0.2 ml/min,柱温:60 ℃。
1.2.2 质谱条件 电喷雾电离源(ESI+),采用选择离子监测模式同时测定西罗莫司([M+Na]+,m/z 936.76),内标达那唑([M+H]+,m/z 338.26);毛细管电压3.4 kV;椎孔电压(西罗莫司72 V,达那唑28 V);二级椎孔电压2 V;六级杆透镜电压0.2 V;源温度120℃;脱溶剂气温度350℃;脱溶剂气流量700 L/h;锥孔气流量50 L/h。
1.2.3 溶液、标准曲线和质控样品的配制 ① 对照品溶液:精密称取西罗莫司对照品5.03 mg(相当于西罗莫司 5.005 mg),以甲醇溶解,并定容于25 ml容量瓶中,混匀即成西罗莫司储备液(200.19 mg/L)。取西罗莫司储备液2.5 ml,以50%甲醇定容于50 ml容量瓶中,即得西罗莫司工作液(10.01 mg/L),置-30℃冰箱储存备用。②内标溶液:精密称取达那唑标准品5 mg,以50%甲醇水溶液溶解,并定容于25 ml容量瓶中,即得内标储备液(200 mg/L)。取内标储备液1 ml,以50%甲醇水溶液定容于50 ml容量瓶中,即得内标工作液(4 mg/L),置4℃冰箱储存备用。③标准曲线的制备:取西罗莫司工作液(10.01 mg/L)0.1 ml,置于10 ml容量瓶中,以空白人全血定容,混匀即得西罗莫司全血浓度100.1 μg/L,再以空白人全血按对倍稀释,配成各含50.05、20.02、10.01、5.005、2.002、1.001、0.5005、0.2002 μg/L西罗莫司的全血样品,置-30℃冰箱储存备用。④质控样品的配制。精密称取西罗莫司对照品4.97 mg(相当于西罗莫司4.945 mg),以甲醇溶解,并定容于25 ml容量瓶中,混匀即成西罗莫司储备液(197.81 mg/L)。取西罗莫司储备液2.5 ml,以50%甲醇定容于50 ml容量瓶中,即得西罗莫司溶液(9.89 mg/L),取9.89 mg/L的西罗莫司溶液0.08 ml,置于10 ml容量瓶中,以空白人全血定容,混匀即得西罗莫司全血高质控样品,浓度79.12 μg/L,再按此法配制得西罗莫司中质控样品(19.78 μg/L),低质控样品(0.495 μg/L),置-30 ℃ 冰箱储存备用。
1.2.4 样品预处理 取全血样品0.1 ml,加入25 μl内标工作液,漩涡混匀,加入5%ZnSO4、丙酮各150 μl,漩涡混匀 6 分钟后,12000 rpm,6 ℃离心 6 min,转移上清液于另一洁净圆底玻璃试管,加入4 ml叔丁基甲醚,漩涡萃取8 min,3000 rpm,6℃离心8 min,转移上层有机相于另一尖底试管;于(45±5)℃水浴通氮气流吹干。残渣加入80%甲醇120 μl旋涡混合1 min,加入环己烷2 ml旋涡萃取4 min,2200 rpm,6℃离心4 min,吸弃上层有机相,取下层水相10 μl进样。记录西罗莫司和内标离子流色谱图的色谱峰面积,计算西罗莫司和内标的峰面积比,从标准曲线求算样品中西罗莫司浓度。
1.2.5 方法学考察 ①标准曲线和线性范围:取标准曲线全血样品0.1 ml,加入25 μl内标工作液,按照“1.2.4样品预处理”进行操作,记录西罗莫司和内标离子流色谱图的色谱峰面积,以西罗莫司和内标峰面积比对应其浓度进行线性回归,考察线性。②精密度与回收率试验:取高、中、低质控样品各0.1 ml,于同批内连续测定5次,将记录峰面积比代入当日线性回归方程,计算西罗莫司浓度,以测得值与理论加入值之比计算方法学回收率,得到批内精密度与回收率;在不同天连续分3批每浓度各测定5次,计算批间精密度与回收率。③萃取回收率试验:按标准曲线方法配制并测定 100.1、10.01、0.495 μg/L三个浓度血样,每个浓度平行测定3份,所得峰面积与对照品溶液直接进样所得峰面积进行比较,计算萃取回收率。④基质效应:将高、中、低(79.12、19.78、0.495 μg/L)质控样品,按“1.2.4样品处理”操作,进样得峰面积A1,用相同体积的纯水代替空白全血,按“1.2.4样品处理”操作,记录色谱图峰面积A2,将A1与A2相除,即得绝对基质效应。⑤稳定性考察:根据样品测定过程中可能遇到的不稳定因素,实验先后考察了工作液-20℃保存的稳定性;全血样品在4℃放置7天的稳定性,和在-30℃保存0、8、14及30天的稳定性;全血样品反复冻融0、1、2次的稳定性;测定样品处理完后立即进样与室温放置4 h后进样的结果差异。
1.2.6 LC-MS法与MEIA法测定比较 目前,测定西罗莫司血药浓度的方法主要为免疫法和LC-MS法,因此将所建立的LC-MS法与微粒子酶免疫分析法(MEIA法)对同一样品的测定结果进行比较,考察两种测量方法的一致性。对于之前选择的20例肾移植术后患者,在采集谷浓度血样时,取其静脉血样2~3 ml,立即移入经EDTA处理的试管中,充分混匀,平均分为两份,分别采用LC-MS法和MEIA法进行测定。
MEIA法测定的主要步骤为:精确吸取样本全血150 μl加入离心管中,精确加入150 μl沉淀剂,振摇10秒,离心5分钟,转速10000转/分,取上清液150 μl置雅培IMx分析仪内,IMX分析仪将自动检测并打印结果。
1.3 统计学方法采用SPSS 19.0统计软件,以MEIA法所测的值为X变量,LC-MS法所测的值为Y变量,进行双变量相关分析,考察测定结果相关性。采用 MedCalc 17.4.4统计软件,进行 Bland-Altman分析,考察两个测量方法的一致性。
2 结果
2.1 方法专属性在选定测定条件下,根据质谱分析结果,进行SIR监测,西罗莫司和内标的m/z分别为936.76和338.26。空白血浆、西罗莫司和内标加空白血浆及血浆样品色谱图见图1~3。空白血浆中内源性杂质和代谢物不干扰西罗莫司及内标物的测定,保留时间分别为3.07 min和7.52 min。
2.2 方法学考察结果西罗莫司全血标准曲线回归方程:Y=7.63×10-3X+1.55×10-4(r=0.9992,weighting=1/X2)。表明西罗莫司在0.2002~100.1 μg/L范围内线性良好,最低定量限为0.2002 μg/L,其RSD为6.58%。萃取回收率试验结果显示,SRL萃取回收率为53.6%~58.9%。经试验测定计算高、中、低质控样品中基质效应分别为(97.01±6.52)%、(103.01±5.64)%及(93.0±8.25)%,RSD分别为9.3%、7.7%、11.1%。高、中、低质控样品精密度与回收率试验结果见表1。
稳定性考察结果显示,工作液-20℃冷冻保存29 d均能保持稳定,满足测定要求。西罗莫司全血样品在-30℃保存30 d,西罗莫司浓度结果稳定。对比测定冻融0、1、2次的全血样品以及4℃放置7 d的全血样品,测定结果表明,在冻融和4℃放置条件下西罗莫司浓度结果稳定。对比测定样品处理完后立即进样与室温放置4 h后进样,测定结果表明,预处理后残留物复溶后放置4 h西罗莫司测定结果稳定。
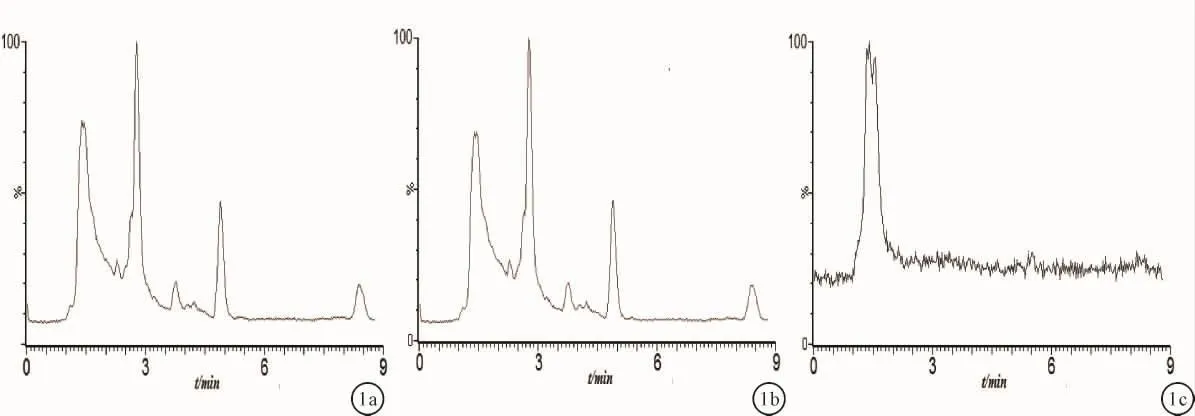
图1 LC-MS色谱图-空白全血 a:总离子色谱图;b:m/z 338.26色谱图;c:m/z 936.76色谱图;1:内标,2:西罗莫司
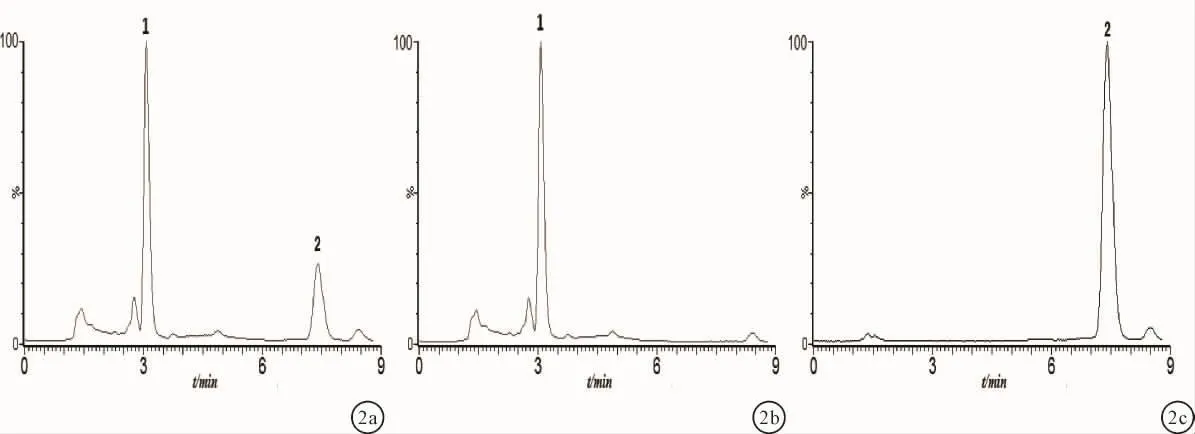
图2 LC-MS色谱图-空白全血加标液 a:总离子色谱图;b:m/z 338.26色谱图;c:m/z 936.76色谱图;1:内标,2:西罗莫司
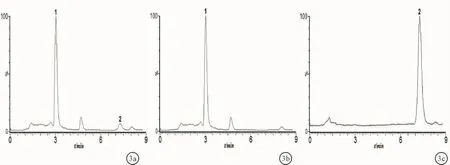
图3 LC-MS色谱图-肾移植术后患者口服西罗莫司后全血样品 a:总离子色谱图;b:m/z 338.26色谱图;c:m/z 936.76色谱图;1:内标,2:西罗莫司
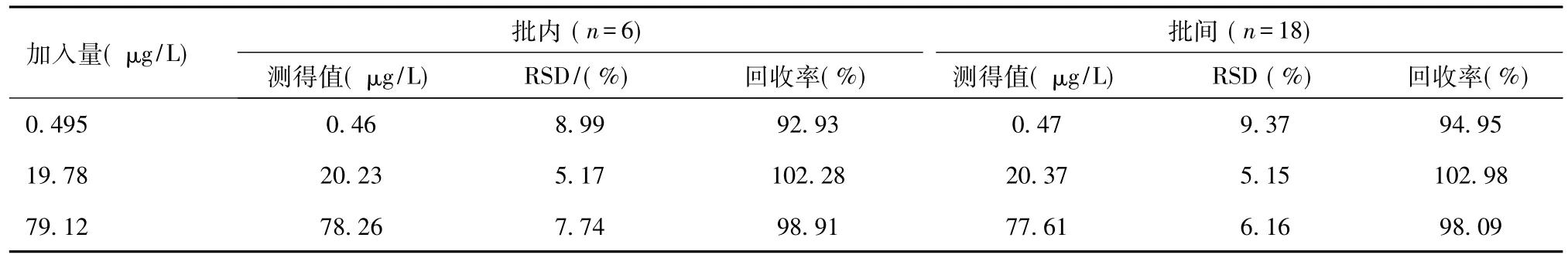
表1 SRL在人全血中的方法学回收率与批内、批间精密度 (n=5)
2.3 统计分析结果双变量相关分析得出,r=0.979(P<0.05),提示两组数据间存在相关性,回归方程为Y=0.729X+0.1021。收集的20份样本浓度在 1.9~11.1 μg/L,相对于 LC-MS,MEIA 的平均百分偏差为32.3%,平均偏差为1.43 μg/L。对两组数据进行Bland-Altman偏差分析,见图4。结果显示,同一份样本用 MEIA测定的浓度均值比HPLC-MS法测定的值高。
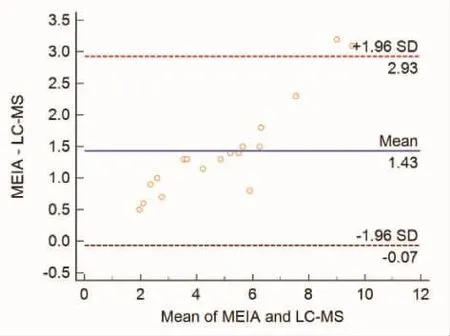
图4 两种方法测定数据的绝对平均偏差
3 讨论
因SRL的有效治疗浓度范围较低4~10 μg/L,因此SRL的测定方法必须考虑到检测灵敏度与分离效果的问题。目前微粒免疫测定法(MEIA)和高效液相色谱-串联质谱联用法(HPLC-MS/MS)常用来测定西罗莫司血药浓度,尽管HPLC-MS/MS分离能力好、高灵敏度且快速的仪器优势,但仪器昂贵的价格亦限制了其应用的普遍性,而在进行有效的样品预处理后,选择HPLC-MS进行检测,同样可以达到HPLC-MS/MS的检测灵敏度。故本文选择HPLC-MS法对西罗莫司的血药浓度进行了测定。
西罗莫司吸收入血后,95%分布于红细胞内,少部分与血浆脂蛋白结合[7],因此测定西罗莫司 的血药浓度需用全血。血样的预处理先必须充分破坏红细胞,并沉淀蛋白,使西罗莫司从中分离出来,便于提取,随后还须将全血中的各种内源性杂质进行去除,以避免干扰西罗莫司的测定。固相萃取办法虽高效、可靠,但成本过高;而直接沉淀蛋白法虽然简便,但提取物中内源性物质较多,基质效应较高,因此在样品预处理方法的建立阶段,作者参考国内外同行的已报道方法[6,8],并根据实验室现有条件,决定采用液液萃取方式处理样品,同时选择较易获取的达那唑作为内标,以提高本方法的通用性。作者对流动性的配比、色谱条件、质谱条件也进行了不断优化,最终确定的流动相、样品处理方法与质谱条件,进一步提高了本方法的灵敏度。
本研究还比较分析了MEIA与HPLC-MS两种方法测定结果的差异,并给出两种方法之间转换的定量关系,方便临床医生对TDM的结果解读;同时建立测定全血西罗莫司浓度的LC-MS法,可用于临床西罗莫司的浓度监测。体内西罗莫司主要经肝微粒体细胞色素P450酶系代谢为具有结构相似的去甲基化、羟基化成无免疫抑制活性的产物,而临床药理学活性主要由西罗莫司母药产生[9]。MEIA法是非特异性的,可与代谢产物发生交叉反应,与专门针对母体分子的LC-MS检测法相比,交叉干扰能够导致测定结果产生固定的正偏差[10]。本研究结果显示,MEIA法测定相对于LC-MS测定值明显偏高,与西罗莫司体内代谢特征及两种测定方法的原理相符合。
因此本文建立的LC-MS法测定肾移植术后患者西罗莫司血药浓度快速、准确、灵敏、选择性高,与Abbott IMx测定西罗莫司的免疫分析法比较均有较好的相关性,但LC-MS法能避免免疫分析方法中交叉免疫所造成的测定值偏高,更适用于临床对西罗莫司的血药浓度监测,尤其适用于肾移植术后以西罗莫司作为辅助用药时,西罗莫司血药浓度较低者的含量测定。
[1]Stepkowski SM,Chen H,Daloze P,et al.Rapamycin,a potent immunosuppressive drug for vascularized heart,kidney,and small bowel transplantation in the rat[J].Transplantation,1991,51(1):22-26.
[2]Hong JC,Kahan BD.Sirolimus induced thrombocytopenia and leukopenia in renal transplant recipients:Risk factors,incidence,progression,and management[J].Transplantation,2000,69:2085-2098.
[3]Kahan BD,Wong RL,Carter C,et al.A phase I study of a 42 week course of SDZ-RAD(RAD)quiescent cyclosporine-prednisone-treated renal transplant recipients[J].Transplantation,1999,68(8):1100-1106.
[4]Panos H,Dietrich AV.Evaluation of a cyano stationary phase for the determination of tacrolimus,sirolimus and cyclosporin A in whole blood by high-performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,809(2004):287-294.
[5]时颖华,李中东,施孝金,等.HPLC法测定人全血中西罗莫司的浓度[J].中国临床药学杂志,2004,13(2):76-78.
[6]黄明珠,胡兴江,陈俊春,等.西罗莫司全血浓度测定方法及临床应用[J].中国临床药理学杂志,2014,30(5):445-447.
[7]Yatscoff RW,Wang P,Chan K,et al.Rapamycin:distribution,pharmacokinetics,and therapeutic range investigations [J].Ther Drug Monit,1995,17(6):666-671.
[8]徐红冰,胡道德,陈桂良,等.HPLC法检测肾移植患者全血中西罗莫司的药物浓度[J].药学服务与研究,2004,4(2):152-154.
[9]Leung LY,Lim HK,Abell MW,et al.Pharmacokinetics and metabolic disposition of sirolimus in healthy male volunteers after a single oral dose[J].Ther Drug Monit,2006,28:51-61.
[10]Schmid RW,Lotz J,Schweigert R,et al.Multi-site analytical evaluation of a chemiluminescent magnetic microparticle immunoassay(CMIA)for sirolimus on the Abbott ARCHITECT analyzer[J].Clin Biochem,2009,42:1543-1548.
Determination of blood concentrations of sirolimus in patients after renal transplantation
ZOU Jing,XIAO Hong-tao,LI Jin-qi,SHI Jian-you,WANG Ting (Department of Pharmacy,Sichuan Academy of Medical Science & Sichuan Provincial People's Hospital,Chengdu 610072,China)
Objective To develop a HPLC-MS method for determination of blood sirolimus(SRL)concentrations in patients after renal transplantation.MethodsWe selected 20 patients who
a triple immunotherapy of FK506/CsA+Sirolimus+glucocorticoids after rental transplantation.The whole blood samples were collected.To determine the concentrations of SRL,danazol was used as the internal standard(IS),and SRL and IS were separated on a Zorbax SB-C18 Narrow Bore RR(100 × 2.1 mm,3.5 μm)with a mobile phase containing H2O-acetonitrile-methanol(27:45:28,v/v)at a flow rate of 0.2 ml/min and temperature of the column is 60 ℃following protein precipitation and a simple two-step liquid-liquid extraction procedure.The mass spectrometer was operated in the positive ion mode,and selective ion monitors(SIM)were at m/z 936.76([M+Na]+)for SRL and 338.26([M+H]+)for internal stand-ard,respectively.At the same time,a microparticle enzyme immunoassay(MEIA)was also used to determine blood SRL concentrations.The consistency of results by the HPLC-MS method MEIA was analyzed.ResultsCalibration curves were linear(r=0.9992)between 0.2 and 100 μg/L of SRL and the sensitivity was 0.2 μg/L.Intraday and inter-day precision was less than 6%.Analytical recovery ranged from 92.93%to 102.98%.The correlation coefficient of the two methods was 0.979(P<0.05)suggesting a close correlation between the two methods(n=20) .An average deviation of the two methods was 1.4 μg/L when blood SRL concentrations ranging from 1.9 to 11.1 μg/L.ConclusionThe HPLC-MS method described herein had been successfully applied for TDM in adult renal transplant recipients due to its low limits of quantification and stability.There is a correlation between the HPLC-MS and MEIA in determination of blood RSL concentrations.However,the average concentration values of the same sample are higher using MEIA when compared to HPLC-MS method.
Sirolimus;Danazol;HPLC-MS;TDM;MEIA
R965
A
1672-6170(2017)04-0036-05
2017-02-03;
2017-04-03)
2015年四川省人民医院青年基金立项资助项目(编号:2015QN05)

