超临界CO2萃取景天三七总黄酮的工艺优化
张兴桃,张东京,董 增,常志强,汤怀颍
宿州学院生物与食品工程学院,宿州,234000
超临界CO2萃取景天三七总黄酮的工艺优化
张兴桃,张东京,董 增,常志强,汤怀颍
宿州学院生物与食品工程学院,宿州,234000
以景天三七为材料,采用超临界CO2萃取技术提取景天三七总黄酮,设计单因素实验研究萃取温度、压力、夹带剂对总黄酮提取效果的影响,正交试验法研究超临界CO2萃取景天三七总黄酮的最佳工艺条件。结果表明,景天三七的总黄酮类化合物萃取的最佳条件为萃取压力300 Bar、萃取温度45℃、夹带剂为80%乙醇,总黄酮化合物的含量为19.54 mg/g,方差分析表明夹带剂和温度对提取效果影响显著。经重复性验证,该方法准确可靠,重现性好,结果稳定,适用于景天类植物总黄酮的提取。
景天三七;总黄酮;正交设计;超临界CO2萃取
景天三七(SedumaizoonL.)为景天科植物,味甘,微酸,是一种药用价值较高的保健植物,具有止血、消炎、镇痛等作用[1],有研究表明景天三七的有效主要成分是黄酮、景天庚糖、果糖和有机酸等[2]。总黄酮具有抗肿瘤、抗癌、清热解毒、护肝、延缓衰老等药用功能[3-4]。
超临界CO2萃取技术在中药有效成分的提取上具有操作简单、纯度高等诸多优点[5]。目前超临界CO2萃取景天三七总黄酮的研究较少,本研究旨在用正交设计法优化超临界CO2萃取工艺,确定提取景天三七总黄酮的最佳方案。
1 材料与方法
1.1 材 料
景天三七幼苗在光照培养箱中25℃培养至开花,材料为开花期前期的景天三七全草。
1.2 试剂与主要仪器
1.2.1 试 剂
无水乙醇、氢氧化钠、亚硝酸钠、盐酸、锌粉等(均为分析纯),芦丁标准品(100 mg,100080-201409,中国食品药品检定研究院),高纯度CO2。
1.2.2 主要仪器
超临界萃取系统(HA120-50-02,美国Water公司),紫外分光光度计(U-3100,日本岛津公司),冷冻干燥机(FD-2A,上海田枫实业公司),电子天平(FA2004N,上海圣科有限公司),旋转蒸发器(RE-5299,郑州亚荣仪器有限公司)。
1.3 方 法
1.3.1 景天三七的预处理
取花期的景天三七全草洗净,吸水纸吸水,放到-20℃冰箱中冷冻12 h,冷冻干燥机干燥,取出放入中药材粉碎机,过40目筛,密封,存放阴凉干燥处。每次分装1 g景天三七干粉用滤纸包好装入超临界CO2萃取萃取釜中,拧紧萃取盖,检漏。超临界CO2萃取工艺系统流程如下:

1.3.2 技术流程
粉碎干燥的景天三七→过筛→称3g→超临界CO2萃取→分离纯化总黄酮→鉴定→含量测定→确定最佳工艺。
1.3.3 芦丁标准曲线的制作
将芦丁标准品放入真空干燥箱中,120℃减压干燥至恒重,精密称取芦丁标准品20 mg,用60%乙醇溶解,摇匀,定容至100 mL,配成0.2 mg·mL-1的芦丁标准品溶液,作为标准品贮备液待用,避光放置。量取标准溶液0.0、1.0、2.0、3.0、4.0、5.0 mL,分别置于6支10 mL比色管中。在501 nm处测定吸光度,以吸光度为纵坐标、芦丁浓度为横坐标绘制标准曲线。
1.3.4 最佳测定波长的确定
精密量取配制的景天三七总黄酮溶液1.0 mL和芦丁标准液1.0 mL,分别放置于10 mL比色管中,用50%乙醇稀释至刻度5.0 mL,加入0.4 mL体积分数为5% NaNO2溶液,摇匀,静止5 min,加入0.4 mL 5% Al(NO3)3溶液,摇匀,静置5 min,再加4 mL 4%NaOH,用50%乙醇溶液稀释至刻度,摇匀,放置10 min。紫外分光光度计在300~600 nm之间进行波长扫描[6],在501 nm处找到最大吸收峰,确定该波长为最佳测定波长。
1.3.5 总黄酮含量的计算
分别在10 mL比色管中加入稀释10倍后的景天三七提取液0.0 mL与1.0 mL。在501 nm波长下测得吸光度A。将A代入芦丁标准曲线的回归线性方程中得出浓度,然后按照下列方程计算总黄酮的含量。根据数据得出用超临界CO2萃取黄酮类物质的最佳条件。
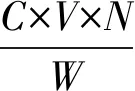
式中,P表示总黄酮含量(mg/g),C表示总黄酮浓度(mg/mL),N表示萃取液的稀释倍数,V表示萃取液的体积(mL),W表示景天三七原料投料量(g)。
1.3.6 单因素实验
以萃取压力、萃取温度、夹带剂浓度为3个单因素,每个因素分别设计5个水平,3次重复,其中一个因素改变,其他因素不变。设定萃取时的压力分别为150、200、250、300、350 Bar,设温度分别为35、40、45、50、55℃,夹带剂分别为体积分数为50%、60%、70%、80%、90%乙醇5个水平。
1.3.7 正交设计实验
以15 mL/min为流速,设置夹带剂浓度(80%乙醇、70%乙醇、60%乙醇)、萃取压力(200、250、300 Bar)和温度(40、45、50 ℃)为3个因素,设立3个水平。用正交软件进行方案设计,平行3次(表1)。

表1 正交因素水平表
1.3.8 景天三七萃取液的纯化结晶
采用超临界CO2萃取法得到景天三七总黄酮萃取液,然后将萃取液放入旋转蒸发器中,去除萃取液中的乙醇,得到总黄酮水溶液,最后将该溶液放入冷冻干燥机干燥至粉末,即得到总黄酮粉末。
1.3.9 黄酮类物质的鉴定
将冷冻干燥所得的总黄酮粉末置于50 mL小烧杯中,加入25 mL体积分数为50%的乙醇充分溶解,取适量的溶液置于10 mL试管中,滴加四五滴浓盐酸,摇匀后再加入适量锌粉,发生剧烈反应。根据HCl-锌粉的颜色反应,观察反应的颜色变化。黄酮类物质具有邻酚羟基,可与锌离子形成黄色或橙红色络合物,使用HCl-锌粉反应可以鉴别是否有总黄酮物质。
2 结果与分析
2.1 标准曲线
根据1.3.6的方法绘制标准曲线,回归曲线方程为y=0.0114x+0.015,其R2=0.9989(图1)。
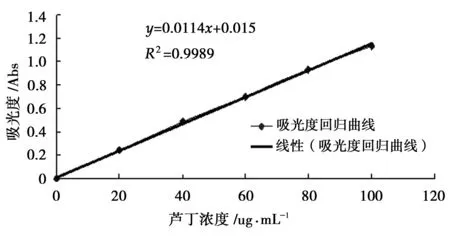
图1 芦丁吸光度标准曲线
2.2 单因素实验分析
2.2.1 温度对总黄酮萃取量的影响
温度为30℃~50℃时,总黄酮含量与温度呈正相关,温度为50℃时总黄酮含量最高为17.59 mg·g-1,表明总黄酮的量随萃取温度的升高而增加,但温度超过50℃时,总黄酮量呈下降趋势(图2)。
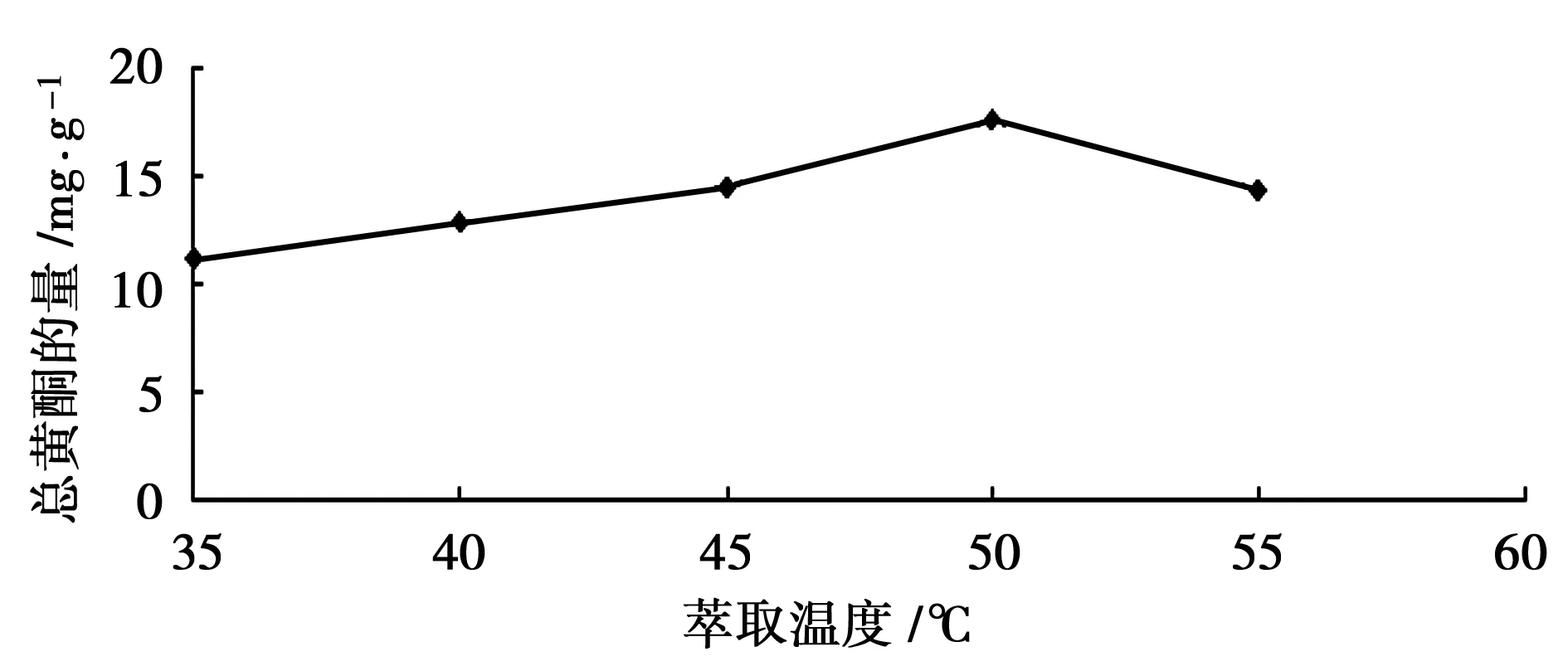
图2 温度对景天三七总黄酮萃取量的影响
2.2.2 夹带剂浓度对总黄酮萃取量的影响
乙醇浓度在50%~80%时,总黄酮含量不断上升。当乙醇浓度为80%时,总黄酮含量达到最高,为18.32 mg/g;当乙醇浓度超出80%时,总黄酮含量呈下降趋势(图3)。
2.2.3 萃取压力对总黄酮萃取量的影响
萃取压力200~300 Bar时,总黄酮含量上升较为明显;当萃取压力为300 Bar,总黄酮含量达到最高,为19.22 mg·g-1;萃取压力超过300 Bar时,总黄酮含量呈下降趋势(图4)。出现此类情况可能是:其他条件不变时,分子间平均自由程与压力呈负相关。但溶质与溶剂间亲和性增强,流体CO2的扩散与渗透能力增大,提高了超临界 CO2的溶解能力。
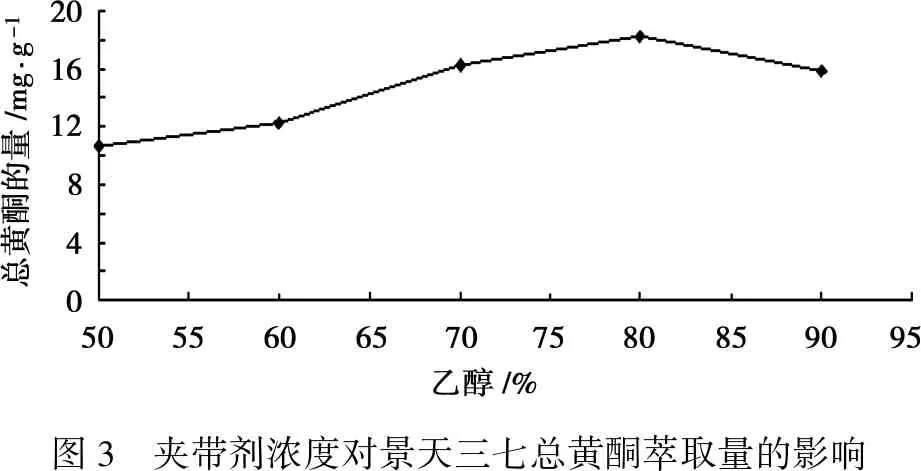
图3 夹带剂浓度对景天三七总黄酮萃取量的影响

图4 压力对景天三七总黄酮萃取量的影响
2.3 总黄酮鉴定
采用HCl-锌粉颜色反应鉴定景天三七总黄酮,所得结果如图5所示。

图5 正交试验提取物黄酮鉴定图
2.4 正交实验分析
根据统计学原理,极差越大,显著性越明显。A(乙醇浓度)极差最大,为5.804,可以判断夹带剂乙醇浓度对景天三七总黄酮萃取量的影响最大;B(萃取压力)和C(温度)极差值分别为1.860和0.927,对总黄酮萃取量的影响较小。最佳提取工艺条件80%的乙醇作为夹带剂、萃取压力300Bar、温度45℃条件下,总黄酮萃取量为19.54 mg/g(表2)。

表2 景天三七中提取总黄酮的正交设计直观分析
方差分析表明,该模型P温度=0.004<0.01,差异极显著;P夹带剂=0.002<0.01,P压力=0.015<0.05,表明萃取、夹带剂、温度对垂盆草总黄酮的提取影响极显著,压力的影响显著(表3)。
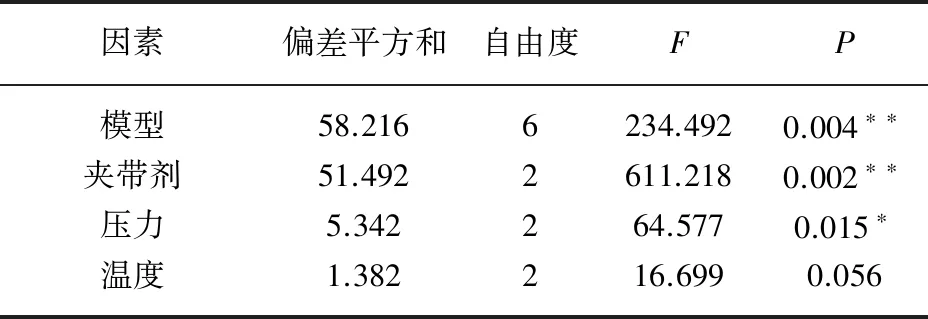
表3 景天三七中提取总黄酮的方差分析表
注:*表示P<0.05显著, **表示P<0.01极显著。
3 结 论
采用超临界CO2萃取法提取景天三七中黄酮类,并运用相应的软件对正交实验结果进行极差和方差分析,结果表明:对景天三七中总黄酮萃取量的影响程度从高到低依次为夹带剂浓度>萃取压力>萃取温度。以1.0 g样品计,景天三七总黄酮的最优提取工艺条件为萃取压力300 Bar、萃取温度为45℃,以80%乙醇为夹带剂,所提取出的总黄酮含量为19.54 mg/g。超临界CO2萃取法在提取景天三七总黄酮具有耗时短、无残留溶剂和重金属残留、纯度高等优点。
[1]谢宗万.中药材品种论述:上册[M].2版.上海:上海科学技术出版社,1989:79-80
[2]张晶晶,王晶,薛娇,等.费菜茎叶的化学成分[J].沈阳药科大学学报.2010,27(8):635-638
[3]李秋红,罗莉萍,叶文峰.超临界CO2萃取杜仲叶总黄酮的研究[J].食品科学,2006(12):536-538
[4]万茵,谢明勇,董欢欢,等.超临界CO2流体提取车前子总黄酮的工艺优化[J].南昌大学学报:理科版,200731(2):160-163
[5]公衍玲,黄山,于慧荣.垂盆草总黄酮的酶法提取及其抑菌活性[J].药学实践杂志,2010,28(2):114-115
[6]张珊珊,朱文娴,赵晓红,等.超临界CO2萃取北方地区早园竹叶中总黄酮的工艺优化[J].食品科学,2011,32(6):143-147
(责任编辑:汪材印)
10.3969/j.issn.1673-2006.2017.05.034
2016-12-10
国家自然科学基金项目(21107078),宿州学院区域发展协同创新中心课题(2015SZXTZXKFZD02、2015SZXTZXKF06)。
张兴桃(1978-),安徽宿松人,硕士,副教授,主要研究方向:植物分子生物学。
TS201.1
:A
:1673-2006(2017)05-0119-04

