杠板归总黄酮纤维素酶提取工艺的研究
薛天乐,孙 鹏,王 庆,丁 锐
亳州职业技术学院药学院,亳州,236800
杠板归总黄酮纤维素酶提取工艺的研究
薛天乐,孙 鹏,王 庆,丁 锐
亳州职业技术学院药学院,亳州,236800
[目的]:研究杠板归总黄酮的纤维素酶最优提取工艺。[方法]:分别考察酶浓度、提取时间、pH值、提取温度、料液比、乙醇浓度对杠板归总黄酮提取率的影响,并结合正交试验研究最优提取工艺。[结果]:最优工艺为酶浓度2 mg/mL,提取时间为30 min,pH5.5,反应温度65℃,液料比为40∶1,乙醇浓度为50%,在此工艺条件下,总黄酮提取率可达3.28%,比传统的水煎法和乙醇回流法分别提高了91.8%和44.5%。[结论]:此法可以用于杠板归总黄酮的提取。
杠板归;总黄酮;纤维素酶;正交试验
蓼科植物杠板归(PolygonumperfoliatumL.)为多年生蔓性草本,分布范围较广[1],具有清热解毒、利水消肿、止咳等功效,临床上常用于咽喉肿痛、肺热咳嗽、小儿顿咳、水肿尿少、湿热泻痢、湿疹、疖肿、蛇虫咬伤的治疗[2]。有研究表明,杠板归中黄酮类化合物的含量较高[3],具有保护肝脏的作用[4-5]。目前,关于杠板归总黄酮提取方面的报道不多[6-7],为此,本文采用单因素和正交试验相结合的方法,优选杠板归总黄酮纤维素酶提取工艺,旨在为杠板归的开发应用提供参考。
1 材料与仪器
1.1 材 料
杠板归(购自安徽省亳州市三义堂药业有限公司),芸香苷对照品(购自中国药品生物制品检定所),纤维素酶(购自湖南米纯生物科技有限责任公司,酶活力为10万U/g),其他试剂皆为分析纯。
1.2 仪 器
V5800型可见分光光度计(上海元析仪器有限公司),DFY-300型摇摆式高速粉碎机(温岭市林大机械有限公司),AUY-200型分析天平(津岛国际贸易有限公司),循环式多用真空泵(郑州长城科工贸有限公司),HH-4型恒温水浴锅(金坛市宏华仪器公司),RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂)。
2 方法与结果
2.1 标准曲线的绘制
准确称取5.5 mg芸香苷标准品,70%乙醇定容至50 mL的量瓶中,制成浓度为0.11 mg·mL-1的芸香苷标准液。准确吸取芸香苷标准溶液0.0,2.0,4.0,6.0,8.0,10.0 mL置于6支25 mL量瓶中,分别向每个量瓶加入1.0 mL 5% 亚硝酸钠溶液,混合均匀,静置6 min,再加入1.0 mL 10%硝酸铝溶液,混合均匀,静置6 min;加入10.0 mL 4%氢氧化钠溶液、70%乙醇定容,10 min后在510 nm波长处测定吸光度。以相应的吸光度为纵坐标,芸香苷浓度为横坐标,绘制标准曲线,芸香苷在浓度为8.8~44 μg·mL-1之间具有良好的线性(R2=0.9993),曲线方程为:y=11.74x+0.0705。
2.2 总黄酮的提取与含量测定
将杠板归粗粉1.0 g置于具塞锥形瓶中,按试验设计,以不同的条件进行提取,同法提取2次,过滤,合并滤液,减压浓缩,70%的乙醇定容至50 mL的量瓶中,取5.0 mL置于25 mL量瓶中,按“2.1”方法测定吸光度,并根据回归方程计算浓度,从而求得提取率。
总黄酮的提取率(%)=C×V×10-3/m×100%
式中,C为总黄酮的浓度mg/mL,V为溶液体积mL,m为称取的杠板归的质量g。
2.3 单因素实验
2.3.1 提取温度
控制液料比(mL/g)为30∶1,乙醇浓度为60%,酶用量为1 mg/mL,pH为4,提取时间为60 min,温度分别为35℃、45℃、55℃、65℃、75℃,按“2.2”方法测定总黄酮提取率。
由图1可知,提取率随着提取温度的升高表现出先增高后降低的趋势。这是因为随着温度的升高,纤维素酶的活性逐渐增强,但当温度超过55℃以后,纤维素酶开始失活,提取率也随之下降。
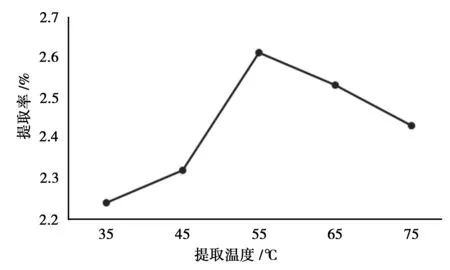
图1 提取温度的考察
2.3.2 提取时间
控制液料比(mL·g-1)为30∶1,乙醇浓度为60%,酶用量为1 mg·mL-1,pH为4,提取时间分别为30、60、90 、120、150 min,提取温度为55℃,按“2.2”方法测定总黄酮提取率。
由图2可知,随着提取时间的增加,总黄酮的提取率也增大,当提取时间达到60 min时,总黄酮的提取率达到最高。再继续增加反应时间,受热破坏而损失的总黄酮量也增加,提取率反而降低[8]。
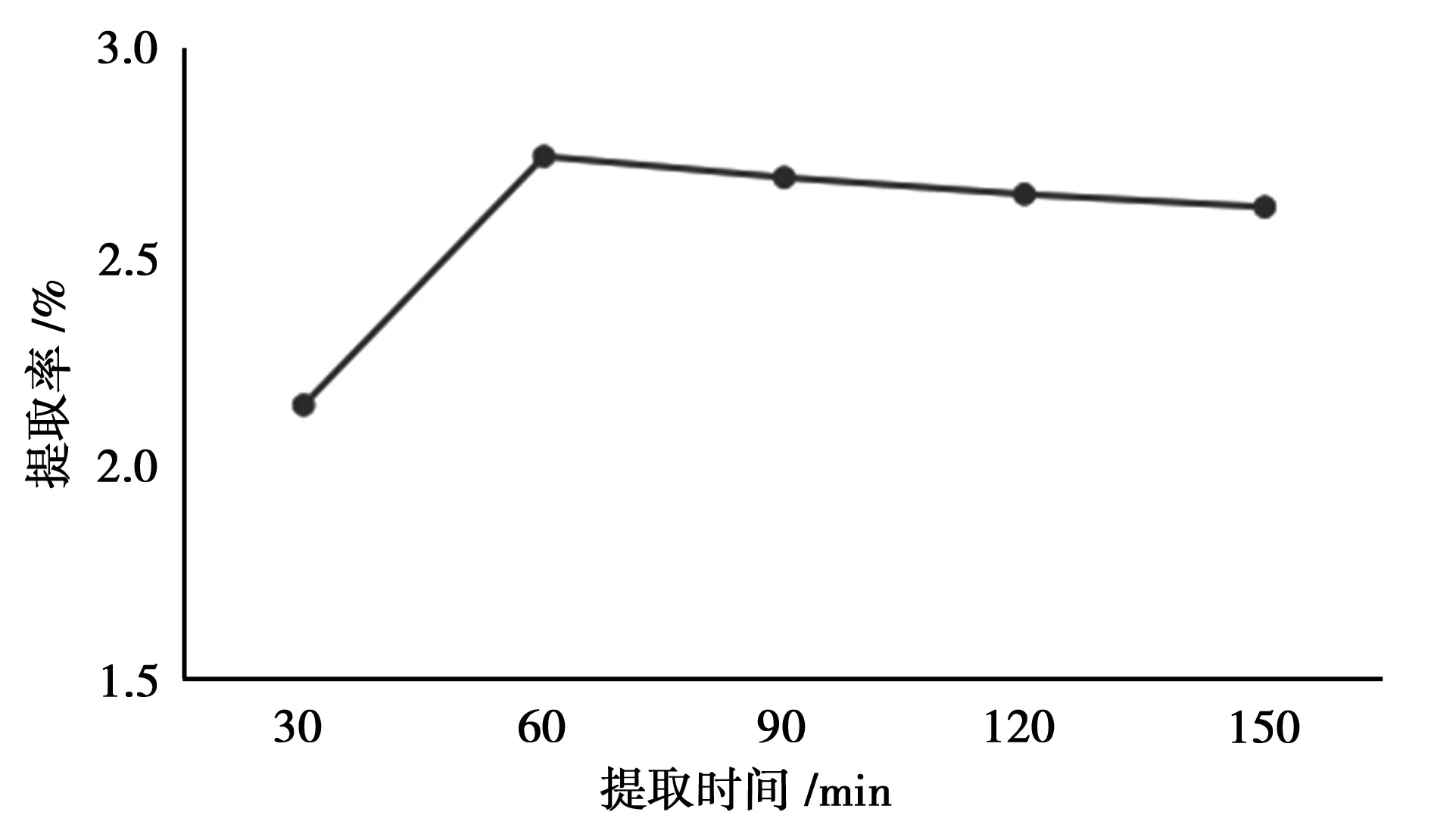
图2 提取时间的考察
2.3.3 酶浓度
控制液料比(mL/g)为30 ∶1,乙醇浓度为60%,酶用量分别为1、1.5、2、2.5、3 mg·mL-1,pH为4,提取时间为60 min,提取温度为55℃,按“2.2”方法测定总黄酮提取率。
由图3知,总黄酮的提取率随着纤维素酶浓度的增加而逐渐上升,当酶浓度达到2 mg·mL-1以上时,继续增加酶浓度,没有多余的底物与之结合,总黄酮的提取率不再上升。
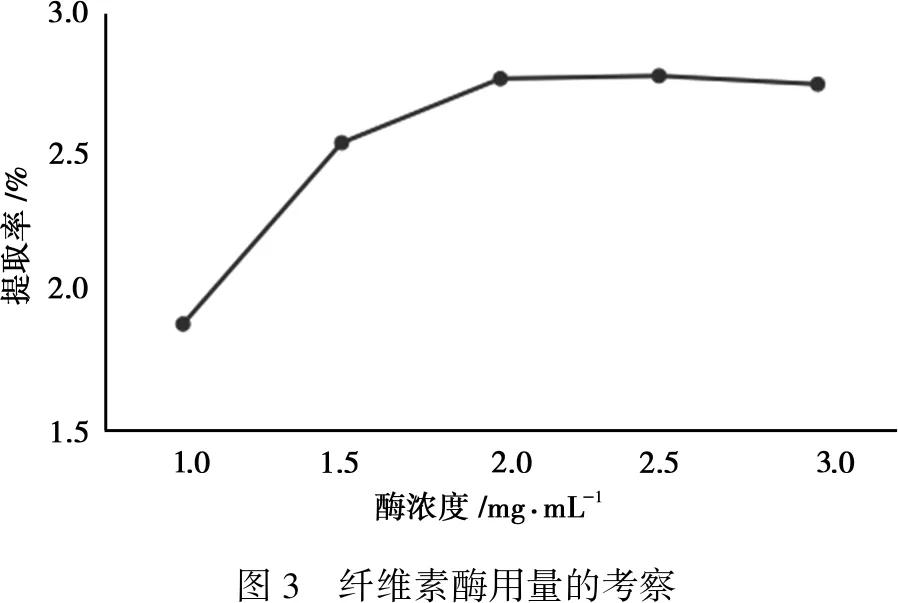
图3 纤维素酶用量的考察
2.3.4 液料比
控制液料比(mL/g)分别20∶1、30∶1、40∶1、50∶1、60∶1,乙醇浓度为60%,纤维素酶用量为2 mg·mL-1,pH为4,提取时间为60 min,提取温度55℃,按“2.2”方法测定总黄酮提取率。
由图4可知,总黄酮的提取率随着料液比增加而增加,当料液比达到40∶1以上时,总黄酮的提取率不再增加。
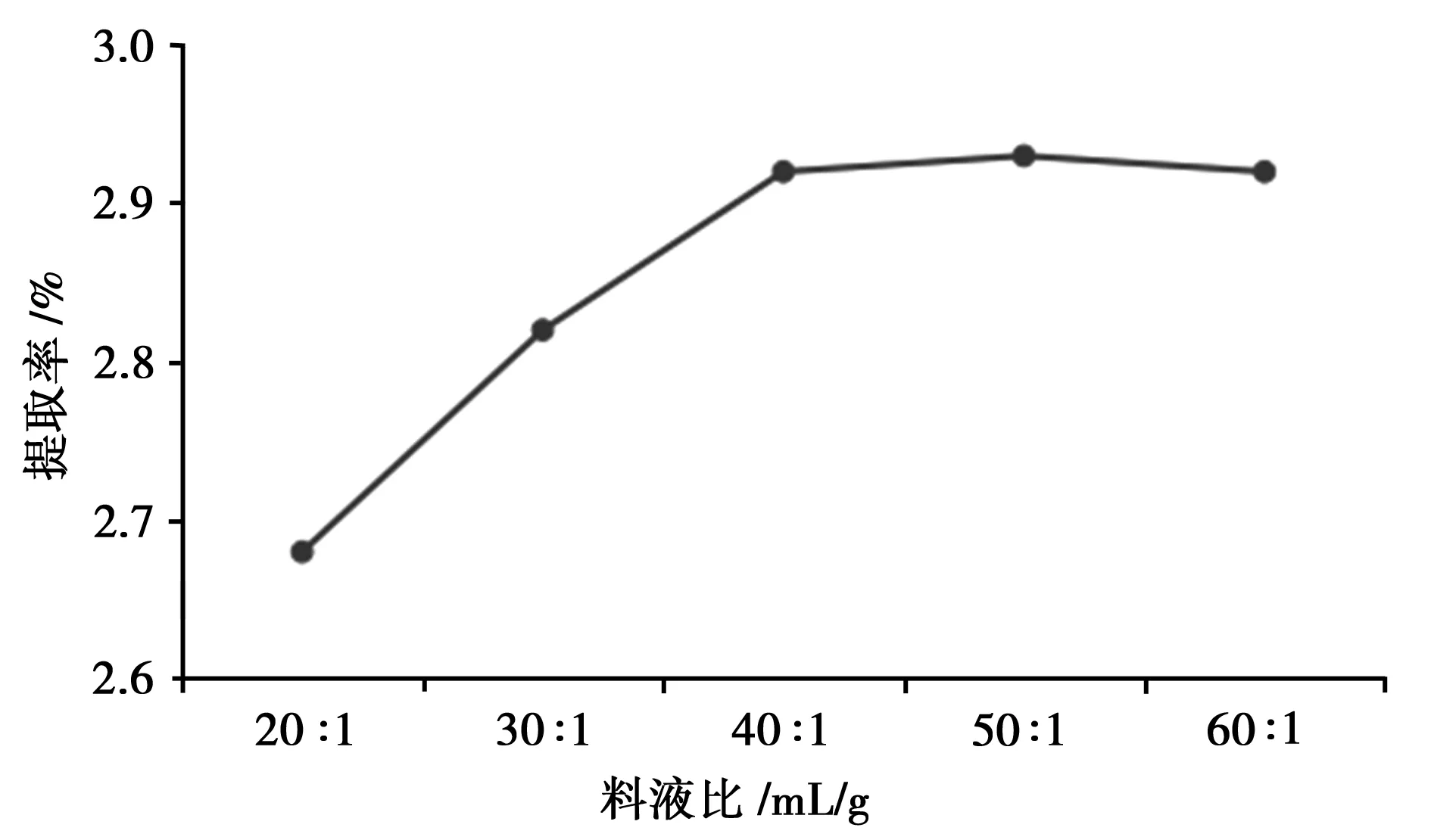
图4 料液比的考察
2.3.5 乙醇浓度
控制液料比(mL/g)为40∶1,乙醇浓度分别为30%、40%、50%、60%、70%,纤维素酶用量为2 mg·mL-1,pH为4,提取时间为60 min,提取温度55℃,按“2.2”方法测定总黄酮提取率。
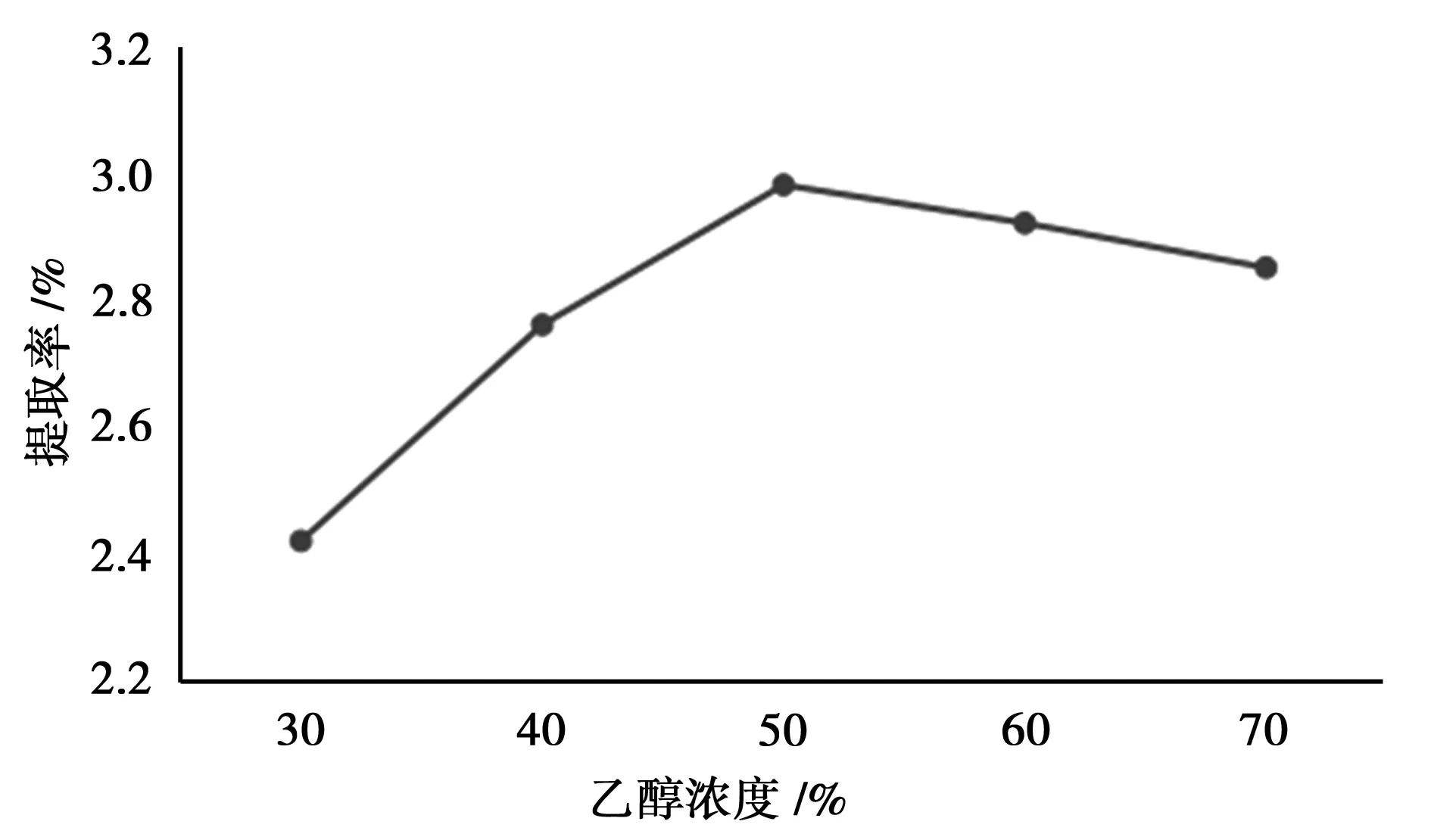
图5 乙醇浓度的考察
由图5知,提取率随乙醇浓度增加表现出先增加后降低的趋势,乙醇浓度为50%时提取率最大。这可能是乙醇浓度过高,一方面抑制了纤维素酶的部分活性,另一方面增加了一些亲脂性强的杂质成分的竞争性溶出[9]。
2.3.6 pH值
控制液料比(mL·g-1)为40∶1,乙醇浓度为50%,纤维素酶用量为2 mg/g,pH分别为3.5、4、4.5、5、5.5、6,提取时间为60 min,提取温度55℃,按“2.2”方法测定总黄酮提取率。
由图6知,当pH值增大至5.0左右时,总黄酮的提取率达到最大;再增大pH时,总黄酮的提取率开始降低,因此较为适宜的提取pH值为5.0。
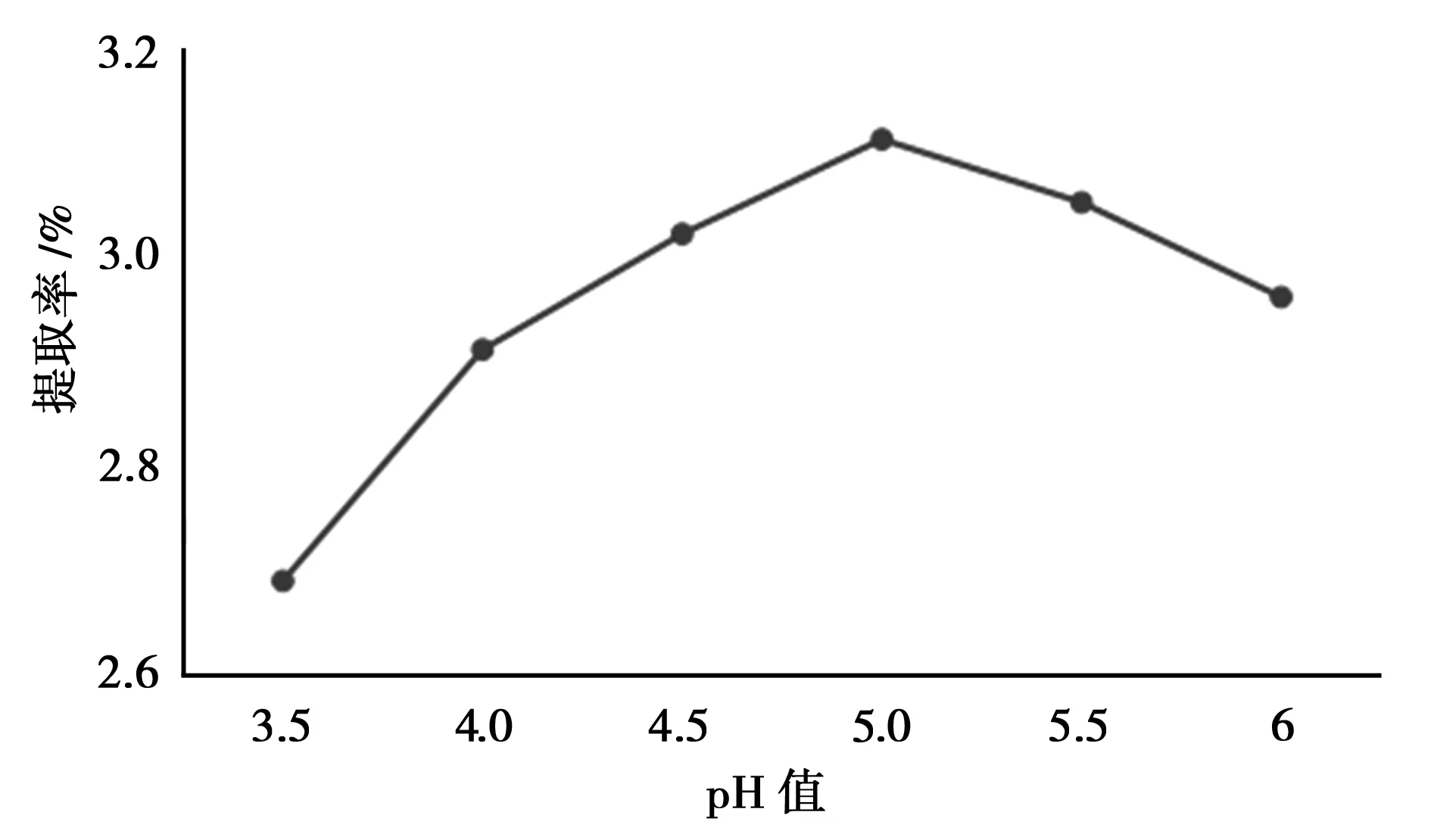
图6 pH值的考察
2.4 正交实验
选取酶浓度、提取时间、pH、提取温度四个因素设计正交实验,确定杠板归总黄酮的最佳提取工艺,结果见表1、2。
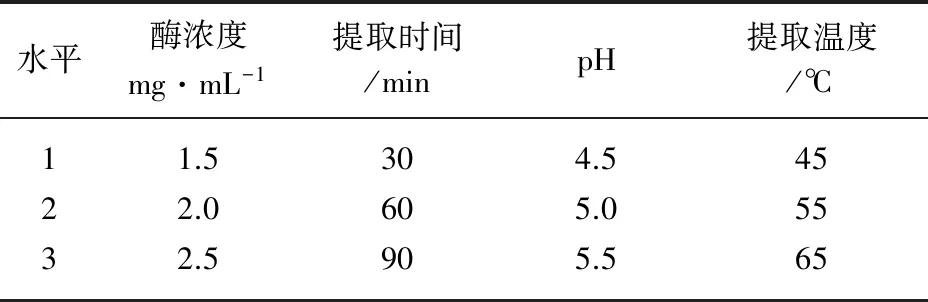
表1 正交试验因素水平表
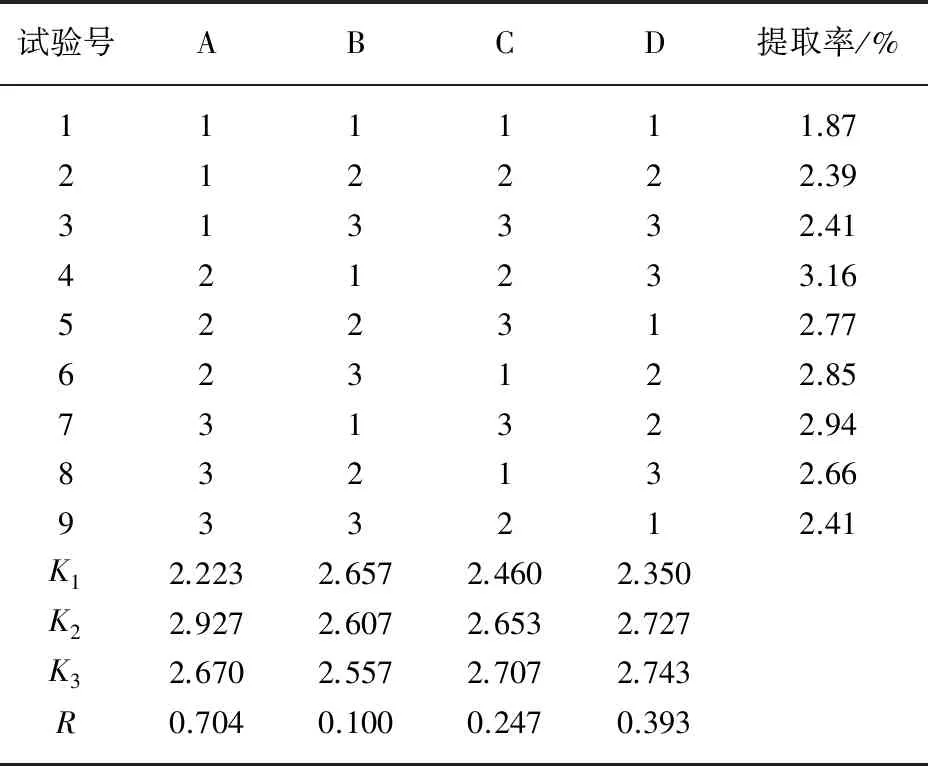
表2 正交试验结果
由表2知,影响杠板归总黄酮提取率的各影响因素主次顺序为酶浓度>提取温度>pH>提取时间。最佳试验组合为A2B1C3D3,即酶浓度为2 mg·mL-1,提取时间为30 min,pH值为5.5,反应温度65℃。
2.5 不同提取方法的比较
采用最佳提取工艺提取杠板归总黄酮,且与传统的水煎法和乙醇回流法进行对比,结果见表3。

表3 不同提取方法的结果比较
由表3知,在最佳提取条件下,杠板归总黄酮的提取率可达3.28%,分别比传统的水煎法和乙醇回流法提高了91.8%和44.5%。
3 结 论
本文采用单因素和正交试验相结合的方法,优选杠板归总黄酮纤维素酶提取工艺,结果表明:在酶浓度为2 mg·mL-1,提取时间为30 min,pH值为5.5,反应温度65℃,液料比为40∶1,乙醇浓度为50%的最优提取工艺条件下,杠板归总黄酮的提取率可达3.28%,显著高于水煎法和乙醇回流法。该工艺可以用于杠板归总黄酮的提取。
[1]邢煜君,王海燕,王俊霞,等.杠板归抗氧化作用及抑制α-葡萄糖苷酶活性[J].中国实验方剂学杂志,2011,17(2):189-191
[2]国家药典委员会.中华人民共和国药典:一部[M].北京:中国中医药科技出版社,2015:166-167
[3]张明,陈华国,赵超,等.杠板归中总黄酮的含量测定[J].中国实验方剂学杂志,2012,18(18):77-80
[4]韦日明,高雅,张可锋,等.杠板归总黄酮对小鼠酒精性肝损伤的保护作用[J].南方农业学报,2016,47(4):664-669
[5]高雅,李豪,钟明利,等.杠板归总黄酮抗肝纤维化大鼠的作用及其机制研究[J].华西药学杂志,2015,30(2):181-183
[6]朱良荣,陶锋.杠板归总黄酮不同提取工艺的比较研究[J].中国中医药科技,2016,23(3):296-298
[7]王希,王宗成.超声波辅助碱水提取杠板归中黄酮的工艺研究[J].广州化工,2016,44(16):57-59
[8]高旗,张竟怡,宁敏敏,等.微波提取陕南名茶中总黄酮的工艺研究[J].河北农业科学,2011(1):154-157
[9]毕洁,于丽娜.花生壳黄酮乙醇提取工艺探讨[J].现代化工,2008,28(2):316-319
(责任编辑:汪材印)
10.3969/j.issn.1673-2006.2017.05.033
2017-01-21
安徽省教育厅自然科学重点项目(KJ2016A500);亳州市中药科技创新团队(BZ2013zzb06)。
薛天乐(1981-),安徽亳州人,讲师,硕士,研究方向:中药活性成分提取与分离。
R284.2
:A
:1673-2006(2017)05-0116-03

