胶原蛋白肽金属螯合物及其生产制备工艺的研究进展
孙姗姗, 高亚辉, 陈俊德
1.厦门大学生命科学学院, 福建 厦门 361005; 2.国家海洋局第三海洋研究所, 国家海洋局海洋生物资源综合利用工程技术研究中心, 福建 厦门 361005
胶原蛋白肽金属螯合物及其生产制备工艺的研究进展
孙姗姗1,2, 高亚辉1, 陈俊德2*
1.厦门大学生命科学学院, 福建 厦门 361005; 2.国家海洋局第三海洋研究所, 国家海洋局海洋生物资源综合利用工程技术研究中心, 福建 厦门 361005
胶原蛋白肽金属螯合物是胶原蛋白肽与金属离子通过配位共价结合或吸附结合方式形成的螯合物。该螯合物作为金属矿物元素补充剂,具有生物利用率高、安全性高、生物活性高等优点。综述了胶原蛋白肽金属螯合物的螯合机理、稳定性、吸收利用、功能活性和生产制备工艺并展望了其开发应用前景,以期为相关研究提供参考。
胶原蛋白肽金属螯合物;螯合机理;生物活性;生产制备工艺
随着社会的快速发展,受膳食结构、生活环境、生活习惯等多种因素的影响,人们普遍存在缺乏钙、镁、锌、铜、铁等金属矿物元素的现象[1]。这些金属矿物元素存在于人体组织和体液中,不仅作为人体内酶反应的活化剂,而且是人体各种代谢功能中的调节剂,具有明显的营养作用和生理功能[2]。膳食金属矿物元素的缺乏会导致多种疾病[3~5],例如,缺铁会引起小细胞低色素性贫血、体力活动和耐力受损、儿童认知障碍[6,7];缺钙可能会对细胞内的代谢、骨骼生长、凝血、神经传导、肌肉收缩和心脏功能有影响,同时,会增加骨质疏松的风险[8];锌缺乏可能会引起侏儒病、皮炎、生长智力发育不正常、厌食症等[9];缺铜会导致贫血、骨骼改变、冠心病等[10]。为此,营养学家建议消费者在日常饮食中应选择富含金属矿物元素的食物[2]。因而,开发适宜的金属矿物元素补充剂具有重要的现实意义。
市售的金属矿物元素补充剂有三个发展阶段:无机矿物质添加剂、有机矿物质添加剂、蛋白肽(氨基酸)金属矿物元素螯合物。前两种矿物质补充剂虽能在一定程度上补充人体所需的金属矿物元素,但会与胃酸或者食物中的草酸结合形成沉淀,进而阻碍吸收;而有些则具有较强的碱性,会对人体的胃肠道产生较大的刺激。由于这两种矿物质补充剂具有较大的毒副作用,且在人体内的吸收利用效率低下[10],故开发高效无毒的第三代蛋白肽金属螯合物矿物元素补充剂成为该领域的研究热点。胶原蛋白中存在很多潜在的具有生物活性的肽段[11,12],低分子量的胶原蛋白肽容易被人体吸收,且具有显著地与二价金属矿物离子(如钙离子、铁离子、铜离子)结合的能力[13],其分子结构中的氨基、羧基、羟基、弧基等侧基在不同条件下可以与金属离子发生配位反应,形成稳定的螯合物[3~5]。形成的螯合物同时具有金属矿物质和胶原蛋白肽的功能[10],进入人体时,不受食物以及胃肠道环境的影响,可以直接通过主动运输的方式被人体吸收,提高了金属矿物元素的吸收利用效率[10]。因而,胶原蛋白肽金属螯合物具有生物效价高、吸收快、营养性强等特点,开发价值和应用前景巨大。本文拟从胶原蛋白肽金属螯合物的螯合机理、特性及其生产制备工艺等方面进行讨论,以期为相关研究提供参考。
1 胶原蛋白肽金属螯合物的螯合机理及特性
1.1 螯合机理
胶原蛋白肽金属螯合物的螯合方式主要为配位共价结合和吸附结合。胶原蛋白肽链上氨基酸的基团类型是影响螯合物配位共价结合的重要因素。胶原蛋白肽链氨基酸的氰基、羰基、氨基、羧基、羰基、羟基、巯基和亚氨基与钙离子(Ca2+)、铜离子(Cu2+)、锰离子(Mn2+)和锌离子(Zn2+)结合形成离子键或配位键,缓解金属矿物离子之间的拮抗作用,可确保螯合物的稳定性[14~18]。胶原蛋白肽链氨基酸序列也是影响螯合物配位共价结合的主要因素。胶原蛋白肽 GPAGPHGPPG和Ca2+、Fe2+和Cu2+的螯合能力分别为 11.52±2.23 nmol/μmol、1.71±0.17 nmol/μmol 和 0.43±0.02 μmol/μmol[4];GPYGPFGPWG和Zn2+的螯合能力为 56.74 μg/mg[19];GKTGWPG和Zn2+的螯合能力为 83.56 μg/mg[20];AGPAGPK与Ca2+的螯合能力为0.88±0.02 μg/mg[21]。此外,氯化钙晶粒能够通过吸附作用“嵌入”胶原蛋白肽的表面,形成胶原蛋白肽钙螯合物[15,22~23]。
1.2 稳定性
胶原蛋白肽的相对分子质量是影响螯合物稳定性的重要因素。蛋白肽和金属的螯合能力与肽的分子量之间存在线性关系,随着蛋白肽分子量的降低,螯合能力提高[24],但当蛋白肽的分子量降低到一定程度后,螯合物不稳定[25]。胶原蛋白肽的氨基酸残基、肽链氨基酸序列及空间立体结构亦是影响胶原蛋白肽金属螯合物稳定性的重要因素[26,27]。胶原蛋白肽的半胱氨酸(Cys)残基、组氨酸(His)残基、天冬氨酸(Asp)残基和谷氨酸(Glu)残基有助于提高胶原蛋白肽金属螯合物的稳定性[26,28~30]。而对于鳕鱼皮胶原蛋白肽金属螯合物,肽链氨基酸序列是影响其稳定性的首要因素,空间立体结构是次要因素[21]。
1.3 吸收利用
人体内存在着独立的小肽转运系统,具有转运速度快、耗能低、不易饱和等特点。当金属矿物离子和胶原蛋白肽螯合后,通过抑制刷状缘上肽酶的水解活性,防止肽的水解,肽作为金属矿物元素的配体,通过肽转运机制进入粘膜细胞。胶原蛋白肽金属螯合物以螯合态经过胃及小肠,不但能够被人体快速吸收,而且能够降低螯合物之间的金属矿物质的拮抗作用,提高其吸收利用率[31]。研究表明,肽金属螯合物的吸收率可高达90%以上,远高于传统金属矿物元素补充剂[32]。在胶原蛋白肽金属螯合物的利用方面,胶原蛋白肽钙螯合物的股骨钙含量、股骨指数、钙表观吸收率、钙保留率、提高骨密度能力、提高骨强度能力均高于传统的碳酸钙补充剂[10,33~34]。
1.4 功能活性
胶原蛋白肽金属螯合物具有多种功能活性。胶原蛋白肽-铬(Ⅲ)螯合物可以显著地降低血糖、增加肝糖原的合成并提高葡萄糖激酶的活性[35, 36],还能够显著提高小鼠肝脏内的超氧化物歧化酶(SOD)的表达[37]。胶原蛋白肽铁螯合物具有较强的清除二苯基苦酰肼基自由基(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)自由基的能力[38]。胶原蛋白肽-锌螯合物对大肠杆菌和金黄色葡萄球菌均具有抗菌活性,其抗菌活性优于其他类型的螯合物,且可随着锌含量增加而快速增加[39]。
2 生产制备工艺
胶原蛋白肽金属螯合物的生产制备工艺主要采用水相合成技术和固相合成技术。
2.1 水相合成技术
胶原蛋白肽金属螯合物的水相合成技术是指胶原蛋白肽和金属离子在溶液中,以离子态或者适当的电子排列发生螯合,在配体与金属离子之间形成配位键和(或)离子键,得到胶原蛋白肽金属螯合物[40]。水相合成技术是在胶原蛋白肽金属螯合物生产制备中最常用的方法。研究表明,利用水相合成技术生产制备金属螯合物,所发生反应的本质是溶液中的游离配体取代金属离子上配位水分子的过程。
影响螯合效果的因素主要有pH、原料配比、螯合时间和螯合温度等。本课题组在实验中发现,pH是影响螯合效果最重要的因素之一[41]。不同类型的胶原蛋白肽和金属离子螯合反应所需的最佳pH不同。当反应体系的pH偏低时,反应体系中多余的氢离子与金属离子竞争供电子基团(即胶原蛋白肽分子);当pH偏高时,反应体系中多余的羟基离子则与胶原蛋白肽分子争夺电子受体(金属离子),从而降低反应体系的螯合效率。此外,在螯合过程中,随着反应的进行,原料的结构和理化性质发生变化,需随时调节pH,保证反应体系处于最佳状态,以提高螯合效率。原料配比也是影响螯合效果的重要因素。螯合反应需要合适的原料配比(即胶原蛋白肽与无机盐的质量之比),过低配比会导致螯合反应生成的螯合物结构不稳定,过高的配比则会造成配位分子的浪费。此外,为了确定螯合的最佳工艺,还需要考察螯合时间和螯合温度对螯合效果的影响。目前,考察胶原蛋白肽金属螯合物的生产制备工艺时,通常以螯合率为指标,pH、原料配比、螯合时间和螯合温度为考察因素,利用单因素实验、正交实验或响应面实验、中心组合实验、最陡爬坡试验等多种分析方法确定胶原蛋白肽金属螯合物的最佳螯合工艺(表1)。水相合成技术因其工艺简单、成本低,成为胶原蛋白肽金属螯合物生产制备的主要方法。然而,该方法在反应过程中产生大量的盐类,影响其产品的附加值。为了提高胶原蛋白肽金属螯合物的产品质量和附加值,根据其产品特性,将目前国内外生产蛋白质、活性肽及其衍生物的关键技术应用到螯合物的生产制备上是十分必要的。如构建连续流离心、多级膜分离协同快速干燥集成工艺技术、规模化分离纯化,得到分子量集中的胶原蛋白肽金属螯合物;利用离子色谱、反相色谱等层析技术分离纯化,得到高附加值的胶原蛋白肽金属螯合物单体。
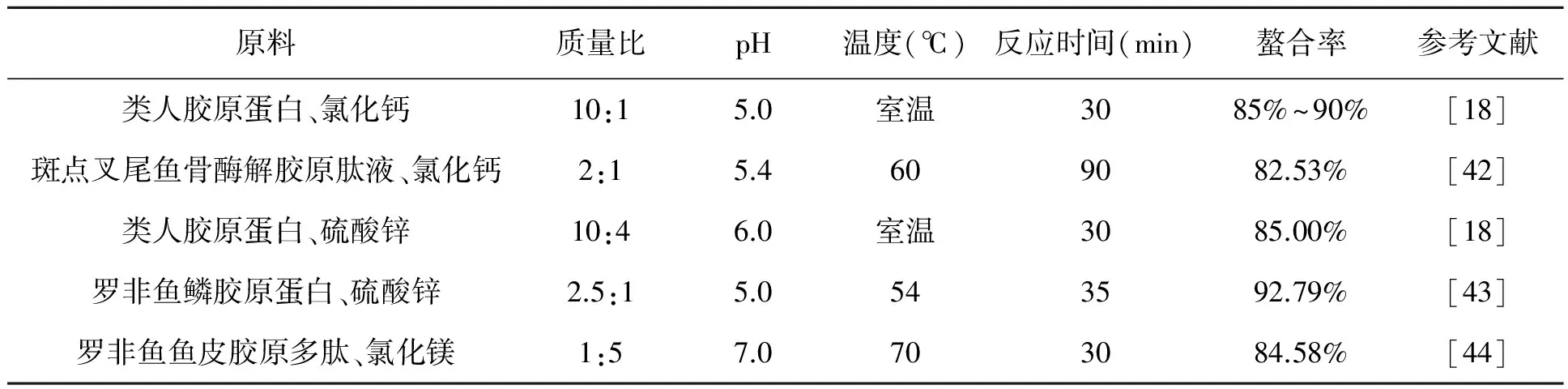
表1 多种分析方法确定的最佳螯合条件
除常规的水相合成技术外,磷酸化技术、硫醇化技术、超声技术也被应用到胶原蛋白肽螯合物的水相合成技术中。研究表明,与未磷酸化的类人胶原蛋白肽相比,磷酸化后的类人胶原蛋白肽与铁离子螯合,在结合位点和表观吸附常数上都显著增加[45];磷酸化后胶原蛋白肽螯合钙的螯合率远高于普通胶原蛋白肽螯合钙,吸收率远高于氯化钙和葡萄糖酸钙[46,47]。而硫醇化后的类人胶原蛋白,能提供更多的羰基、巯基基团与锌离子结合,与类人胶原蛋白相比,硫醇化类人胶原蛋白热力学性质更稳定,具有更好的生物相容性[48]。超声波的空化作用可以产生微冲流,能有效打破边界层,加快反应物的反应速度,提高胶原蛋白肽和金属离子的螯合率[49]。采用超声技术制备鱼胶原蛋白肽螯合锌,螯合率可高达96.07%,远高于传统的水相合成技术[50]。与传统的水相合成技术相比,超声技术具有反应时间短、螯合率高等特点。但该技术在规模化生产时,对厂房的安全措施、操作人员的安全意识要求较高。
2.2 固相合成技术
胶原蛋白肽金属螯合物的固相合成技术是指将固态胶原蛋白肽和含金属矿物元素的无机盐混合,经过螯合反应得到螯合物。水相合成技术主要用于制备生产溶解性良好的胶原蛋白肽金属螯合物,对于溶解性差和不溶的螯合物却无能为力。为解决水相合成技术在生产上的不足,开发了固相合成技术,用于制备生产溶解性差和不溶的胶原蛋白肽金属螯合物[51]。然而,传统的固相合成技术存在的反应转化率低等缺点,影响其产业化生产应用,使得微波固相合成技术生产制备溶解性差和不溶的胶原蛋白肽金属螯合物成为研究的热点。
胶原蛋白肽与金属离子的配比是影响微波固相合成螯合效果的关键因素。配比过低,合成反应生成的螯合物结构不稳定,容易降解;配比过高,导致螯合能力降低,生产成本增加。此外,微波辐射时间、微波合成功率、引发剂和脱酸剂的选择、反应物粒度等都会影响微波固相合成的螯合效果。如微波辐射时间过短,胶原蛋白肽金属螯合物的螯合率较低;若辐射时间过长,则易造成反应体系温度过高,热量无法快速释放,导致螯合物分解。因此,需加快微波固相合成的生产制备工艺技术的研发工作,以期生产出高质量、高附加值、低成本的螯合物产品[51,52]。如采用微波固相合成技术合成鳕鱼皮胶原蛋白肽锌螯合物,确定最佳反应条件为:微波时间105 s,微波功率252 W,胶原蛋白肽和硫酸锌质量比3∶1,合成的鳕鱼皮胶原蛋白肽锌螯合物的螯合率为29.34%[53];采用微波固相合成技术,制备真鲷鱼胶原蛋白肽-铬(Ⅲ)螯合物,确定最佳螯合条件为,微波功率为100 W,微波反应时间为5 min,配体与铬离子(Ⅲ)的摩尔比为1∶1[54]。微波固相合成技术具有缩短反应时间、提高原料的利用效率、减少能耗、减少废液排放等优点, 但该技术方法在规模产业化生产时需要制定严格的安全防护措施。
3 展望
近年来,营养素补充剂已经成为我国保健品领域的最快增长点之一,其市场需求呈快速增长的趋势。如此巨大的市场催生了大量的产品。随着竞争的加剧和广大消费者对保健产品认识的不断提高,高安全性、高生物利用度的胶原蛋白肽金属螯合物营养补充剂深受消费者的青睐,具有巨大的市场前景。然而,与美国、西欧等发达国家相比,我国的胶原蛋白肽金属螯合物营养补充剂行业尚处于初级阶段,行业集中度不高,产品同质化现象严重。造成该现象的原因在于:一方面,虽然我国高校、研究所在胶原蛋白肽金属螯合物的机理、稳定性、吸收利用和功能活性方面取得了丰硕的研究成果,然而,科研工作者对市场需求不甚了解,难以突破胶原蛋白肽金属螯合物行业存在的实现产业化的关键技术瓶颈;另一方面,我国企业家以市场需求为导向,在胶原蛋白肽金属螯合物生产制备工艺研究方面做了大量的工作,但由于缺乏基础理论支撑,开发高质量、高附加值的产品困难重重。因此,急需建立科研院所、高校和企业为主要支撑的产业技术联盟,发挥科研院所、高校和企业相互联合、优势互补的作用,将胶原蛋白肽金属螯合物的理论研究和生产制备工艺与规模产业化生产相结合,以期研发一批具有自主知识产权和国际竞争力的产品,进而带动我国营养素补充剂保健品产品集群的形成。
[1] 杨会成,李八方,董士远,等. 一种鱼皮胶原蛋白多肽螯合锌的制备工艺[P]. 中国:CN103626867A,2014-03-12.
[2] Keller J L, Lanou A J, Barnard N D. The consumer cost of calcium from food and supplements[J]. J. Am. Diet. Assoc., 2002, 102(11): 1669-1671.
[3] Guo H, Hong Z, Yi R. Core-shell collagen peptide chelated calcium/calcium Alginate Nanoparticles from fish scales for calcium supplementation[J]. J. Food Sci., 2015, 80(7): N1595-N1601.
[4] Guo L, Harnedy P A, O’Keeffe M B,etal.. Fractionation and identification of Alaska Pollock skin collagen-derived mineral chelating peptides[J]. Food Chem., 2015, 173: 536-542.
[5] Guo L, Harnedy P A, Zhang L,etal..Invitroassessment of the multifunctional bioactive potential of Alaska Pollock skin collagen following simulated gastrointestinal digestion[J]. J. Sci. Food Agric., 2015, 95(7): 1514-1520.
[6] Huang C Y, Wu C H, Yang J I,etal.. Evaluation of iron-binding activity of collagen peptides prepared from the scales of four cultivated fishes in Taiwan[J]. J. Food Drug Anal., 2015, 23(4): 671-678.
[7] Bass J K, Chan G M. Calcium nutrition and metabolism during infancy[J]. Nutrition, 2006, 22(10): 1057-1066.
[8] Maret W, Sandstead H H. Zinc requirements and the risks and benefits of zinc supplementation[J]. J. Trace Elem. Med. Biol., 2006, 20(1): 3-18.
[9] Megías C, Pedroche J, Yust M M,etal.. Affinity purification of copper chelating peptides from chickpea protein hydrolysates[J]. J. Agric. Food Chem., 2007, 55(10): 3949-3954.
[10] 马志英,沈亚领,沈菊泉,等. 一种胶原多肽螯合钙的制备方法[P]. 中国:CN102309008A,2012-01-11.
[11] Banerjee P, Shanthi C. Cryptic peptides from collagen: a critical review[J]. Protein Peptide Lett., 2016, 23(7): 664-672.
[12] Pal G K, Suresh P V. Sustainable valorisation of seafood by-products: recovery of collagen and development of collagen-based novel functional food ingredients[J]. Innov. Food Sci. Emerg., 2016, 37: 201-215.
[13] Nakchum L, Kim S M. Preparation of squid skin collagen hydrolysate as an antihyaluronidase, antityrosinase, and antioxidant agent[J]. Prep. Biochem. Biotech., 2016, 46(2): 123-130.
[14] 汤克勇. 胶原物理与化学 [M]. 北京: 科学出版社, 2012.
[15] 祝德义, 李彦春, 靳丽强, 等. 胶原多肽与钙结合性能的研究[J]. 中国皮革, 2005, 34(3): 26-29.
[16] Zhu C, Sun Y, Wang Y,etal.. The preparation and characterization of novel human-like collagen metal chelates[J]. Mat. Sci. Eng. C-Mater., 2013, 33(5): 2611-2619.
[17] Yu Y Y, Fan D D. Coordination study of recombinant human-like collagen and zinc (II) [J]. Spectrochim. Acta A(Mol. Biomol.), 2011, 81(1): 412-416.
[18] 俞园园. 类人胶原蛋白—锌螯合物的制备及相关研究[J]. 中国食物与营养, 2013, 19(8): 46-49.
[19] 迟长凤, 王 斌, 陈 荫, 等. 马面鲀鱼皮锌螯合肽[P]. 中国: CN104928337A, 2015-09-23.
[20] 谭洪亮, 王 斌, 迟长凤, 等. 一种金枪鱼鱼骨胶原蛋白源锌螯合胶原肽及其制备方法和用途[P]. 中国: CN104710525A, 2015-06-17.
[21] 杜 芬, 侯 虎, 赵玉然, 等. 鳕鱼源金属螯合肽体外模拟胃肠消化稳定性研究[J]. 现代食品科技, 2016 (7): 33-38.
[22] Li Y C, Zhu D Y, Jin L Q,etal.. The combination between collagen polypeptide and calcium[J]. J. Soc. Leath. Tech. Ch., 2006, 90(3): 123-126.
[23] Jin Y G, Fu W W, Ma M H. Preparation and structure characterization of soluble bone collagen peptide chelating calcium[J]. Afr. J. Biotechnol., 2011, 10(50): 10204-10211.
[24] Zhuang Y, Zhao X, Li B. Optimization of antioxidant activity by response surface methodology in hydrolysates of jellyfish (Rhopilemaesculentum) umbrella collagen [J]. J. Zhejiang Univ. Sci. B, 2009, 10(8): 572-579.
[25] Dong S, Zeng M, Wang D,etal.. Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthysmolitrix)[J]. Food Chem., 2008, 107(4): 1485-1493.
[26] Guo L, Harnedy P A, Li B,etal.. Food protein-derived chelating peptides: biofunctional ingredients for dietary mineral bioavailability enhancement[J]. Trends Food Sci. Tech., 2014, 37(2): 92-105.
[27] Dunbar R C, Steill J D, Polfer N C,etal.. Peptide length, steric effects, and ion solvation govern zwitterion stabilization in barium-chelated di-and tripeptides[J]. J. Phys. Chem. B, 2009, 113(31): 10552-10554.
[28] Seth A, Mahoney R R. Iron chelation by digests of insoluble chicken muscle protein: the role of histidine residues[J]. J. Sci. Food Agric., 2001, 81(2): 183-187.
[29] Vattem D A, Seth A, Mahoney R R. Chelation and reduction of iron by chicken muscle protein digests: the role of sulphhydryl groups[J]. J. Sci. Food Agric., 2001, 81(15): 1476-1480.
[30] Charoenphun N, Cheirsilp B, Sirinupong N,etal.. Calcium-binding peptides derived from tilapia (Oreochromisniloticus) protein hydrolysate[J]. Eur. Food Res. Technol., 2013, 236(1): 57-63.
[31] 薛爱爱. 氨基酸与二肽金属螯合物的研究[D]. 兰州: 兰州理工大学, 硕士学位论文,2008.
[32] 曾敏莉, 周远大. 钙制剂的现状及发展趋势[J]. 儿科药学杂志, 2004, 10(3): 16-18.
[33] 成 静, 陈栋梁, 倪 萌, 等. 胶原肽螯合钙的吸收试验研究[J]. 食品科技, 2012(5): 64-67.
[34] Peng Z, Hou H, Zhang K,etal.. Effect of calcium-binding peptide from Pacific cod (Gadusmacrocephalus) bone on calcium bioavailability in rats[J]. Food Chem., 2017, 221: 373-378.
[35] 王秀丽, 刘安军, 李 琨, 等. 胶原蛋白多肽-铬 (Ⅲ) 螯合物的降血糖机理探讨[J]. 食品研究与开发, 2006, 27(5): 125-126.
[36] 王振强, 申 森, 樊 欣. 胶原蛋白多肽-铬(Ⅲ)螯合物制备及功效研究[J]. 食品工业, 2011(9): 99-101.
[37] 刘安军, 王维君, 曹东旭, 等.胶原蛋白多肽-铬(Ⅲ)螯合物对小鼠肝脏SOD表达的影响[J]. 食品研究与开发, 2007, 28(12): 22-25.
[38] 段 秀, 杨成涛, 孙 云, 等. 罗非鱼皮胶原蛋白肽亚铁螯合修饰及螯合物性质的研究[J]. 食品工业科技, 2014, 35(18): 157-160.
[39] Liu H, Wang S, Xi Y,etal.. Preparation, characterization, and antibacterial activity evaluation of collagen-Zn complex[J]. Polym. Bull., 2010, 64(8): 835-843.
[40] F. 巴索洛, R. G. 皮尔逊. 无机反应机理-溶液中金属络合物的研究[M]. 北京: 科学出版社, 2001.
[41] 洪 惠,罗永康,吕元萌,等. 酶法制备鱼骨胶原多肽螯合钙的研究[J]. 中国农业大学学报, 2012,17(1):149-155.
[42] 陆剑锋,孟昌伟,李 进,等. 斑点叉尾鱼骨胶原多肽螯合钙的制备及其特征[J]. 水产学报,2012,36(2):314-320.
[43] 刘 永, 黎彬庆, 韦寿莲. 罗非鱼鳞胶原蛋白肽锌螯合物制备工艺优化[J]. 食品与发酵工业, 2013, 39(4): 125-129.
[44] 崔 潇, 江虹锐, 刘小玲, 等. 响应面法优化罗非鱼鱼皮胶原多肽螯合镁的工艺条件的研究[J]. 食品工业科技, 2013, 34(15): 238-241,245.
[45] Deng J, Chen F, Fan D,etal.. Formation and characterization of iron-binding phosphorylated human-like collagen as a potential iron supplement[J]. Mater. Sci. Eng. C, 2013, 33(7): 4361-4368.
[46] 侯 虎, 李八方, 彭 喆, 等. 一种钙螯合肽的制备方法 [P]. 中国:CN104232719B, 2017-01-25.
[47] Zhu C, Chen Y, Deng J,etal.. Preparation, characterization, and bioavailability of a phosphorylated human-like collagen calcium complex[J]. Polym. Adv. Technol., 2015, 26(10): 1217-1225.
[48] Zhu C, Ma X, Wang Y,etal.. A novel thiolated human-like collage zinc complex as a promising zinc supplement: physicochemical characteristics and biocompatibility [J]. Mater. Sci. Eng. C, 2014, 44: 411-416.
[49] 陈俊德, 易瑞灶, 陈 晖. 鱼胶原蛋白及其活性肽的研究进展[J]. 中国海洋药物, 2009 (4): 52-56.
[50] 胡爱军, 马立新, 郑 捷, 等. 超声法制备鱼胶原蛋白肽锌螯合物的研究[J]. 食品工业, 2014, 35(7): 9-12.
[51] 徐锁平. 铜钴镍锌锰螯合物的微波固相合成及其抑菌活性研究[D]. 北京:中国矿业大学, 博士学位论文,2013.
[52] 陈新峰, 张治国, 王君虹, 等. 响应面法优化微波固相合成毛虾肽螯合钙工艺[J]. 浙江农业学报, 2015, 27(8): 1473-1478.
[53] 张俊敏, 乐 辉, 陈 忻, 等. 响应面法优化微波固相合成鳕鱼皮胶原蛋白肽锌螯合物的工艺[J]. 广东农业科学, 2011, 38(22): 87-90.
[54] 胡爱军, 闫 伟, 郑 捷, 等. 真鲷鱼胶原蛋白多肽-铬(Ⅲ)螯合物的加工方法 [P]. 中国: CN102657338A, 2012-09-12.
Progress of Collagen Peptide Metal Chelates and Related Production Technologies
SUN Shanshan1,2, GAO Yahui1, CHEN Junde2*
1.SchoolofLifeSciences,XiamenUniversity,FujianXiamen361005,China; 2.MarineBiologicalResourceComprehensiveUtilizationEngineeringResearchCenteroftheStateOceanicAdministration,theThirdInstituteofOceanographyoftheStateOceanicAdministration,FujianXiamen361005,China
Collagenpeptidemetalchelatesareformedbycollagenpeptidesandmetalionsthroughcoordinatecovalentbondingoradsorptionbinding.Theyhavebeenconsideredasthepotentialapproachtodeliveringmetalmineralelementstoconsumerswithmanyvirtues,suchashigherbioavailability,highersafetyandhigherbioactivity.Chelatemechanism,stability,absorptionandutilization,functionalactivityandproductiontechnologiesofcollagenmetalchelateswerereviewedandthedevelopmentprospectwerealsoforeseeninthispaper,whichwasexpectedtoprovidereferenceforrelatedreasearches.
collagenpeptidemetalchelates;chelatemechanism;functionalactivity;productiontechnologies
2017-04-07; 接受日期:2017-05-18
国家自然科学基金项目(41106149;41676129)资助。
孙姗姗,硕士研究生,主要从事蛋白工程研究。E-mail: shshsun123@163.com。*通信作者:陈俊德,副研究员,主要从事蛋白工程研究。E-mail:jdchen@tio.org.cn
10.19586/j.2095-2341.2017.0024

