拜赖青霉活性产物的抗真菌作用研究
张楠楠, 白 净, 张礼文, 徐玉泉, 王惠国, 冯宝民
1.大连大学生命科学与技术学院, 辽宁 大连 116622; 2.中国农业科学院生物技术研究所, 北京 100081
拜赖青霉活性产物的抗真菌作用研究
张楠楠1,2, 白 净2, 张礼文2, 徐玉泉2, 王惠国1*, 冯宝民1
1.大连大学生命科学与技术学院, 辽宁 大连 116622; 2.中国农业科学院生物技术研究所, 北京 100081
采用平板对峙实验和生长速率法,筛选和测定拜赖青霉ACCC 30440对尖孢镰刀菌与大丽轮枝菌的抑制活性。结果表明,ACCC 30440的PDB发酵液和乙酸乙酯提取物均能够抑制尖孢镰刀菌与大丽轮枝菌的生长,含10%发酵液的培养基对尖孢镰刀菌与大丽轮枝菌的抑制率均达40%以上,含20%发酵液则可完全抑制这两株病原真菌的生长;ACCC 30440的乙酸乙酯提取物对尖孢镰刀菌与大丽轮枝菌的半抑制浓度分别为518.63 μg/mL和443.42 μg/mL。说明拜赖青霉ACCC 30440菌株能够产生抑制植物病原真菌生长的活性物质。
拜赖青霉;尖孢镰刀菌;大丽轮枝菌;活性产物
植物病害是制约农作物高产稳产的重要因素之一,70%~80%的植物病害是由病原真菌侵染所致[1],其中,能够引起植物枯萎病和黄萎病的尖孢镰刀菌(Fusariumoxysporum)和大丽轮枝菌(Verticilliumdahlia)是世界性重要的土传病原真菌。植物真菌病害不仅直接造成农作物产量下降与品质降低,而且部分病原真菌在侵染农作物过程中,可分泌产生多种有害的毒素与代谢物,极大威胁了农产品的安全性。随着现代农业的发展及人类环境保护意识的提高,生物农药作为生物防治的重要内容,具有来源广、成本低、毒性低、易于降解和残留小等优点,成为开发农用抗生素的重要来源[2]。
青霉菌广泛存在于自然界中,具有生长繁殖快、产孢能力强的优点,其生长原料来源广、价格低廉,更利于工业化生产[3],是生物防治农作物病原真菌的主要菌种。国内外关于青霉菌株活性产物的抗真菌作用已有报道。如青霉(Penicillumsp.)TS67的发酵液能够抑制玉蜀黍平脐蠕孢菌(Bipolarismaydis)和大豆尖孢镰刀菌(Fusariumoxysporum)的生长,其作用机制可能是影响植物病原真菌的细胞壁形成[4,5]。马德里青霉(Penicilliummadriti)QMYCS-2发酵液中含有能够抑制烟草黑胫病菌的有效成分[6];灰黄青霉(Penicilliumgriseofulvum)CF3发酵液对4株马铃薯土传病原真菌均有较强抑制作用,并表明该作用由发酵液中抗菌活性代谢产物所致[3];青霉菌(P.italicum)对尖孢镰刀菌在营养竞争、抗生作用方面均具有较好的抑制作用[7];海洋真菌梅花状青霉FS83的发酵液提取物对绿色木霉、黑曲霉、胶孢炭疽菌具有一定的抑制效果,抑制率均达50%以上[8]。到目前为止,尚未见到有关拜赖青霉对植物病原真菌——尖孢镰刀菌与大丽轮枝菌拮抗作用的研究报道。因此,本研究初步探讨了拜赖青霉(Penicilliumbilaiae)ACCC 30440的发酵活性产物对植物病原真菌——尖孢镰刀菌与大丽轮枝菌的抑制作用,以期为开发生物农药提供一种新的来源。
1 材料与方法
1.1 材料
1.1.1 实验材料 拜赖青霉(Penicilliumbilaiae)ACCC 30440,由中国农业菌种保藏中心提供。植物病原真菌:尖孢镰刀菌(Fusariumoxysporum) Foc TR4由海南大学刘柱实验室提供,大丽轮枝菌(Verticilliumdahlia) v991由中国农业科学院生物技术研究所程红梅研究员提供。1.1.2 仪器与试剂 恒温培养箱(德国MEMMERT公司);高压蒸汽灭菌锅(日本Digital Biology 公司);生物安全柜(中国Haier公司);旋转真空蒸发仪(瑞士BUCHI公司);光学显微镜(上海缔伦光学仪器有限公司);恒温振荡器(美国精骐有限公司);台式离心机(德国EPPENDORF公司)。
乙酸乙酯、甲醇、二甲基亚砜(DMSO)均为分析纯,购自北京化玻站生物技术有限公司;马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基均购自碧迪(BD)医疗器械(上海)有限公司。
1.2 ACCC 30440对病原真菌的抑制试验
采用平板对峙法,在直径9 cm的PDA平板上分别接种2.5 μL含有107孢子/mL的ACCC 30440与病原真菌的孢子悬浊液,接种点距离3 cm,以不接青霉的为对照,每个处理重复3次,于28℃培养箱内培养,每天观察菌落的生长状况,用毫米刻度尺测量病原真菌与ACCC 30440共培养生长的菌落直径R1和病原真菌单独生长时的菌落直径R2,并计算共培养5 d后对病原真菌的抑制率。计算公式:抑菌率I=[(R2-R1)/R2]×100%。
1.3 ACCC 30440发酵液对病原真菌抑制作用的测定
1.3.1 ACCC 30440发酵液的制备 菌株活化后,收取孢子,制成孢子悬浊液。配置PDB培养基,250 mL三角瓶中分装100 mL培养基,121℃高压蒸汽灭菌15 min。待培养基冷却后,于无菌条件下,每个三角瓶中再加入20 μL ACCC 30440孢子悬浊液(107孢子/mL),200 r/min 28℃培养10 d。于无菌条件下,分别将菌丝体过滤,得到发酵液,并将发酵液12 000 r/min离心10 min,收集上清并用0.22 μm滤膜过滤,获得青霉30440无菌发酵液。
1.3.2 ACCC 30440发酵液对病原真菌生长的影响 发醇液对病原真菌生长的影响采用生长速率法测定。将不同体积的发酵液分别加入到40℃左右的PDA培养基(经灭菌)中,分别制成含2.5%、5%、10%、20%发酵液的培养基,充分摇匀,并迅速倒入直径为9 cm的平板中。以不含发酵液为空白对照,每个处理重复3次。在平板中央分别接入2.5 μL病原真菌孢子悬浊液,置于28℃恒温箱中黑暗培养。每天观察菌落生长情况,采用十字交叉法测定菌落直径并计算第5天菌丝生长抑制率。菌丝生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.4 ACCC 30440发酵液乙酸乙酯提取物对病原真菌抑制作用的测定
1.4.1 ACCC 30440发酵液乙酸乙酯粗提物与病原真菌菌饼的制备 将获得的发酵液用等体积的乙酸乙酯萃取,重复3次,合并萃取液,旋转蒸发仪蒸干,得到发酵液乙酸乙酯提取物。将病原真菌菌株活化,5 d后收集孢子,制成孢子悬浊液,涂布到PDA平板中,28℃培养4 d,用于制备直径5 mm的菌饼。
1.4.2 ACCC 30440发酵液乙酸乙酯粗提物对病原真菌生长的影响 称取乙酸乙酯提取物配制成浓度为625 mg/mL的储存液,分别用20%的DMSO稀释成500 mg/mL、250 mg/mL、125 mg/mL、62.5 mg/mL和31.25 mg/mL,取40 μL加入到25 mL灭菌并冷却至40℃左右的PDA培养基中,使培养基中提取物的含量分别为1 000 μg/mL、800 μg/mL、400 μg/mL、200 μg/mL、100 μg/mL和50 μg/mL,混匀后贮备平板。以加入同体积的20% DMSO与水的平板为对照,每个处理重复3次。在平板中央分别接入直径5 mm病原真菌菌饼,置于28℃恒温箱中黑暗培养。每天观察菌落生长情况,采用十字交叉法测定菌落直径并计算第5天菌丝生长抑制率。
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.5 统计学分析
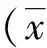
2 结果与分析
2.1 ACCC 30440对病原真菌的抑制作用
通过平板对峙实验,结果表明,ACCC 30440
对尖孢镰刀菌与大丽轮枝菌具有拮抗作用,能够明显抑制尖孢镰刀菌与大丽轮枝菌的菌落生长,见图1。共培养5 d后,其对尖孢镰刀菌的平板对峙抑制率为26.00%±3.12%,对大丽轮枝菌的平板对峙抑制率为22.33%±4.09%(表1)。
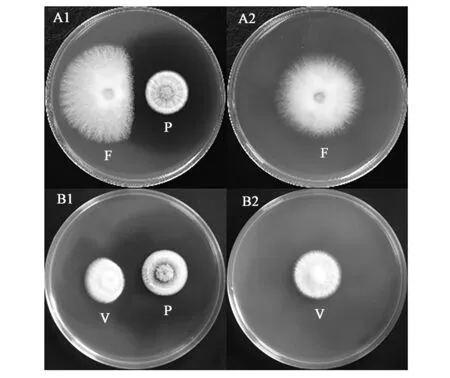
图1 ACCC 30440平板对峙实验菌落形态Fig.1 Colony characteristics through plate confrontation on ACCC 30440.注:A1:ACCC 30440对尖孢镰刀菌生长有明显抑制作用;A2:对照组尖孢镰刀菌正常生长;B1:ACCC 30440对大丽轮枝菌生长有明显抑制作用;B2:对照组大丽轮枝菌正常生长。F:尖孢镰刀菌;P:ACCC 30440;V:大丽轮枝菌。

表1 ACCC 30440与植物病原真菌平板对峙实验结果(n=3)
注:*表示与对照组相比差异显著(P<0.05)。
2.2 ACCC 30440发酵液对病原真菌生长的影响
ACCC 30440发酵液能够抑制病原真菌菌落的生长,随发酵液含量的增加,病原真菌菌落生长受到抑制,菌落直径逐渐变小(表2)。培养基中含20%发酵液时两种病原真菌几乎都不生长(P<0.05);含2.5%发酵液时,能够抑制尖孢镰刀菌的生长,而对大丽轮枝菌生长的抑制现象不明显;含10%发酵液时,对两种病原真菌的抑制率均能达到40%以上(图2)。可见,ACCC 30440发酵液能够抑制植物病原真菌生长,说明ACCC 30440发酵液中存在某种能够抑制病原真菌生长的次级代谢产物。
2.3 ACCC 30440发酵液乙酸乙酯提取物对病原真菌生长的影响
为了确定ACCC 30440对病原真菌的抑制作用是否由活性代谢产物引起,用等体积乙酸乙酯萃取3 L ACCC 30440的发酵液并得到1.2 g提取物。将不同浓度的乙酸乙酯提取物加入到培养基中,观察其对两株病原真菌生长的影响。实验结果表明,ACCC 30440发酵液乙酸乙酯提取物能够抑制这两株病原真菌的生长,随乙酸乙酯提取物浓度的增加,尖孢镰刀菌与大丽轮枝菌的菌落直径逐渐变小(表3)。当培养基中含1 000 μg/mL乙酸乙酯提取物时,能明显抑制尖孢镰刀菌的生长,抑制率能达到80%以上,此时大丽轮枝菌几乎不生长(P<0.05)(图3)。使用半抑制浓度(IC50)计算软件,计算得到乙酸乙酯提取物对尖孢镰刀菌的IC50为518.63 μg/mL,对大丽轮枝菌的IC50为443.42 μg/mL,表明ACCC 30440乙酸乙酯提取物对大丽轮枝菌的抑制活性略高于尖孢镰刀菌。

表2 ACCC 30440发酵液对病原真菌菌落生长的影响(n=3)
注:*表示与CK组相比差异具有显著性(P<0.05)。
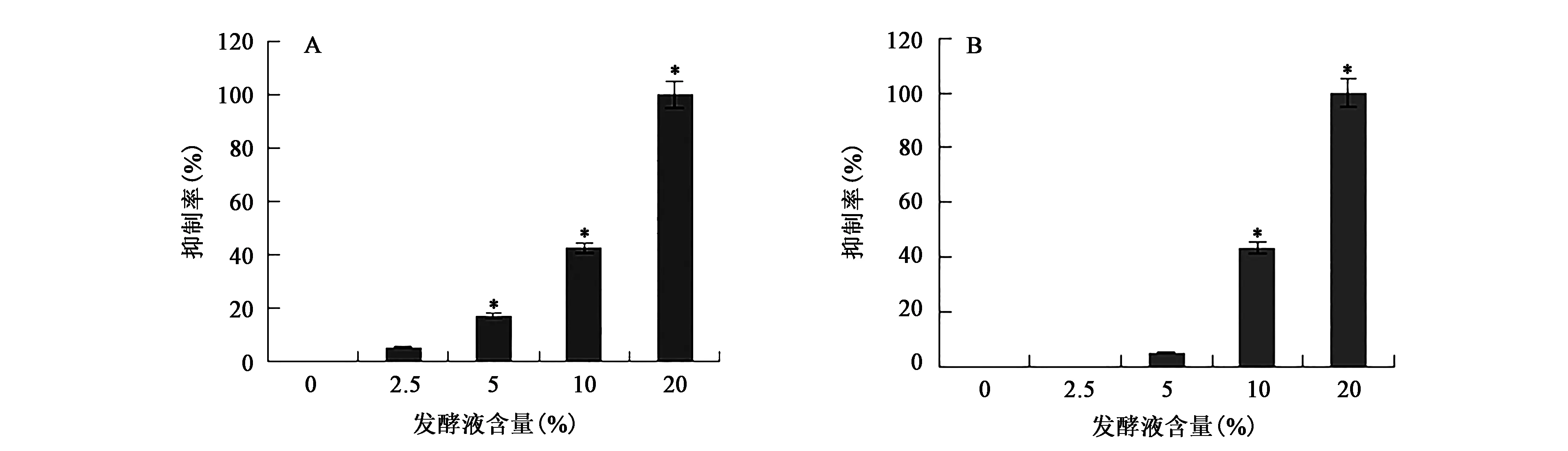
图2 ACCC 30440发酵液对病原真菌生长的抑制作用(n=3)Fig.2 Inhibities on mycelial growth influenced by the fermentation broth of ACCC 30440(n=3).注:A:对尖孢镰刀菌的抑制作用;B:对大丽轮枝菌的抑制作用;*表示与CK组相比差异具有显著性(P<0.05)。
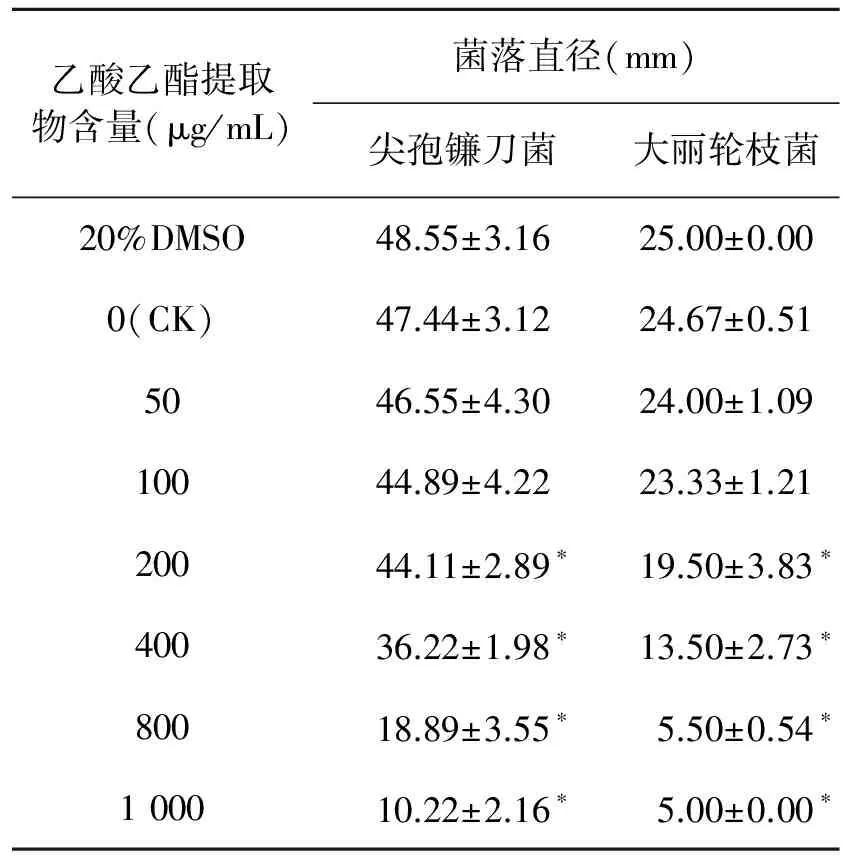
乙酸乙酯提取物含量(μg/mL)菌落直径(mm)尖孢镰刀菌大丽轮枝菌20%DMSO48.55±3.1625.00±0.000(CK)47.44±3.1224.67±0.515046.55±4.3024.00±1.0910044.89±4.2223.33±1.2120044.11±2.89∗19.50±3.83∗40036.22±1.98∗13.50±2.73∗80018.89±3.55∗5.50±0.54∗100010.22±2.16∗5.00±0.00∗
注:*表示与CK组相比差异具有显著性(P<0.05)。
3 讨论
过量使用化学农药导致的农药残留不仅会造成环境污染、生物多样性被破坏,而且会对农产品安全造成重大隐患,因此开发和推广可降解、选择性高的生物农药,已成为保障农产品质量安全的重要措施[9]。目前,抗植物病原真菌的活性成分来源广泛,涉及植物、动物、微生物等领域,尤其是微生物领域。青霉菌属于曲霉科青霉属,种类繁多、分布广,广泛存在于自然界,在工业中也具有很高的经济价值。本研究通过平板对峙实验发现拜赖青霉ACCC 30440能够抑制尖孢镰刀菌与大丽轮枝菌的生长,利用生长速率法发现ACCC 30440发酵液能够显著抑制这两株病原真菌的生长。拜赖青霉(Penicilliumbilaiae)[10,11]是一种真菌微生物,能够促进一些农作物对土壤中磷的吸收,并能促进农作物生长,例如小麦、油菜和豆科植物。Nakahara等[12]报道从拜赖青霉Chalabuda乙酸乙酯提取物中分离到3种化合物,均具有杀线虫活性。拜赖青霉ACCC 30440是否也会产生杀线虫的活性产物需要进一步研究。Meng等[13]从红树林植物榄李(Lumnitzeraracemosa)的根际土壤中分离得到拜赖青霉MA-267,并从其发酵产物中分离到两种化合物Penicibilaenes A和Penicibilaenes B,发现这两种化合物能够抑制植物病原真菌的生长,但具有选择性,主要抑制胶孢炭疽菌(Colletotrichumgloeosporioides),其最低抑菌浓度(minimal inhibitory concentration,MIC)分别为1.0 μg/mL和0.125 μg/mL。本研究还发现ACCC 30440乙酸乙酯提取物能够同时抑制尖孢镰刀菌与大丽轮枝菌的生长,其半抑制浓度分别为518.63 μg/mL和443.42 μg/mL,即对大丽轮枝菌的抑制活性略高于尖孢镰刀菌,表明ACCC 30440对植物病原真菌的拮抗作用可能具有广泛性。
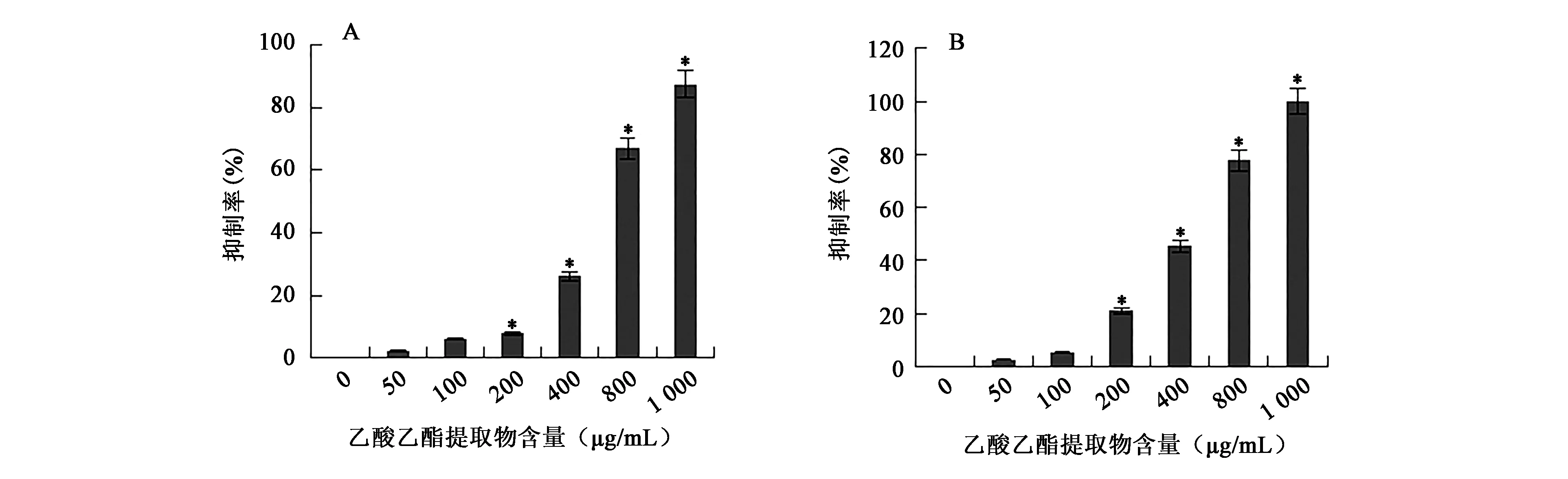
图3 ACCC 30440乙酸乙酯提取物对病原真菌生长的抑制效果(n=3)Fig.3 Inhibities on mycelial growth influenced by the ethyl acetate extracts of ACCC 30440(n=3).注:A:对尖孢镰刀菌的抑制作用;B:对大丽轮枝菌的抑制作用; *表示与CK组相比差异具有显著性(P<0.05)。
拜赖青霉对人畜和环境无害,目前市场上有神农氏公司和哈尔滨尚仕生物科技有限公司生产的以拜赖青霉为主的菌肥“菌乐宝”和“增酶莙”等,具有增强植物对养分的吸收、增加土壤肥力、提高植物抗病能力等特点,但由拜赖青霉生物合成的有效成分还不清楚。本文的研究结果表明,拜赖青霉能够产生抑制植物病原真菌生长的活性物质,为更合理的利用拜赖青霉提供了一定的理论依据,也为开发生物农药提供了一种新的来源,具有巨大的应用前景。
[1] 康振生. 我国植物真菌病害的研究现状及发展策略[J]. 植物保护, 2010, 36(3):9-12.
[2] 杨 光, 孙长华, 李东刚. 微生物农药的发展概况[J]. 化学工程师, 2010(2):45-48.
[3] 陈 杰, 郭天文, 汤 琳, 等. 灰黄青霉CF3对马铃薯土传病原真菌的拮抗性及其促生作用[J]. 植物保护学报, 2013, 40(4):301-308.
[4] 王淑媛, 王素英, 涂敏勤. 青霉TS67菌株活性产物的抗真菌作用[J]. 微生物学通报, 2008, 35(9):1404-1408.
[5] 王素英, 朱晨晨, 李 琪. 抗大豆尖孢镰刀菌新型固体生物农药的研制[J]. 河北师范大学学报(自然科学版), 2013, 37(1):76-81.
[6] 王海波, 时 焦, 雒振宁, 等. 青霉菌QMYCS-2菌株的分离鉴定及其对烟草黑胫病的防治作用[J]. 烟草科技, 2016, 49(2):14-20
[7] 王 芳, 李 静, 张 欢. 青霉菌、放线菌株和石灰水对尖孢镰刀菌抑制作用的研究[J]. 中国农学通报, 2013, 29(12):185-189.
[8] 李浩华, 陈玉婵, 王 磊, 等. 海洋真菌梅花状青霉FS83抗菌抗肿瘤活性研究[J]. 生物技术通报, 2013(1):151-155.
[9] 刘永震, 张志强. 浅谈我国生物农药发展现状及存在的问题[J], 河北农业, 2015(1):52-53.
[10] Burton E M, Knight J D. Survival ofPenicilliumbilaiaeinoculated on canola seed treated with Vitavax RS and Extender[J]. Biol. Fert. Soils, 2005,42(1):54-59.
[11] Friesen T J, Holloway G, Hill G A,etal.. Effect of conditions and protectants on the survival ofPenicilliumbilaiaeduring storage [J]. Biocontrol Sci. Technol., 2006, 16(1):89-98.
[12] Nakahara S, Kusano M, Fujioka S,etal.. Penipratynolene, a novel nematicide fromPenicilliumbilaiaeChalabuda[J]. Biosci. Biotech. Bioch., 2004, 68(1):257-259.
[13] Meng L H, Li X M, Liu Y,etal.. Penicibilaenes A and B, sesquiterpenes with a tricyclo [6.3.1.01,5] dodecane skeleton from the marine isolate ofPenicilliumbilaiaeMA-267[J]. Org. Lett.,2014,16(23):6052-6055.
Study on the Antifungal Effect of Bioactive Metabolites Produced byPenicilliumbilaiae
ZHANG Nannan1,2, BAI Jing2, ZHANG Liwen2, XU Yuquan2, WANG Huiguo1*, FENG Baomin1
1.SchoolofLifeScienceandBiotechnology,DalianUniversity,LiaoningDalian116622,China; 2.BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China
The antagonistic activity ofPenicilliumbilaiaeACCC 30440 againstFusariumoxysporumandVerticilliumdahliaewas screened and determined by plate confrontation experiment and growth rate method. The results showed that ACCC 30440 fermentation broth and ethyl acetate extract could inhibit the growth ofF.oxysporumandV.dahliae, and the inhibition rate toF.oxysporumandV.dahliaewere both more than 40% with 10% fermentation broth, while 20% fermentation broth completely inhibited the growth of these two pathogenic fungi. The half inhibitory concentrations of ACCC 30440 ethyl acetate extract onF.oxysporumandV.dahliaewere 518.63 μg/mL and 443.42 μg/mL, respectively. The results indicated thatP.bilaiaeACCC 30440 strain could produce bioactive metabolites that inhibited the growth of phytopathogenic fungi.
Penicilliumbilaiae;Fusariumoxysporum;Verticilliumdahliae; bioactive metabolites
2017-03-28; 接受日期:2017-04-14
国家973计划项目(2015CB755700);农业部948项目(2016-X43)资助。
张楠楠,硕士研究生,研究方向为次级代谢产物及其生物活性的研究与开发。E-mail:linyiznn@126.com。*通信作者:王惠国,副教授,研究方向为次级代谢产物及其生物活性的研究与开发。E-mail:wanghuiguo163@163.com
10.19586/j.2095-2341.2017.0020

