以菊粉为底物全细胞催化生产甘露醇
罗 希, 曹 海 龙, 张 卉 妍, 李 悝 悝, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国科学院大连化学物理研究所, 辽宁 大连 116023 )
以菊粉为底物全细胞催化生产甘露醇
罗 希1, 曹 海 龙2, 张 卉 妍2, 李 悝 悝2, 张 春 枝1
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国科学院大连化学物理研究所, 辽宁 大连 116023 )
将Leuconostocmesenteroides来源的甘露醇脱氢酶(mdh)及Mycobacteriumvaccae来源的甲酸脱氢酶(fdh)的共表达载体pRSFDuet-mdh-fdh,与葡萄糖辅助蛋白(glf)的表达载体pZY507glf共转入大肠杆菌BL21(DE3)中,成功构建了一个可将果糖转化为甘露醇的全细胞催化剂E.coliBL21(DE3)/pRSFDuet-mdh-fdhpZY507glf。该全细胞催化剂在pH 6.5、温度30 ℃时,具有最高的转化效率,甘露醇的产率可达到0.91 g/g。通过与高活力的菊粉酶协同作用,甘露醇的产率可达到0.93 g/g。
甘露醇;生物转化法;菊粉;全细胞催化
0 引 言
甘露醇是一种六元糖醇,在医药、食品、化工和轻工等领域具有十分广泛的应用[1-3]。目前,甘露醇的生产方法有海带提取法和化学催化法。其中,海带提取法生产甘露醇的能耗较高,对环境污染较大,正逐渐被淘汰;化学催化法是目前工业上普遍采用的甘露醇生产方法,但由于其生产过程副产大量山梨醇,导致甘露醇的分离成本高昂。因此,开发一种高效、绿色及低成本的甘露醇生产方法具有非常重要的意义。
近年来,利用微生物转化法进行甘露醇生成的研究备受重视[4]。全细胞催化是介于发酵法和提取酶催化法之间的一种生物催化技术[5]。Kaup等[6-7]带领的团队是最早开展全细胞催化合成甘露醇研究的团队之一。他们运用基因工程的方法,将异源的NADH依赖型的甘露醇脱氢酶和NAD+依赖型甲酸脱氢酶基因转入大肠杆菌体内,建立了一个可利用果糖和甲酸作为底物生产甘露醇的全细胞催化剂。该方法不仅利用细胞自身产生的辅酶,且辅酶可再生,因而兼具反应高效特异及过程经济的特点[8]。此后,Carsten等[9]成功在谷氨酸棒状杆菌中建立了生产甘露醇的全细胞催化系统。由于大肠杆菌内全细胞催化转化出现辅因子丢失现象,Florian等[10]优化了甘露醇脱氢酶基因,生产甘露醇的能力提高20%。此外,利用磷酸盐和亚磷酸盐为大肠杆菌内的全细胞催化提供辅酶,转化糖类生产甘露醇的研究也取得了一定的进展[11-13]。
菊粉在菊粉酶的作用下,可水解生成大量的果糖和少量的葡萄糖,是生产制备甘露醇的理想原料[14-15]。利用菊芋中的菊粉进行化学品及燃料的生产已有广泛的研究报道[16-17]。目前尚未有利用菊芋中的菊粉为原料,利用全细胞催化剂生产甘露醇的研究报道。本实验建立了一个利用菊粉为原料,通过全细胞催化进行甘露醇的生产的研究方法。
1 材料与方法
1.1 材 料
1.1.1 菌株质粒、培养基与培养方法
大肠杆菌BL21(DE3),实验室保存;共表达载体pRSFDuet、载体pMcFDH(含MycobacteriumvaccaeN10来源的甲酸脱氢酶基因fdh)、质粒pZY507glf(含运动发酵单胞菌来源的葡萄糖辅助蛋白)均由中国科学院大连化学物理研究所提供。实验所用菌株及质粒见表1。

表1 大肠杆菌菌株及质粒
LB培养基:胰蛋白胨1.0%,酵母提取物0.5%,NaCl 1.0%,固体培养时加2%琼脂。转化时加入50 μg/mL卡那霉素(用于筛选pRSFDuet-fdh-mdh质粒),25 μg/mL氯霉素(用于筛选pZY507glf质粒)。挑取构建的菌株平板单菌落至LB培养基中,培养基中加入卡那霉素,37 ℃、200 r/min振荡过夜。吸取1 mL转接至100 mL LB培养基中,加入卡那霉素(含质粒pZY507glf时加入氯霉素)培养至OD600为0.5左右,加入0.02 mmol/L IPTG 25 ℃诱导12 h。
1.1.2 试剂与仪器
琼脂糖凝胶DNA回收试剂盒,普通质粒小提试剂盒,DNA相对分子质量标准Marker,6×溴酚蓝,限制性内切酶,T4连接酶,琼脂糖,卡那霉素,氯霉素,菊粉酶,胰化蛋白胨,酵母提取物,氯化钠,辅酶Ⅰ,还原型辅酶Ⅰ,巯基乙醇,葡萄糖,果糖,甘露醇,甲酸钠,菊粉等。
TC412 PCR,英国Techne公司;DYCP-31核酸电泳仪,大连捷迈科贸有限公司;ICS 3000高效液相色谱系统,美国ESA公司;354酶标仪,美国赛默飞世尔公司;1645050蛋白电泳仪,大连捷迈科贸有限公司;BIOF 6005A GBN微生物发酵罐,上海高机生物工程有限公司。
1.2 方 法
1.2.1 甘露醇脱氢酶表达载体的构建
根据NCBI中公布的Leuconostocmesenteroide甘露醇脱氢酶基因(mdh)序列,委托苏州金维智公司对mdh进行了密码子优化及全基因合成,并插入到pRSFDuet载体上的NcoⅠ和BamHⅠ位点上,构建了甘露醇脱氢酶表达载体pRSFDuet-mdh。
1.2.2 甲酸脱氢酶和甘露醇脱氢酶共表达载体的构建
以质粒pMcFDH为模板,利用上游引物5′-CTACATATGGCAAAGGTCCTGTG-3′ 及下游引物5′-ATAGGTACCTCAGACCGCCTTCT-TGAACTTG-3′对甲酸脱氢酶基因fdh进行克隆。利用NdeⅠ和KpnⅠ酶切位点,将克隆出的fdh基因插入到pRSFDuet-mdh质粒载体上,构建出pRSFDuet-mdh-fdh表达载体。
1.2.3 全细胞催化剂菌株的构建
将质粒pRSFDuet-mdh-fdh和质粒pZY507glf(葡萄糖辅助蛋白基因)共转入BL21(DE3) 感受态细胞中,利用具有卡那霉素抗性和氯霉素抗性的LB固体平板进行培养,并将构建出的含有两个质粒的菌株命名为菌株Ⅰ。
1.2.4 相关酶活力的测定
1.2.4.1 甘露醇脱氢酶酶活力测定
0.2 mol/L还原型辅酶Ⅰ,0.2 mol/L D-果糖,0.1 mol/L磷酸钾缓冲液pH 6.0,于1 mL体系。在25 ℃条件下,在340 nm波长下每10 s测量NADH的吸光度,记录90 s。以此吸光度的变化率与酶的相关性确定酶活力。一个酶活力单位(U)定义:在pH 6.0条件下,1 min氧化1 μmol NADH的酶量。
1.2.4.2 甲酸脱氢酶酶活力测定
0.2 mol/L甲酸钠,0.2 mol/L辅酶Ⅰ,0.1 mol/L 磷酸钾缓冲液pH 7.0,于1 mL体系。在340 nm波长下每10 s测量NADH的吸光度,记录90 s。以此吸光度的变化率与酶的相关性来确定酶活力。一个酶活力单位(U)定义为:在pH 7.0条件下,1 min氧化1 μmol NAD+的酶量。
1.2.4.3 菊粉酶的酶活力测定
在pH 6.5、30 ℃条件下,每1 min水解菊粉产生1 μmol果糖所需的酶量为一个酶活单位[18-19]。测定540 nm波长处的吸光度。
1.2.5 全细胞催化实验
转化缓冲液pH:诱导条件为25 ℃,时间为12 h,分别优化转化pH 5.5、6.0、6.5、7.0,转化底物为0.1 mol/L果糖和甲酸钠。用甲酸控制pH,4 h取一次样液,反应48 h。通过HPLC检测分析转化的底物、中间产物和终产物浓度。
转化温度:在pH 6.5条件下,分别优化转化温度25、30、35、40 ℃。反应过程同上。
在pH为6.5、温度为30 ℃条件下,分别添加15和30 U/mL外源菊粉酶,考察其对甘露醇产率的影响。反应过程同上。
1.2.6 液相分析产物
转化反应中转化底物的量及转化产物甘露醇的量用HPLC的方法测定。转化反应液稀释后,用0.22 μm滤膜过滤后即可上样,上样量为20 μL。色谱柱为“DIONEX”CarboPacTMPA10(4 mm×250 mm)型阴离子交换柱,流动相为18 mmol/L NaOH,柱温30 ℃,体积流量1 mL/min。检测器为脉冲安培电化学检测器。采用外标法绘制标准曲线对转化体系中的底物、中间产物和终产物进行定量分析。
2 结果与讨论
2.1 甘露醇脱氢酶基因与甲酸脱氢酶基因共表达载体的构建
根据Leuconostocmesenteroides来源的甘露醇脱氢酶序列(WP_011679419.1),基于密码子偏好性对其进行了优化,优化后的序列见图1。图1中,粗体部分为mdh基因ORF序列,下划线部分为酶切位点。将优化后的序列交由苏州金唯智公司进行了全基因合成,并将合成后的序列插入到pRSFDuet载体的NcoⅠ和BamHⅠ位点上,获得了载体pRSFDuet-mdh。

图1 密码子优化后的甘露醇脱氢酶序列
根据pMcFDH载体上的甲酸脱氢酶序列,对甲酸脱氢酶基因进行克隆,电泳检测结果见图2。将该序列和质粒pRSFDuet-mdh用NdeⅠ和KpnⅠ进行双酶切并经胶回收纯化后,利用T4 DNA连接酶连接,得到pRSFDuet-mdh-fdh载体,如图3所示。
M,BM 15 000 DNA marker; 1,fdh PCR产物
2.2 全细胞催化剂的构建
将测序正确的重组质粒和质粒pZY507glf共同转化至E.coliBL21(DE3)中异源表达,通过SDS-PAGE分析目标蛋白的表达情况,结果如图4所示。由图4可知,菌株E.coliBL21(DE3)/pRSFDuet-mdh-fdhpZY507glf经过0.02 mmol/L IPTG诱导后,在36和40 ku处有特异性条带,与目的蛋白甘露醇脱氢酶和甲酸脱氢酶大小相符。由此可见,该蛋白为诱导表达的重组蛋白。

图3 mdh和fdh共表达质粒的结构
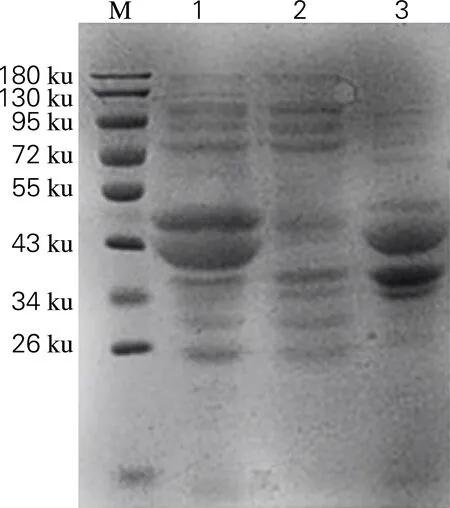
M,PageRuler prestained protein ladder;1,诱导破壁后上清液;2,未诱导全菌;3,诱导破壁后沉淀
图4 菌株E.coliBL21(DE3)/pRSFDuet-mdh-fdhpZY507glf的表达
Fig.4 Expression ofE.coliBL21(DE3)/ pRSFDuet-mdh-fdhpZY507glf
对表达的菌株进行酶活力测定,得到甘露醇脱氢酶酶活为5.13 U/mg,甲酸脱氢酶酶活力为5.97 U/mg。
2.3 全细胞催化反应条件优化
以果糖为底物,按“1.2.5”的方法,分别考察不同pH和温度对甘露醇合成效率的影响,结果见表2。由表2可知,pH 6.5、30 ℃分别为该催化反应的最适pH和反应温度。

表2 不同pH和温度条件下果糖全细胞催化转化甘露醇的产率
Tab.2 Conversion yields of D-fructose to D-mannitol by whole cell biotransformations at different pH and temperature

pH产率/(g·g-1)θ/℃产率/(g·g-1)5.50.56250.71±0.016.00.80±0.09300.916.50.91350.57±0.047.00.80±0.02400.25±0.01
2.4 外源添加菊粉酶对甘露醇产率的影响
以菊粉为底物,外源添加菊粉酶,添加量分别为15和30 U/mL,制备甘露醇。在pH 6.5、30 ℃ 条件下反应48 h,每4 h取样,结果如图5所示。


(a) 添加15 U/mL菊粉酶

(b) 添加30 U/mL菊粉酶
图5 外源添加菊粉酶对甘露醇产率的影响
Fig.5 Biotransformations of inulin to D-mannitol with extracellular inulinase supplementation
由图5可知,在反应体系中加入两种用量菊粉酶后,果糖和葡萄糖的浓度在4 h后大幅提高,表明菊粉被快速水解;但反应进行到8 h,图5(b) 中果糖浓度进一步提高,而图5(a)中果糖浓度则有所降低,表明15 U/mL菊粉酶添加量不能满足体系中菊粉的完全水解。当反应进行到48 h,两种不同菊粉酶添加量反应均有一定量的果糖剩余,此时甘露醇的产率分别为0.78和0.93 g/g。
3 结 论
本实验构建了质粒pRSFDuet-mdh-fdh,与pZY507glf共同转入大肠杆菌内成功表达。利用构建的全细胞催化剂E.coliBL21(DE3)/pRSFDuet-mdh-fdhpZY507glf,以果糖为底物,在不同温度及pH条件下进行全细胞催化实验,得到了最优转化条件。通过与高活力的菊粉酶协同,实现了以菊粉为底物利用全细胞催化进行甘露醇的合成,在菊粉酶添加量为30 U/mL时甘露醇的产率可达到0.93 g/g。本实验的研究结果拓宽了全细胞催化合成甘露醇路线的底物范围,为建立以能源植物菊芋中的菊粉为底物实现甘露醇的高效合成提供了参考。
[1] 朱豫.利用乳酸菌发酵糖化菊芋汁生产甘露醇的研究[D].大连:中国科学院大连化学物理研究所,2009.
[2] 黎颖.甘露醇的性质、生产与发展建议[J].广西化工,1999,28(4):29-33.
[3] 金红星,成文玉.明串珠菌发酵产甘露醇的研究进展[J].中国酿造,2012,31(10):4-6.
[4] 樊洁,韩烨,周志江,等.微生物发酵法生产糖醇的研究进展[J].食品与发酵科技,2013,49(5):94-98.
[5] 万红贵,赵宗松,蒋导航,等.微生物全细胞催化技术在工业生产中的应用[J].安徽农业科学,2011,39(4):1917-1919.
[6] KAUP B, BRINGER-MEYER S, SAHM H. Metabolic engineering ofEscherichiacoli: construction of an efficient biocatalyst for D-mannitol formation in a whole-cell biotransformationtion[J]. Applied Microbiology Biotechnology, 2004, 64(3): 333-339.
[7] KAUP B, BRINGER-MEYER S, SAHM H. D-Mannitol formation form D-glucose in a whole-cell biotransformation with recombinantEscherichiacoli.[J]. Applied Microbiology Biotechnology, 2005, 69(4): 397-403.
[8] SAHA C B, RACINE F M. Biotechnological production of mannitol and its applications[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 879-891.
[10] HEUSER F, MARIN K, KAUP B, et al. Improving D-mannitol productivity ofEscherichiacoli: impact of NAD, CO2and expression of a putative sugar permease fromLeuconostocpseudomesenteroides[J]. Metabolic Engineering, 2009, 11(3): 178-183.
[11] RESHAMWALA S M S, PAGAR S K, VELHAL V S, et al. Construction of an efficientEscherichiacoliwhole cell biocatalyst for D-mannitol production[J]. Journal of Bioscience and Bioengineering, 2014, 118(6): 628-631.
[12] JACOBSEN J H, FRIGAARD N U. Engineering of photosynthetic mannitol biosynthesis from CO2in a cyanobacterium[J]. Metabolic Engineering, 2014, 21: 60-70.
[14] 岳敏,曹海龙,李曙光,等.诱变选育以菊芋为原料高产甘露醇的乳酸菌[J].中国酿造,2012,31(9):53-56.
[15] 齐国超.菊芋组织培养及分子生物学研究现状[J].黑龙江农业科学,2015(3):151-154.
[16] CURCIO S, RICCA E, SARACENO A, et al. A mass transport/kinetic model for the description of inulin hydrolysis by immobilized inulinase[J]. Journal of Chemical Technology and Biotechnology, 2015, 90(10): 1782-1792.
[17] 刘宏.菊粉的功能特性与开发应用[J].中国食物与营养,2010(12):25-27.
[18] WANG L, HUANG Y, LONG X, et al. Cloning of exoinulinase gene fromPenicilliumjanthinellumstrain B01 and its high-level expression inPichiapastoris[J]. Journal of Applied Microbiology, 2011, 111(6): 1371-1380.
[19] 李益民,高教琪,袁文杰,等.菊粉酶基因的异源表达、分离纯化及酶学性质[J].生物工程学报,2015,31(5):670-681.
[20] 顾夕梅,陈晓佩,奚晓桐,等.菊粉酶及其制备低聚果糖研究进展[J].广东化工,2014,41(7):95-96.
The whole cell catalytic production of mannitol using inulin as substrate
LUO Xi1, CAO Hailong2, ZHANG Huiyan2, LI Kuikui2, ZHANG Chunzhi1
( 1.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China;2.Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China )
A whole-cell biotransformation systemE.coliBL21(DE3)/pRSFDuet-mdh-fdhpZY507glffor mannitol production were established through the mannitol dehydrogenase (mdh) derived fromLeuconostocmesenteroidesand the formate dehydrogenase gene (fdh) derived fromMycobacteriumvaccaepRSFDuet-mdh-fdhwith the glucose facilitator protein (glf) pZY507glfco-expressed inE.coliBL21(DE3). The yield of mannitol could reach to 0.91 g/g under the optimum conditions of pH 6.5 at 30 ℃. The yield of mannitol could reach to 0.93 g/g by whole catalyst with high activity inulinase.
mannitol; biotransformation; inulin; whole cell catalysis
2016-03-11.
国家高技术研究发展计划(863计划)项目(2014AA093511).
罗 希(1990-),女,硕士研究生;通信作者:张春枝(1963-),女,教授.
TS202.1;Q819
A
1674-1404(2017)04-0235-05
罗希,曹海龙,张卉妍,李悝悝,张春枝.以菊粉为底物全细胞催化生产甘露醇[J].大连工业大学学报,2017,36(4):235-239.
LUO Xi, CAO Hailong, ZHANG Huiyan, LI Kuikui, ZHANG Chunzhi. The whole cell catalytic production of mannitol using inulin as substrate[J]. Journal of Dalian Polytechnic University, 2017, 36(4): 235-239.

