女性帕金森病患者经期影响的相关因素分析
万志荣,张瑜,高靖,苏东宁,商梦晴,冯涛
·论著·
女性帕金森病患者经期影响的相关因素分析
万志荣,张瑜,高靖,苏东宁,商梦晴,冯涛
目的 调查育龄期女性帕金森病(PD)患者受经期影响的患病率及临床特征。方法 采用调查问卷、病例对照研究,连续选取自2015年6月~2016年1月我院门诊及天坛医院PD专病门诊发病年龄在50岁以下女性PD患者,记录受经期影响的病例数,分为经期相关组和与经期无关组,分析两组临床的异质性。同时收集两组发病年龄、文化程度、初始症状、病程、有无毒物接触史、家族史、统一PD评定量表第Ⅲ部分(UPDRS-Ⅲ)评分、改良Hoehn-Yahr(H-Y)分级、贝克焦虑量表(BAI)等资料。结果 共收集175例女性PD患者,经期受影响者42例,患病率为24%;将经期相关组与经期无关组分别在非经期及经期期间进行比较,非经期期间,两组在发病年龄、BAI方面差异有统计学意义(均P<0.05),而在病程、文化程度、有无毒物接触史、家族史、UPDRS-Ⅲ、改良H-Y分级等方面则差异无统计学意义(均P>0.05),但在经期期间,两组在发病年龄、UPDRS-Ⅲ、改良H-Y分级、BAI等方面均存在明显统计学意义(均P<0.000)。结论 女性育龄期PD患者易受经期影响,临床症状恶化,表现为运动症状加重,更易合并焦虑,提示该类患者日常生活能力及生活质量更差,应提醒临床医生的识别。
帕金森病;经期;患病率;贝克焦虑量表;症状恶化
帕金森病(PD)是黑质-纹状体通路变性的疾病,常见于中老年人,男性患病率高于女性[1],其中一个主要原因是与女性雌激素的神经保护作用有关,它可使发病延迟[2-3]。但专门针对女性PD患者的临床特点,尤其是经期与非经期的临床特征异同及相关影响因素却很少述及。有资料[4-6]表明,临床上受到经期影响的女性PD患者,均不同程度出现药物起效慢,药效短现象,称为症状恶化,极大影响了患者的生活质量[4-5]。这可能与激素水平波动有关[3-5]。有研究[3-6]表明,经期症状加重恰逢雌激素和孕激素水平的最低点,而雌激素会改变中脑边缘、中脑皮质的多巴胺能通路。以往研究[5-6]多为个案报道,缺乏较大样本的临床观察。本研究对175例发病时处于育龄期的女性PD患者经期与非经期进行病例对照研究,了解其临床特点及相关可能的影响因素,以加强临床对女性PD患者受经期影响的早期识别及关注。
1 对象与方法
1.1 对象 连续收集自2015年6月~2016年1月航天中心医院神经内科门诊及天坛医院PD专病门诊女性PD患者,共175例。所有患者均符合英国PD协会脑库制定的原发性PD的临床诊断标准[7]。排除标准:(1)帕金森综合征;(2)有脑器质性疾病;(3)有严重系统疾病:(4)有明显认知功能障碍,不能配合完成调查;(5)合并妇科良、恶性肿瘤者;(6)有明确毒物接触史;(7)发病时已绝经者。
1.2 方法 采用横断面病例对照研究。
1.2.1 问卷调查及量表评分 (1)采取与患者面对面访谈的形式进行调查,同时参考患者家属及其病历提供的资料,由专门从事运动障碍专科医生详细记录175例PD患者的临床信息并对其进行分类,包括年龄、发病年龄、初始症状、有无PD家族史、是否行脑深部电刺激术(DBS)等;本研究将在疾病发展过程中曾经受到月经期影响连续超过半年以上者,定义为经期相关PD患者。对经期相关者进一步询问所受影响的临床表现特点;(2)症状评价:采用统一PD评定量表第Ⅲ部分(UPDRS-Ⅲ)评分和改良Hoehn-Yahr(H-Y) 分级量表评价患者的运动症状;对所有患者进行二次评估(经期期间及非经期间);(3)情绪障碍评价:采用贝克焦虑量表(BAI)评价患者的情绪障碍,对所有患者进行二次评估(经期期间及非经期间)。含有21个项目的自评量表,采用4级分方法。其标准为“1”表示无;“2”表示轻度,无多大烦扰;“3”表示中度,感到不适但尚能忍受;“4”表示重度,只能勉强忍受,以BAI≥45作为焦虑阳性的判断标准。
1.2.2 分组 根据经期是否受影响将入选病例分为经期相关组和经期无关组。
1.2.3 统计学方法 采用SPSS 17.0软件完成统计学分析。两组间资料的比较:计数资料采用χ2检验;符合正态分布的计量资料均值比较采用t检验;多个组间比较采用单因素方差分析或χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 一般人口学资料 175例女性PD患者,年龄26~64岁,平均(48.5±7.7)岁;发病年龄11~50岁,平均(40.9±7.7)岁;病程(7.64±5.05)年;平均改良H-Y分级为2.5级;UPDRS-Ⅲ评分(34.9±13.3)分;BAI评分(39.0±10.6)分。受经期影响PD患者共42例,发病率24.0%(42/175),其中月经前期、月经期均受影响22例(52.4%),单纯经期中受影响20例(47.6%),均为临床症状恶化,表现为开期时间缩短,关期时间延长,具体体现在药物起效慢,药效时间短,尤其是多巴胺能药物疗效下降显著。
2.2 两组一般临床资料的比较 见表1。与经期无关组比较,经期相关组在发病年龄的差异有统计学意义(P<0.000),而在病程、初始症状、家族史、文化程度、是否行DBS之间均无明显差异(均P>0.05)。
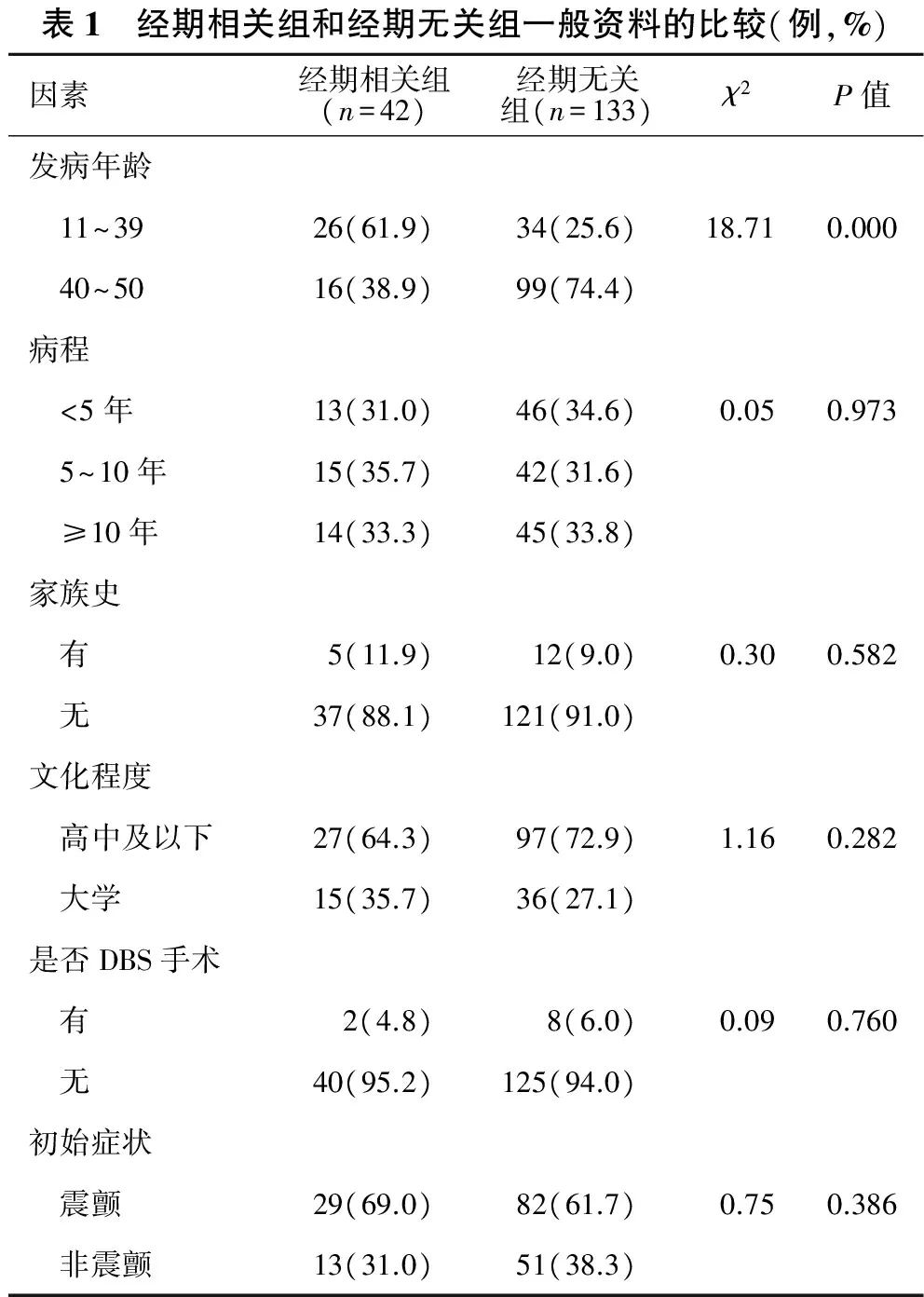
表1 经期相关组和经期无关组一般资料的比较(例,%)因素经期相关组(n=42)经期无关组(n=133)χ2P值发病年龄 11~3926(61.9)34(25.6)18.710.000 40~5016(38.9)99(74.4)病程 <5年13(31.0)46(34.6)0.050.973 5~10年15(35.7)42(31.6) ≥10年14(33.3)45(33.8)家族史 有5(11.9)12(9.0)0.300.582 无37(88.1)121(91.0)文化程度 高中及以下27(64.3)97(72.9)1.160.282 大学15(35.7)36(27.1)是否DBS手术 有2(4.8)8(6.0)0.090.760 无40(95.2)125(94.0)初始症状 震颤29(69.0)82(61.7)0.750.386 非震颤13(31.0)51(38.3)
2.3 两组量表评分的比较 见表2。非经期期间,两组BAI评分差异有统计学意义(P<0.000),改良H-Y分级、UPDRS-Ⅲ评分差异均无统计学意义(均P>0.05)。经期期间,两组在BAI、改良H-Y分级、UPDRS-Ⅲ评分差异均有统计学意义(均P<0.000)。

表2 经期相关组和经期无关组间量表评分的比较(x±s,例,%)因素非经期期间经期相关组(n=42)经期无关组(n=133)P值经期期间经期相关组(n=42)经期无关组(n=133)P值改良H⁃Y分级 均值2.5±0.752.49±1.040.9633.38±0.802.55±1.020.000 1~2.5级23(54.8)72(54.1)0.9449(21.4)69(51.9)0.000 3~5级19(45.2)61(45.9)33(78.6)64(48.1)UPDRS⁃Ⅲ评分 均值34.0±11.135.2±13.950.62047.8±10.5936.2±13.450.000BAI评分 均值44.9±9.337.1±10.40.00051.0±8.338.0±10.30.000 <45分20(47.6)91(68.4)0.01511(26.2)87(65.8)0.000 ≥45分22(52.4)42(31.6)31(73.8)46(34.6)
3 讨 论
PD是一种常见的神经系统变性疾病,主要表现为运动迟缓、静止性震颤、肌强直和姿势步态异常等运动症状[7]。目前国内,有少部分研究是关于女性生育特点对PD的影响及雌激素在PD中的神经保护作用[3,8],其他是关于PD动物模型上的研究[9-10]。专门针对临床上经期对育龄期女性PD的影响相关研究不多。因不同国家、种族的妇女绝经年龄有差异,但大多数研究显示,妇女绝经年龄在50~51岁[11],故本研究将发病年龄定在50岁的PD女性患者纳入研究对象范围。雌激素与运动障碍之间的关系最先由Koller等[12]提出。研究[2-4]表明,性激素在导致PD的过程中扮演着重要的角色,尤其是雌激素对神经细胞的生存与发展具有十分重要的影响。生育期妇女的雌激素水平随着月经和妊娠期激素变化而有所不同[13]。对于绝经前PD妇女,在雌激素水平降至最低的月经来潮前期、月经期,常常出现运动症状加重、左旋多巴的疗效下降[6,14-16]。有报道[15]显示,近40%~50%育龄期在月经周期间表现为症状的恶化,临床上有表现为穿衣困难及冻结步态,还有表现为震颤加重、药效时间缩短。Tolson等[16]在2002年曾报道19例发病年龄34~56岁的PD女性患者,其中有15例存在经期症状恶化现象,均表现为药物的有效性降低和关期时间延长,且这段时期患者自身的痛苦、疲劳和屈辱感明显增加。Schartau等[4]曾报道19例女性PD患者,有16例(84%)存在经期症状恶化现象。而本研究发现受经期影响PD患者患病率为24%(42/175),远低于先前报道。分析原因考虑与调查对象的人种不同及病例数存在差别等因素有关。有研究[17]表明,PD的患病率不仅存在种族和性别差异,同时也具有一定的地域分布差异。但PD经期症状恶化就其原因考虑与雌激素的作用相关,雌激素可随着生育期妇女月经期性激素水平的变化而有所不同,而且生育期妇女不同时期性激素的影响亦明显不同,如月经来潮前期及月经期雌激素水平明显降低[3,16]。有研究[3]已经证明,低的雌激素水平与PD呈正相关(如生育期的时间短、绝经早)。
本研究还发现,女性PD患病绝大多数集中在40岁以上年龄段(65.7%,115/175),与以往研究[3,16]相似。但经期相关PD组患者发病年龄更轻,集中在30~40岁年龄段,就其原因,考虑可能与存在肥胖、妇科手术、绝经过早等因素有关,有研究[3,18-19]表明上述因素使女性发展为PD的易感性明显增高。但还需要进一步收集本研究中女性PD患者的月经史、生育史、妇科疾病及手术史等资料进一步印证,这些将是本研究组后期研究对重点。
本研究对两组PD患者在经期期间及非经期间均进行UPDRS-Ⅲ、改良H-Y分级以及BAI评估。BAI量表主要是测量受测试者主观感受到近1周的焦虑程度,更能反应经期期间对女性PD患者的情绪影响程度。结果显示,非经期期间,两组在改良H-Y分级、UPDRS-Ⅲ评分之间无明显差异,但在焦虑方面有明显差异,尤其在经期期间更为明显。而经期期间,两组在改良H-Y分级、UPDRS-Ⅲ评分之间存在明显差异,提示经期相关组,在症状恶化后运动症状更重,更容易合并焦虑情绪,这个时期患者的生活质量更差。
对于经期影响的PD患者的治疗方法,目前报道最多的是雌激素替代疗法(ERT)。ERT不仅可以降低绝经后妇女罹患PD的风险,还可使左旋多巴起效的阈值下降,可延长“开期”时间,缩短“关期”时间,并使UPDRS的运动评分改善[2,6]。但也尚存在争议,与雌激素剂量、剂型、给药时间及持续时间等均相关[2-3]。本研究还应监测经期前后雌激素水平的变化,以更好的解释临床发病及防治机制,期待以后的研究进一步完善。
[1]万志荣, 商梦晴, 冯涛, 等. 早发型与晚发型帕金森病患者临床异质性的研究[J]. 临床神经病学杂志, 2016, 29:178.
[2]Jessica I, Lundin GN, Ton AZ, et a1. Formulations of hormone therapy and risk of Parkinson’s disease[J]. Movement disorders, 2014, 29:1631.
[3]陈炼, 陈蕾, 张本恕, 等. 女性生育特点对帕金森病的影响[J]. 中国现代神经疾病杂志, 2006, 6:119.
[4]Schartau E, Tolson D,Fleming V.Parkinson’s disease:the effects on woman hood[J]. Nurs Stand, 2003, 17:33.
[5]Tolson D, Fleming V, Schartau E, et al. Coping with menstruation:understanding the needs of women with Parkinson’s disease[J]. J Adv Nurs, 2002, 40:513.
[6]Fabienne S, Sprenger KS, Elisabeth W, et al. Perimenstrual fluctuations in two siblings with early-onset Parkinson’s disease[J]. Mov Disord Clin Prac, 2014,1:125.
[7]王晓杰, 陈黔妹, 刘芳, 等. 帕金森病潜在周围神经损害的电生理特点[J]. 临床神经病学杂志, 2016, 29:175.
[8]陈荣杰, 张本恕, 王世民. 帕金森病的性别差异及其原因探讨[J]. 天津医药, 2009, 37:212.
[9]眭晨燕, 李学忠, 周小平. 雌激素对不同年龄组帕金森病大鼠的影响及其机制[J]. 基础医学与临床, 2015, 35:1351.
[10]刘彬, 谢俊霞. 雌激素对帕金森病模型大鼠中央杏仁核多巴胺释放及其旋转行为的影响[J]. 青岛大学医学院学报, 2002, 38:111.
[11]Cjelsvik B, Rosvold EO, Straand J, el al.Symptom prevalence during menopause and factors associated with symptoms and menopausal age.Results from the norwegian hordaland women’s cohort study[J]. Maturitas, 2011, 70:383.
[12]Koller WC, Barr A, Biary N. Estrogen treatment of metic disorders[J]. Neurology (C1eveknd), 1982, 32:547.
[13]Windham GC, Elkin E, Fenster L, et al.Ovarian hormones in premenopausal women:variation by demographic,reproductive and menstrual cycle characteristics[J]. Epidemiology, 2002, 13:675.
[14]Thulin P, Carter JH, Nichols MD, et al. Menstrual cycle related changes in Parkinson’s disease[J]. Neurology, 1996, 46:A376.
[15]Quinn NP, Marsden CD. Menstrual-related Parkinson’s fluctuations in disease[J]. Mov Disord, 1986, 11:85.
[16]Tolson D, Fleming V, Schartau E. Coping with menstruation: understanding the needs of women with Parkinson’s disease[J]. J Adv Nurs, 2002, 40:513.
[17]Gordon PH, Mehal JM, Holman RC, et al. Parkinson’s disease among American Indians and Alaska natives:a nationwide prevalence study[J]. Mov Disord, 2012, 27:1456.
[18]Ragonese P, D’Amelio M, Salemi Q, et al. Risk of Parkinson’s disease in women:effect of reproductive characterstics[J]. Neurology, 2004, 62:2010.
[19]Nitkowska M, Czyzyk M, Friedman A. Reproductive life characteristics in females affected with Parkinson’s disease and in healthy control subjects-a comparative study on Polish population[J]. Neurol Neurochir Pol, 2014, 48:322.
Related factors analysis of the influence of menstruation on female patients with Parkinson’s disease
WANZhi-rong,ZHANGYu,GAOJing,etal.
DepartmentofNeurology,AerospaceCentralHospital,Beijing100049,China
Objective To investigate the prevalence and clinical characteristics of female patients of childbearing age with Parkinson’s disease during the menstrual period. Methods A case control study was con-ducted using the questionnaire. Female patients with Parkinson’s disease under the age of 50 were selected from outpatient clinics of Aerospace Central Hospital and specialized PD clinic of Beijing Tiantan Hospital between June 2015 to January 2016. These cases were divided into menstrual related group and menstrual unrelated group according to the influence of menstruation. Clinical heterogeneities were analyzed between the two groups. The clinical data of age of onset, educational level, initial symptoms, duration of disease, history of exposure to poison, family history, Unified Parkinson Disease Rating ScaleⅢ(UPDRS-Ⅲ) scores, modified Hoehn-Yahr classification and Beck Anxiety Inventory were collected. Results One hundred and seventy-five cases were collected, including of 42 cases in menstrual related group, and the prevalence was 24%. The menstrual related group and menstrual unrelated group were compared during the non menstrual period and menstrual period separatedly. There were statistically significant differences in age of onset and Beck Anxiety Inventory (allP<0.05) but no significant differences in duration of disease, educational level, history of exposure to poison, family history, UPDRS-Ⅲ scores and modified Hoehn-Yahr classification (allP>0.05) between the two groups during the non menstrual period. There were statistically significant differences in age of onset, UPDRS-Ⅲ scores, modified Hoehn-Yahr classification and Beck Anxiety Inventory (allP<0.000) during the menstrual period.Conclusions Female PD patients of childbearing age are more influenced by menstruation. The deterioration of clinical symptoms manifested as aggravated motor symptoms and these patients are more likely to coexist with anxiety, indicating of the poorer daily life ability and quality. The awareness of the conclusion should be raised.
Parkinson’s disease; menstrual period; prevalence; Beck Anxiety Inventory; worsening of symptoms
100049 北京,航天中心医院神经内科(万志荣,高靖,商梦晴);承德市第六医院内科(张瑜);首都医科大学附属北京天坛医院神经病学中心神经变性病科(苏东宁,冯涛)
冯涛
R742.5
A
1004-1648(2017)03-0200-04
2016-09-14
2014-10-31)

