帕金森病异常表达microRNAs的筛选及microRNA-1976作用机制的初步研究
邱峰,吴越,曹辉,华平,张尧,杜明洋,姜海波
·论著·
帕金森病异常表达microRNAs的筛选及microRNA-1976作用机制的初步研究
邱峰,吴越,曹辉,华平,张尧,杜明洋,姜海波
目的 筛选并验证与帕金森病相关的差异microRNA(miRNAs),初步探讨miR-1976在帕金森病发展中的作用机制。方法 随机选取28例帕金森患者及对照组35例为研究对象。采用μParaflo®微流体芯片技术筛选与帕金森病相关的差异miRNAs,针对组间差异表达3倍以上、且组内差异小的8个miRNAs,进行实时PCR验证芯片重复性,并进一步构建miR-1976过表达慢病毒,通过电子显微镜及流式细胞仪检测miR-1976过表达组多巴胺能神经元细胞凋亡情况。结果 微流体芯片技术筛选出18个PD相关的差异表达miRNAs基因,表达差异3倍以上的8个基因是miR-1976、miR-153、miR-103a、miR-29a、miR-210、miR-375、miR-146a、miR-101a,miR-1976的表达差异最大,结果与miRNA芯片检测结果一致。miR-1976过表达组中发现凋亡小体形成,细胞凋亡率显著增加。结论 miR-1976是一个高差别表达的miRNA,具有促进多巴胺能神经元凋亡的功能,可能为帕金森病患者新的生物标志物。
帕金森病;miR-1976;多巴胺能神经元细胞;凋亡机制
帕金森病(PD)是一种因中脑黑质致密部多巴胺能神经元进行性变性、缺失导致CNS退行性疾病,尽管现有研究已在基因水平初步揭示了多巴胺能神经元凋亡的分子机制[1-2],但以这些基因为干预靶标防治PD的效果并不十分理想。目前已确认microRNA(miRNA)分子在神经退行性疾病发生发展过程中发挥着极为重要的作用[3],如过表达miR-16靶向淀粉样蛋白前体蛋白基因参与了Alzheimer’s病的病理相关机制[4];而重度脊髓性肌萎缩患者血清中存在2个表达失衡的miRNA簇(miR-335-5p、miR-100-5p)等[5]。但目前检索miRNA与PD之间关系的研究却少见报道,提示从多巴胺能神经元凋亡角度,加快PD相关miRNA的研究已十分必要。本研究筛选与PD相关的差异miRNAs并进行验证,初步探讨相关miRNAs在PD发展中的作用机制。
1 对象与方法
1.1 对象 (1)PD组:系2015年1月~2015年12月就诊于南京医科大学附属脑科医院的PD患者共28例,男15例,女13例,年龄(65.8±2.2)岁,最终行实时荧光定量PCR检测的为23例,男12例,女11例;年龄(63.5±1.0)岁。采用中华医学会神经病学分会运动障碍及PD学组制定的PD诊断标准。(2)对照组(NC组)30例,系同期住院的非PD老年患者和体检中心的健康体检者共35例,男18例,女17例,年龄(65.1±2.8)岁。最终行实时荧光定量PCR检测30例,男女各15例,年龄(65.0±0.8)岁。NC组在常规结构像T1WI和T2WI上均排除隐匿性神经系统疾病,无PD、痴呆、糖尿病、关节炎、不稳定心脏病及其他急性病。本研究得到南京医科大学附属脑科医院医学伦理委员会允许,患者均知情同意。
1.2 方法
1.2.1 血浆样本的收集与处理 采集受试者全血3 ml,2 h内分离血浆,3500 r/min,5 min,于DEPC水处理的EP管中,-80℃保存备用。
1.2.2 总RNA的提取 取上述血浆解冻,加入3倍提价的Trizol,反复剧烈震荡充分混匀;室温放置10 min变性处理,加氯仿 200 μl,振荡器上充分混匀,2~8 ℃,14000 × g,离心15 min;将上层水相转移至另一离心管,加入500 μl异丙醇沉淀其中RNA,室温放置2 min后,离心10 min,12000 × g;去上清,加75%乙醇洗涤RNA沉淀,7500 × g,离心5 min;空气中干燥沉淀5~10 min,取适量DEPC水溶解RNA;微量分光光度计对RNA完整性进行鉴定(紫外灯下出现28S、18S和5S区带),-80℃保存,备用。
1.2.3 miRNA的分离提取 取总RNA 100 μg加入5倍体积的Lysis/binding Buffer,置于冰上,加入1/10体积的miRNA Homogenate Additive和1/3体积的100%乙醇,混匀后充分过滤。5000 r/min,离心1 min,弃上清;加入700 μl miRNA 洗涤液 1,5000 r/min,离心1 min,弃上清;加入500 μl miRNA 洗涤液 2,5000 r/min,离心1 min,弃上清,重复2次,弃掉残余液体;将50 μl,95 ℃的洗脱液加入滤器中,室温孵育2 min;10 000 r/min,离心1 min,收集包含miRNA的滤液。
1.2.4 miRNA芯片杂交 配制杂交液含15%甲酰胺2.4 μl,0.2%SDS 3.2 μl,3×SSC 2.4 μl,50×Denhard’s 1.6 μl,DEPC处理水6.4 μl,总计16 μl,将RNA溶于杂交液中,金属浴加温,混匀;取出置-20 ℃ 10 min;95 ℃变性3 min;置于冰上,将RNA滴加至μParaflo®microRNA芯片V3.0,加硅化盖玻片;将杂交盒置于湿润的滤纸,42 ℃,24 h;以42 ℃的0.2%SDS,2×SSC漂洗4 min;室温下,以0.2×SSC温洗4 min,玻片置于管中,2000 r/min,1 min甩干,进行芯片扫描。
1.2.5 实时荧光定量PCR 提取受试者血清中RNA,合成针对8个miRNAs(miR-1976、miR-153、miR-103a、miR-29a、miR-210、miR-375、miR-146a、miR-101a)和1个内参U6的反转录引物(锐博生物提供),用FastQuant RT kit(TIANGEN提供)逆转录合成cDNA。cDNA样品行实时定量PCR反应,体系配置如下:10 μl SYBR Green染料(TaKaRa公司提供),1 μl 上、下游引物,1 μl dNTPs,2 μl Taq聚合酶,5 μl待测样品cDNA,总反应体系20 μl。ABI Prime 7300定量PCR检测仪,参数设为95℃预变性10 min,95℃ 5 s,60℃ 2 min,40个循环,单点荧光在60℃进行检测,选择FAM荧光检测模式,对于实验数据,以下公式进行计算:2-△△CT=2-(CT.miRNA-CT.U6)Time x + (CT.miRNA-CT.U6)Time 0.
1.2.6 神经元细胞病理检测 将MES23.5多巴胺能神经元细胞胰酶消化后,收集离心管内,以预冷PBS洗涤,800~1000 r/min,离心10 min,去上清。以PBS重悬,1500 r/min,离心10 min,使多巴胺能神经元细胞压缩成团,大小以1 mm为宜。压缩的细胞团用2.5%戊二醛及1%锇酸双固定,Epon 812包埋后,超薄切片、染色,在JEM-1010透射电镜下观察多巴胺能神经元细胞(凋亡、坏死)超微结构的病理改变。
1.2.7 多巴胺能神经元细胞凋亡检测 用胰酶消化对数期生长的多巴胺能神经元细胞,采用4℃无菌的PBS,洗涤多巴胺能神经元细胞,重复两次。采用250 μl结合缓冲液重悬多巴胺能神经元细胞。取100 μl的细胞悬液重悬细胞,分别加入5 μl Annexin V-FITC和10 μl 的PI溶液,室温下,避光,孵育30 min。加入400 μl结合缓冲液,1 h内流式细胞仪分析检测。FITC荧光检测分别采用激发光波长488 nm,波长为515 nm的带通滤器,PI检测采用>560 nm的滤器。
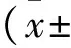
2 结 果
2.1 miRNA 芯片检测结果 通过芯片对13例PD患者和11例NC组受试者血浆miRNA 进行定量检测,结果提示,可筛选出18个PD相关的差异表达miRNAs基因(均P<0.05);PD患者血浆表达11个上调(miR-29a、miR-103a、miR-1976、miR-153、miR-30b、miR-103a、miR-7、miR-9、miR-129、miR-132、miR-105),7个下调(miR-210、miR-375、miR-146a、miR-101a、miR-34b、miR-34c、miR-56)。其中表达上调3倍以上基因的是miR-1976、miR-153、miR-103a、miR-29a、miR-210、miR-375、miR-146a、miR-101a。
2.2 实时荧光定量PCR 采用实时荧光定量PCR 技术,验证芯片检测结果验证部分差异miRNAs在PD组及NC组血清中的表达(图1),结果发现miR-1976的表达差异最大,在PD组中其表达量为NC组的5.64倍,具有显著的统计学差异(P<0.01),结果与miRNA芯片检测结果一致。
2.3 miR-1976过表达对多巴胺能神经元细胞凋亡的影响 构建miR-1976过表达慢病毒,感染体外培养的MES23.5多巴胺能神经元细胞株,电子显微镜下观察发现,感染miR-1976过表达慢病毒载体12 h后,多巴胺能神经元细胞明显有凋亡小体形成(图2);流式细胞仪技术检测发现,miR-1976过表达组多巴胺能神经元细胞凋亡显著增加(图3)。
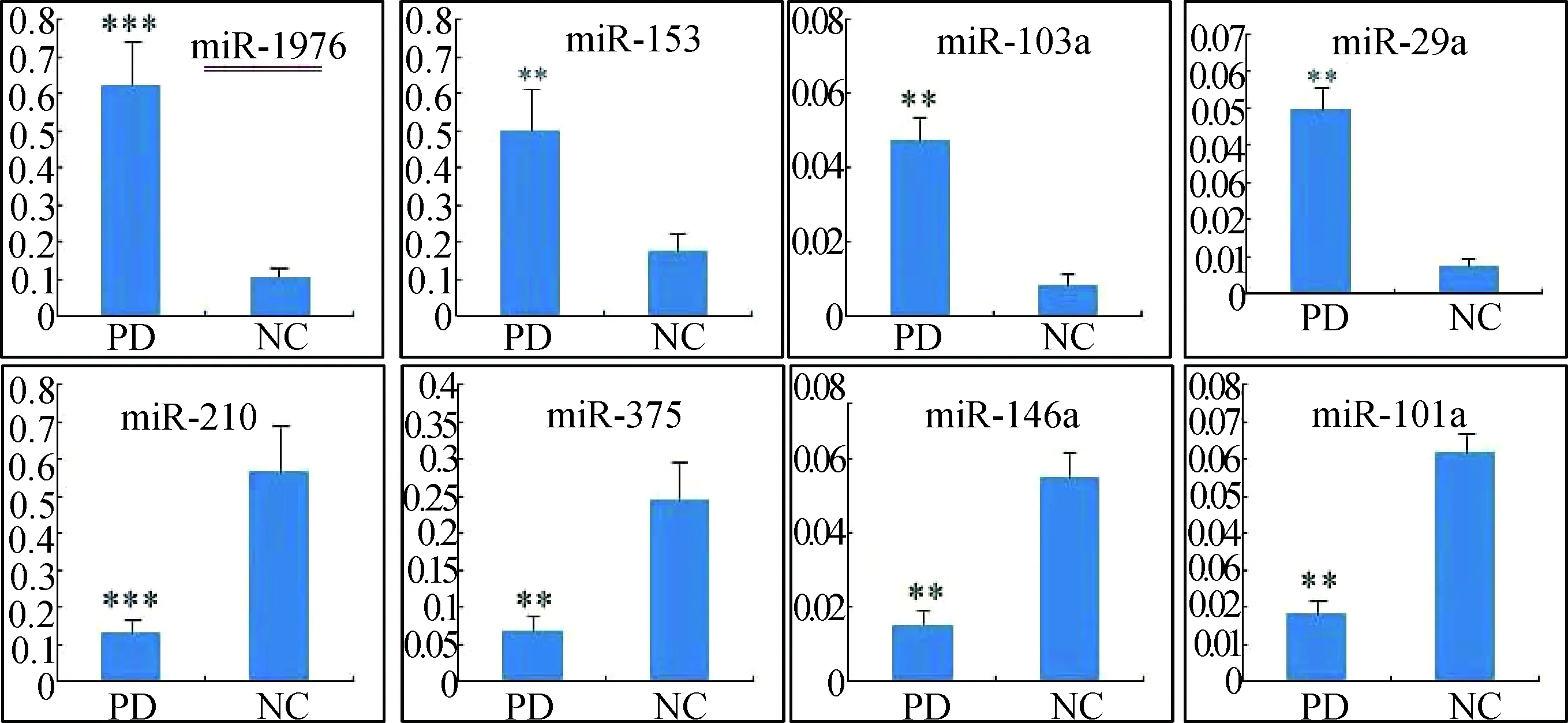
图1 验证miRNAs在PD组和NC组受试者血清中的表达 (与NC组比较,**P<0.01,***P<0.001)
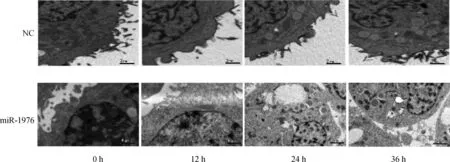
图2 电镜下多巴胺能神经元细胞的凋亡情况(× 3700)
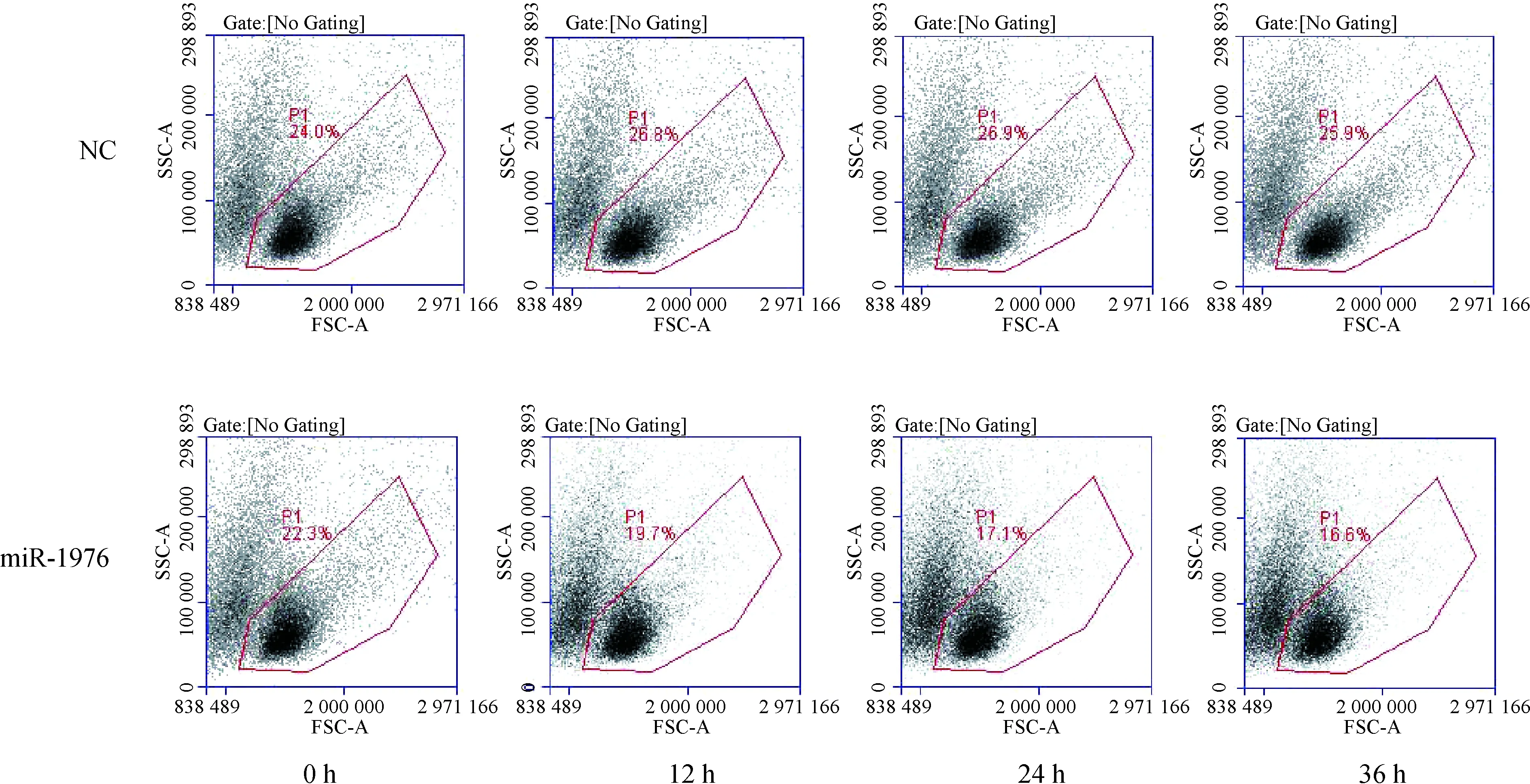
图3 多巴胺能神经元细胞的凋亡情况
3 讨 论
本研究结果显示,miR-1976 在PD患者中的表达量显著升高,可能作为PD的一种潜在的生物标志物,但miR-1976表达水平与PD的诊断是否具有特异性,尚需进一步扩大样本量进行验证,以明确不同程度患者间的miR-1976的表达量是否存在差异。为了解miR-1976的研究现状,经检索阅读相关文献,回顾其相关研究进展发现,miR-1976相关研究未见任何文献报道,以“miR-1976”或“miRNA-1976”搜索PubMed,文献为0篇,完全是一条功能未知的miRNA。而本实验利用miRNA 芯片及实时荧光定量PCR技术弥补了这方面的空白。
血液循环中miRNA以外切体或者结合高密度脂蛋白形式稳定存在于血浆中,其主要来源为多种细胞的出芽、胞吐或以其他方式主动分泌[6]。而血浆中的miRNA可以再次进入细胞内,进入的方式主要以特异性结合受体及完成胞吞过程为主,由此可见血液循环中的miRNA在不同细胞间互相作用的进程中起到一如同激素或细胞活性因子一样的中介作用[7-8]。结合本研究结果,在血液循环miR-1976可能间接反映脑组织内miR-1976的表达变化,但PD患者血浆中miR-1976 表达水平上升的原因和机制尚需进一步研究。本研究为进一步了解miR-1976与多巴胺能神经元凋亡之间的关系,通过构建miR-1976过表达慢病毒,感染多巴胺能神经元以实现过表达,进一步研究了miR-1976在多巴胺能神经元凋亡中的机制,结果提示miR-1976可以促进多巴胺能神经元细胞的凋亡过程。结合本研究中提示PD患者的血液中miR-1976的表达是上升的,其机制可能是miR-1976通过PD 的PINK1机制影响PD病程的进展:PINK1作为肿瘤表达谱的重要基因,其定位于线粒体基质和膜间隙中,且含有精确的线粒体靶向序列。沉默PINK1可致MEF2活性降低,具有诱导肿瘤细胞凋亡的效应[9]。已有研究[10]也证实,突变导致PINK1功能失常,直接诱导线粒体功能障碍致使多巴胺能神经元凋亡可能引发PD的发生发展,由此推测PINK1可能为miR-1976的直接靶基因,miR-1976可能通过直接作用于其靶基因PINK1信号通路,在诱导多巴胺能神经元凋亡及PD中发挥重要作用,后期研究将进一步分析。既往文献[11]报道对PD患者血清样本中PINK1基因的表达加以验证表明,PINK1基因在PD血清中表达水平显著下调。miR-1976可能通过与PINK1信号通路相互作用、诱导多巴胺能神经元的凋亡,极可能是PD发生的分子机制。
综上所述,本研究通过开展PD患者血清miRNA表达谱的研究,筛选并验证了PD患者血清差异表达的miRNAs,从中选取到一个高差别表达的miRNA作为PD患者生物标志物,为后续进一步研究miRNA在PD发病机制中的作用奠定了基础。但本研究也具有不足之处,样本量偏小,下一步拟扩大样本量进一步研究靶基因明确其作用的信号通路及靶点,进一步推动循环miRNA用于PD的早期诊断及预后治疗的相关研究。
[1]Ryan SD, Dolatabadi N, Chan SF,et al. Isogenic human iPSC Parkinson’s model shows nitrosative stress-induced dysfunction in MEF2-PGC1α transcription[J]. Cell, 2013,155: 1351.
[2] Hernandez-Baltazar D, Mendoza-Garrido ME, Martinez-Fong D. Activation of GSK-3β and caspase-3 occurs in Nigral dopamine neurons during the development of apoptosisactivated by a striatal injection of 6-hydroxydopamine[J]. PLoS One, 2013, 8: e70951.
[3]Cardo LF, Coto E, Ribacoba R, et al. MiRNA profile in the substantia nigra of Parkinson ’s disease and healthy subjects[J]. J Mol Neurosci, 2014, 54: 830.
[4]Liu W, Liu C, Zhu J,et al. MicroRNA-16 targets amyloid precursor protein to potentially modulate Alzheimer ’s-associated pathogenesis in SAMP8 mice[J]. Neurobiol Aging, 2012, 33: 522.
[5]Luchetti A, Ciafrè SA, Murdocca M, et al. A perturbed microRNA expression pattern characterizes embryonic neural stem cells derived from a severe mouse model of spinal muscular atrophy (SMA)[J]. Int J Mol Sci, 2015, 16:18312.
[6]Mo MH, Chen L, Fu Y, et al. Cell-free circulating miRNA biomarkers in cancer[J]. J Cancer, 2012,3: 432.
[7]Vickers K, Remaley A. Lipid-based carriers of microRNAs and intercellular communication[J]. Curr Opin Lipidol,2012,23:91.
[8]Duttagupta R, Jiang R, Gollub J, et al. Impact of cellular miRNAs on circulating miRNA biomarker signatures[J]. Plos One, 2011,6:e20769.
[9]Grenier K, Kontogiannea M, Fon EA. Short mitochondrial ARF triggers Parkin/PINK1-dependent mitophagy[J]. J Biol Chem, 2014, 289: 29519.
[10]Hertz NT, Berthet A, Sos ML, et al. A neo-substrate that amplifies catalytic activity of Parkinson’s-disease-related kinase PINK1[J]. Cell, 2013, 154: 737.
[11]Wang X, Winter D, Ashrafi G, et al. PINK1 and Parkin target miro for phosphorylation and degradation to arrest mitochondrial motility[J]. Cell, 2011, 147:893.
Study of aberrantly expressed microRNAs involved in Parkinson’s disease and effective mechanism of miRNA-1976
QIU-Feng,WU-Yue,CAO-Hui,etal.
CerebrovascularDiseaseCenter,NanjingBrainHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing210029,China
Objective To screen and verify aberrant microRNA(miRNAs) in Parkinson’s disease, study the effective mechanism of miR-1976 in Parkinson ’s disease.Methods Twenty-eight patients with Parkinson’s disease and 35 controls were investigated in a case-control study. The miRNA expression profiles were analyzed using μParaflo® miRNA microarray. Eight aberrant miRNAs that were over threefold difference between groups and minimum difference within groups were then verified by real-time PCR. Lentiviral vectors were constructed for miR-1976, then the effect of apoptosis in dopaminergic neuron cell were analyzed by electron microscope and flow cytometry. Results Eighteen aberrant miRNAs were identified by miRNA microarray, including 8 over threefold difference expression of miRNAs:miR-1976,miR-153,miR-103a,miR-29a,miR-210,miR-375,miR-146a,miR-101a. Among them, the expression of miR-1976 was verified to be highest. Apoptotic bodies and apoptosis rate were significantly increased with high expression of miR-1976. Conclusion miR-1976 is a newly discovered miRNA with high differential expression concerning the apoptosis of dopaminergic neuron cell, and it may be involved in the process of Parkinson’s disease as a new biomarker.
Parkinson’s disease;miR-1976;dopaminergic neuronal cell;mechanism of apoptosis
210029 南京医科大学附属脑科医院脑血管病救治中心(邱峰,曹辉,张尧,杜明洋,姜海波),神经内科(华平);南京医科大学附属儿童医院新生儿医疗中心(吴越)
吴越
R742.5
A
1004-1648(2017)03-0171-04
2016-11-12
2016-12-15)

