偏头痛脑白质高信号与临床特征及右向左分流的相关分析
谢惠,张强,荐志洁,卞益同,霍康,刘蕊,朱丹,张丽辉,杨健,罗国刚
·论著·
偏头痛脑白质高信号与临床特征及右向左分流的相关分析
谢惠,张强,荐志洁,卞益同,霍康,刘蕊,朱丹,张丽辉,杨健,罗国刚
目的 从临床特征角度探索偏头痛脑白质高信号(WMHs)的危险因素,并研究右向左分流(RLS)是否与偏头痛WMHs有关。方法 纳入偏头痛患者,采集头痛资料,进行对比增强TCD检查是否存在RLS以及分流量大小,并行头颅MRI检查评估WMHs。结果 共纳入57例偏头痛患者,其中合并WMHs共 18例(31.6%),主要位于额、顶叶,病变程度较轻。在对年龄、性别、头痛特征、焦虑抑郁评分以及RLS等因素的分析中,发现合并WMHs组与不合并WMHs组之间,仅年龄(P=0.002)、病程(P=0.046)存在统计学差异。结论 偏头痛患者中发现的WMHs,主要位于额、顶叶,年龄、病程可能是其危险因素,未发现先兆、发作频率、持续时间、疼痛程度、焦虑抑郁等临床特征与其相关,也未发现RLS会增加偏头痛患者WMHs的风险。
偏头痛;脑白质高信号;右向左分流
偏头痛是一种常见的原发性头痛,在世界范围内患病率为14.7%,全球常见病位列第3,致残性疾病位列第6[1]。2012年的一项流行病学调查显示,偏头痛在中国的年患病率为9.3%[2]。其临床特征为反复发作的单侧或双侧搏动性头痛,伴有恶心呕吐或者畏光畏声,约有三分之一的患者还伴随有先兆。既往认为偏头痛不伴有脑结构异常,可是随着影像技术的发展,偏头痛患者脑白质高信号(WMHs)的检出率逐渐增高,目前关于偏头痛WMHs的发生机制并不十分明确,其危险因素也存在着争论。近年来研究发现,偏头痛患者卵圆孔未闭(PFO)的发生率较高。卵圆孔是胎儿时期血液循环的必要通道,在1岁以前原发隔和继发隔相互融合继而卵圆孔闭合,3岁以上仍未闭合者称为PFO,PFO是血液循环右向左分流(RLS)最常见的原因。有猜测认为PFO可能通过RLS造成的反常栓塞或血管活性物质增加从而引起偏头痛。本研究旨在通过研究偏头痛的临床特征来探索WMHs的危险因素,并研究RLS是否与偏头痛WMHs有关。
1 对象与方法
1.1 对象 收集2012年3月~2016年8月在西安交通大学第一附属医院头痛门诊就诊的偏头痛患者。纳入标准:(1)符合国际头痛分类诊断标准;(2)年龄在12~60岁;(3)自愿签署知情同意书。排除标准:(1)其他原发性头痛;(2)脑血管病史;(3)颅内明显器质性疾病;(4)特发性脑白质病变(多发性硬化、脑白质营养不良);(5)甲状腺疾病、肿瘤疾病等;(6)止痛药、酒精滥用者;(7)存在MRI检查禁忌。
1.2 方法
1.2.1 临床资料采集 包括年龄、性别、头痛病程(个月)、发作频率(d/月)、持续时间(h)、疼痛程度(采用数字评分法,0分为无痛,10分为最剧烈的疼痛)、伴发先兆以及既往高血压、糖尿病病史,并通过焦虑自评量表(SAS)及抑郁自评量表(SDS)评估患者有无情绪障碍。
1.2.2 RLS评估 利用对比增强TCD(cTCD)评估患者是否存在RLS,结果评判:(1)存在分流:静息状态下或瓦氏动作后监测到有微栓子信号;(2)中大量分流:微栓子信号>10个以上;(3)自发性分流:静息状态下即可监测到栓子信号,即存在持续性或自发性分流。
1.2.3 影像学检查 采用3.0 T MRI仪、头颅八通道线圈。采集T1WI、T2WI以及Flair,层厚5 mm,层间距6 mm。WMHs信号表现:T2WI及Flair图像上呈高信号,T1WI上呈等或低信号改变。由一名影像科医生及一名神经内科医生进行WMHs评价,当两位评估者意见不一致时,通过讨论达成一致意见。WMHs评估内容主要包括白质高信号的分布位置(额叶、顶叶、颞叶、枕叶、幕下或基底节区)、数目、大小(病灶长径),并通过Fazekas量表对脑室周围WMHs进行评分,通过改良Scheltens量表对脑深部WMHs进行评分。评分标准如下,Fazekas脑室旁WMHs评分(0~3分):(1)0分:无病变;(2)1分:帽状或者铅笔样薄层病变;(3)2分:病变呈光滑的晕圈;(4)3分:不规则的脑室旁高信号,延伸到深部白质。改良Scheltens深部WMHs评分(0~24分):(1)额叶:0~6分;(2)顶叶:0~6分;(3)枕叶:0~6分;(4)颞叶:0~6分。其中:(1)0分:无异常;(2)1分:病变范围≤3 mm,数量≤5;(3)2分:病变范围≤3 mm,数量≥6;(4)3分:病变范围在3~10 mm之间,数量≤5;(5)4分:病变范围在3~10 mm之间,数量≥6;(6)5分:病变范围>10 mm,数量≥1;(7)6分:病变融合[3]。
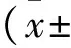
2 结 果
2.1 偏头痛患者一般资料 共纳入偏头痛患者57例,其中男13例,女44例;年龄14~60岁,平均(34.8±11.4) 岁。先兆偏头痛15例,无先兆偏头痛42例。根据有无WMHs分为两组:合并WMHs(WMHs组)18例,不合并WMHs(non-WMHs组)39例。57例患者中,共有4例合并高血压病,其中WMHs组2例,non-WMHs组2例。无糖尿病患者。病程120(60, 234)个月,发作频率3.0(2.0, 9.5)d/月,持续时间5.0(3.0, 12.0) h,头痛程度7.0(6.2, 8.1)分。
2.2 WMHs特征 57例偏头痛患者中,共18例检出WMHs(图1),其中,脑室旁WMHs4例,深部WMHs17例。所有患者中共检出深部WMHs病灶数150个,主要位于额、顶叶。其中额叶病灶101个,顶叶病灶44个,颞叶病灶2个,枕叶病灶0个,幕下病灶1个,基底节区病灶2个;且以小病灶为主,其中病灶长径≤3 mm者119个(79.3%),大小在3~10 mm之间者31个(20.7%),未发现≥10 mm的病灶。在WMHs组中,大多数患者WMHs数目在7个以下,只有3例病灶数目较多,分别为20个、48个、52个,年龄分别为39岁、60岁、54岁,其中39岁病例患有高血压病。总体来说,偏头痛患者中发现的WMHs病变程度较轻,Fazekas量表和改良Scheltens量表评分得分均低,脑室周围WMHs评分均为1,脑深部WMHs评分为1~7分。
2.3 偏头痛WMHs与临床特征 见表1。对偏头痛临床特征进行分析,结果显示,在WMHs组与non-WMHs组之间,年龄以及病程均存在统计学差异(均P﹤0.05)。进一步对先兆分析发现,先兆组患者年龄(26.9±10.4)岁较无先兆组(37.6±10.5)岁更轻,差异具有统计学意义(P=0.001)。由于高血压是脑白质损伤的一个不可忽视的确切危险因素,因此为了排除这一混杂因素,将4例高血压患者剔除,按照同样的统计学方法进行统计分析,结果与表1相似,在WMHs组和non-WMHs组之间,年龄(P=0.003)及病程(P=0.03)存在统计学差异,而性别(P=0.863)、先兆(P=0.241)、发作频率(P=0.404)、持续时间(P=0.616)、头痛程度(P=0.279)及SAS评分(P=0.380)、SDS评分(P=0.457)未见统计学差异。

图1 偏头痛患者头颅MRI检查 右侧额叶一处异常信号影,T1WI相呈低信号,T2WI相呈稍高信号,Flair像呈高信号

表1 WMHs组和non⁃WMHs组临床资料的比较[x±s,例,%,M(Q25,Q75)]WMHs组non⁃WMHs组t值U值χ2值P值年龄41.6±8.431.7±11.4-3.280--0.002女性14(77.8)30(76.9)--0.0001.000先兆3(16.7)12(30.8)--0.6410.423病程(个月)180(84,300)120(48,216)-235.0-0.046发作频率(d/月)4.0(2.0,10.5)3.0(2.0,7.0)-249.0-0.266持续时间(h)5.0(3.0,18.0)5.0(3.3,11.5)-284.5-0.681头痛程度(分)7.0(6.9,8.8)7.1(6.0,8.0)-277.0-0.253SAS评分(分)46.7±10.243.5±8.6-1.200--0.236SDS评分(分)51.5(37.5,61.3)41.5(36,57.3)-290.0-0.361
2.4 偏头痛WMHs与RLS的结果分析 见表2。共有35例偏头痛患者行cTCD检查,其中7例合并WMHs,28例不合并WMHs。存在分流者25例(46.3%),中大量分流者16例(29.6%),自发性分流者13例(24.1%)。Fisher精确检验结果提示是否存在分流、分流量大小以及是否存在自发分流在WMHs组与non-WMHs组之间差异无统计学意义。在剔除高血压患者后,结果未发生实质改变。进一步分析了脑室周围WMHs及脑深部WMHs评分,结果显示在性别、先兆、RLS各组中均差异无统计学意义。
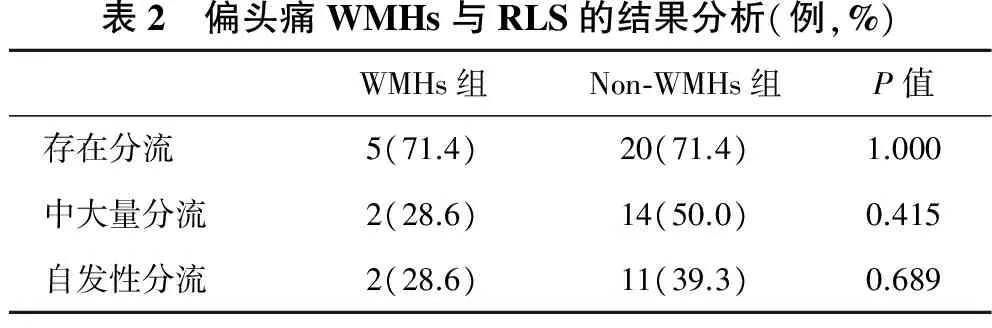
表2 偏头痛WMHs与RLS的结果分析(例,%)WMHs组Non⁃WMHs组P值存在分流5(71.4)20(71.4)1.000中大量分流2(28.6)14(50.0)0.415自发性分流2(28.6)11(39.3)0.689
3 讨 论
本研究中偏头痛的WMHs发生率为31.6%,这与既往文献[4]报道基本相符,而且本研究里偏头痛患者中发现的WMHs主要位于额、顶叶,病变程度较轻,多表现为数目较少且面积较小。
既往较多研究[4-6]发现,偏头痛较一般人群更容易出现WMHs,好发部位多在额、顶叶,然而对于WMHs的危险因素研究结论不一。Swartz等[7]的一项荟萃分析发现偏头痛患者合并WMHs的风险是正常对照人群的3.9倍,并且先兆偏头痛患者较无先兆偏头痛患者有更高的WMHs发生率。基于人群的CAMERA研究[8]发现,先兆偏头痛出现无症状性后循环梗死的发生率明显高于对照组(OR=13.7),女性偏头痛患者是深部WMHs的独立危险因素(OR=2.1),病程长及频率高亦是危险因素。一个小样本量纵向研究[9]发现,先兆偏头痛WMHs发生率是63.4%,3年后随访发现19.5%的患者出现了新发病灶,且新发病灶的数量与先兆持续时间及发作频率相关。Erdelyi-Botor等[10]的研究发现偏头痛合并WMHs组较不合并WMHs组的病程更长、总发作次数更高。然而另一方面,Zhang等[11]发现偏头痛患者WMHs与性别、病程、发作频率、先兆无显著关联,而和年龄相关,尤其是高WMHs负荷组。Gaist等[12]的双胞胎人群研究提示偏头痛患者WMHs以及无症状性脑梗死与先兆无关。这些研究结果的不一致可能是由于研究对象的选择、样本量、研究方法、MRI扫描参数、统计方法的不同所引起。本研究未在有先兆和无先兆组发现统计学差异,分析可能为先兆组较无先兆组患者年龄明显年轻,年龄对于大脑结构功能的作用影响本身就是显著的,不能排除年龄的作用掩盖了先兆的作用,故而导致出现阴性结果;但同时也存在另一种可能,先兆可能不是脑白质损伤的主要危险因素,亦有其他研究[11-12]得出相同结果,这可能是由于研究对象年龄段不同、群体不同所致。另外,本研究没有发现偏头痛WMHs与发作频率、持续时间、疼痛程度相关,发作频率、持续时间、疼痛程度等指标混杂有很强的主观因素以及回忆偏倚,而且由于偏头痛是一种发作性疾病,发作可以不规律,某段时期内的发作频率、持续时间、疼痛程度并不能反映病情严重程度,这也可能是导致各研究结果不一致的原因。在以后的研究中,应该寻找一个更能反映病情程度的指标,如头痛“频繁化”或“慢性化“时间(即头痛从极偶发转为频发或慢性化的时间)。本研究结果显示年龄是偏头痛患者中WMHs的危险因素,现已明确正常人群中大脑白质损伤随着年龄的增长而增多或加重,这一结果与正常人群的规律一致。此外还发现WMHs组较non-WMHs组病程更长,差异具有统计学意义,提示偏头痛病程越长,发生WMHs的概率越大,病程可能是偏头痛WMHs的一个危险因素。然而不可忽视的是,病程越长,相应年龄越大,年龄有可能作为混杂因素影响结果。由于本研究样本量偏小,无法进一步行分层分析排除年龄的影响,需要扩大样本量。本研究还比较了WMHs组与non-WMHs组SAS、SDS评分差异是否存在统计学意义,结果显示WMHs组SAS、SDS评分较non-WMHs组稍高,但差异尚不具有统计学意义。
一个值得注意的事情是,RLS并未发现与偏头痛WMHs有关。研究[13]发现,RLS的存在并没有增加先兆偏头痛患者的WMHs评分分数,而且在多元回归分析中,仅发现年龄是WMHs的危险因素。另外两项研究[14-15]亦得出类似结论。另有一项关于儿童及青少年偏头痛WMHs的研究[6]也发现,WMHs与先兆、PFO以及分流量大小无明显关联。此外,一项关于PFO和卒中的大型人群队列研究[16]发现,在平均11年的随访观察中,PFO阳性组和PFO阴性组在卒中的发生率上无明显差异,亚临床脑梗死以及WMHs负荷亦无明显差异。与此相反,Park等[17]发现偏头痛患者脑深部白质小型损伤与RLS相关,然而其RLS组与非RLS组相比,年龄及高血压比率均显著较高,这可能是本研究结果不一致的原因之一。另一研究[18]发现偏头痛患者近皮质损伤与RLS相关,但同样其研究对象平均年龄48岁,不排除年龄差异致结果不同。PFO是体循环右向左分流的常见形式之一,在人群中的患病率在25%左右,与隐匿性卒中关系密切,机制被认为是人体静脉系统内的栓子可能通过这一异常通道进入动脉系统,造成反常栓塞。PFO 也被发现在偏头痛患者中检出率增高,从而有猜测认为PFO可能在偏头痛的发生机制中扮演重要角色,一种假说即是反常栓塞,偏头痛WMHs也多被认为是缺血引起,另一种则是认为有血管活性物质(如5-羟色胺),没有经过肺脏灭活处理,直接进入动脉系统。动脉血中活性物质增高,刺激到较为敏感的颅脑神经血管组织,血管异常收缩舒张,从而引发头痛,甚至一过性缺血事件发生,即为先兆。然而本研究结合其他多数研究结果并没有证实PFO或RLS与偏头痛WMHs存在必然联系。可能由于RLS造成脑损伤的一个前提条件是循环系统内存在栓子,而偏头痛患者人群较为年轻,血管危险因素并不多见,缺乏栓子形成的条件,所以较少发生与RLS相关的反常栓塞。因此,偏头痛人群中发现的WMHs可能并不能用RLS来解释。
本研究采用cTCD评估RLS。经食道超声心动图被认为是目前诊断PFO的金标准,它可以显示经PFO的异常血流,还能获得房间隔微细形态的图像,可以测量未闭卵圆孔的大小,具有较高的灵敏性(89%)和特异性(100%)。然而这种检查方式常给患者带来不适感,部分患者无法耐受。而cTCD对于PFO检测也同样有着较高的灵敏性(96.8%)和特异性(78.4%)[19]。另外,cTCD相比经食道超声心动图创伤性更小,给患者带来的不适感更轻。因此,目前cTCD是检测RLS最常用的筛查试验,很多研究也常采用cTCD来评估RLS,故本研究采用cTCD检测RLS是较为可靠的检测方法。
总体来说,本研究未能在临床特征方面发现特殊差异,一方面可能是由于样本量较小,需要扩大样本量继续观察;另一方面,将从血液指标着手进行更深层次的分析,以探索偏头痛中发生WMHs的机制。
本研究不足之处:第一,样本量较小是本研究最主要的缺陷,导致研究对象对研究总体的代表性较差,从而容易产生偏倚误差;由于本研究确定研究对象时实行了严格的纳入排除标准,所有偏头痛患者均符合国际头痛分类诊断标准,且排除了合并其他类型头痛、药物滥用等情况,病例纳入速度较慢,故而样本量较少,后续将继续收集病例扩大样本量进一步分析。第二,检查方法中MRI层厚及层间距较大,相对会漏掉一些病灶,从而对结果产生一定影响。第三,由于目前未设置健康对照组,无法验证偏头痛WMHs的出现是由于疾病本身还是年龄影响的结果。另外本研究也无法说明偏头痛患者中发现的WMHs是否具有临床意义。针对目前研究存在的主要缺陷,本课题组后续将继续扩大样本量,并收集健康对照,采用薄层Flair序列(1 mm)扫描,同时完善认知功能评估,以进一步探索偏头痛WMHs的意义。
本研究发现,偏头痛患者中发现的WMHs,主要位于额、顶叶,病变程度较轻;年龄、病程是其危险因素;未发现先兆、发作频率、持续时间、疼痛程度、焦虑抑郁等临床特征与其相关。同时,本研究也未发现RLS会增加偏头痛患者脑白质损伤的风险。
[1]Diener HC, Dodick DW. Headache research in 2015: progress in migraine treatment[J]. The Lancet Neurology, 2016, 15: 4.
[2]Yu S, Liu R, Zhao G, et al. The prevalence and burden of primary headaches in China: a population-based door-to-door survey[J]. Headache, 2012, 52: 582.
[3]魏娜, 王拥军, 张玉梅. 脑白质病变4个分级量表的信度研究[J]. 中国康复理论与实践, 2012, 18: 562.
[4]Yilmaz Avci A, Lakadamyali H, Arikan S, et al. High sensitivity C-reactive protein and cerebral white matter hyperintensities on magnetic resonance imaging in migraine patients[J]. J Headache Pain, 2015, 16: 9.
[5]闫呈新, 赵雷, 朱建忠, 等. 偏头痛患者脑白质损害的MRI特征[J]. 临床神经病学杂志, 2014, 27: 342.
[6]Candee MS, McCandless RT, Moore KR, et al. White matter lesions in children and adolescents with migraine[J]. Pediatr Neurol, 2013, 49: 393.
[7]Swartz RH, Kern RZ. Migraine is associated with magnetic resonance imaging white matter abnormalities: a meta-analysis[J]. Arch Neurol., 2004, 61: 1366.
[8]Kruit MC, van Buchem MA, Launer LJ, et al. Migraine is associated with an increased risk of deep white matter lesions, subclinical posterior circulation infarcts and brain iron accumulation: the population-based MRI CAMERA study[J]. Cephalalgia, 2010, 30: 129.
[9]Dinia L, Bonzano L, Albano B, et al. White matter lesions progression in migraine with aura: a clinical and MRI longitudinal study[J]. J Neuroimaging, 2013, 23: 47.
[10]Erdelyi-Botor S, Komaromy H, Kamson DO, et al. Serum L-arginine and dimethylarginine levels in migraine patients with brain white matter lesions[J]. Cephalalgia, 2017, 37:571.
[11]Zhang Q, Datta R, Detre JA, et al. White matter lesion burden in migraine with aura may be associated with reduced cerebral blood flow[J]. Cephalalgia, 2016, 37:517.
[12]Gaist D, Garde E, Blaabjerg M, et al. Migraine with aura and risk of silent brain infarcts and white matter hyperintensities: an MRI study[J]. Brain, 2016, 139: 2015.
[13]Adami A, Rossato G, Cerini R, et al. Right-to-left shunt does not increase white matter lesion load in migraine with aura patients[J]. Neurology, 2008, 71: 101.
[14]Del Sette M, Dinia L, Bonzano L, et al. White matter lesions in migraine and right-to-left shunt: a conventional and diffusion MRI study[J]. Cephalalgia, 2008, 28: 376.
[15]Koppen H, Palm-Meinders IH, Mess WH, et al. Systemic right-to-left shunts, ischemic brain lesions, and persistent migraine activity[J]. Neurology, 2016, 86: 1668.
[16]di Tullio MR, Jin Z, Russo C, et al. Patent foramen ovale, subclinical cerebrovascular disease, and ischemic stroke in a population-based cohort[J]. J Am Coll Cardiol, 2013, 62: 35.
[17]Park HK, Lee SY, Kim SE, et al. Small deep white matter lesions are associated with right-to-left shunts in migraineurs[J]. J Neurol, 2011, 258: 427.
[18]Yoon GJ, Kim JT, Chang J, et al. Right-to-left shunts as a cause of juxtacortical spots in patients with migraine[J]. Eur J Neuro, 2012, 19: 1086.
[19]Guo S, Shalchian S, Gerard P, et al. Prevalence of right-to-left shunts on transcranial Doppler in chronic migraine and medication-overuse headache[J]. Cephalalgia, 2014, 34: 37.
Association analysis of the white matter hyperintensities and clinical characteristics and right-to-left shunt in migraine
XIEHui,ZHANGQiang,JIANZhi-jie,etal.
DepartmentofNeurology,theFirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China
Objective To explore the risk factors of white matter hyperintensities (WMHs) in migraine patients from the perspectives of clinical characteristics and to investigate whether right-to-left shunt (RLS) relates to the WMHs. Methods Migraine patients were recruited to complete a questionnaire involving headache features, and underwent contrast-enhanced TCD for detecting the presence and grade of RLS and brain MRI scanning for WMHs evaluation. Results Fifty-seven migraine patients were enrolled. WMHs were detected in 18 cases(31.6%). The WMHs were mainly located in the frontal and parietal lobe and the lesions were generally mild. The differences of age, gender, headache features, scores of anxiety and depression and RLS between WMHs group and non-WMHs group were compared, and only age (P=0.002) and disease duration (P=0.046) showed significant differences.Conclusions WMHs in migraine are mainly located in frontal and parietal lobe. Age and disease duration may be the risk factors of the WMHs. The associations between the presence of WMHs and the presence of aura, attack frequency, headache duration, headache degree or anxiety and depression are not found. RLS is neither associated with the risk of WMHs in migraine.
migraine;white matter hyperintensities;right-to-left shunt
国家十二五科技支撑计划(2014BAI04B05)
710061 西安交通大学第一附属医院神经内科(谢惠,霍康,刘蕊,朱丹,张丽辉,罗国刚),影像科(荐志洁,卞益同,杨健);陕西省人民医院神经内科(张强)
罗国刚
R747.2
A
1004-1648(2017)03-0166-05
2016-08-21
2016-11-09)

