脑白质损害对急性缺血性卒中患者短期功能结局的影响
韩凝,贾阳娟,王美蓉,贾艳丽,赵景茹,肖向建,王建华
·论著·
脑白质损害对急性缺血性卒中患者短期功能结局的影响
韩凝,贾阳娟,王美蓉,贾艳丽,赵景茹,肖向建,王建华
目的 探讨脑白质损害对急性缺血性卒中患者3个月功能结局的影响。方法 收集2013年8月~2016年1月入院的首次急性缺血性卒中患者402例,进行头颅MRI检查,采用与年龄相关的白质改变评分(ARWMC)对脑白质损害严重程度进行评估。通过mRS评估患者发病3个月的功能结局。采用多元Logistic回归分析筛选有意义的独立危险因素。结果 单因素分析显示,功能结局良好与不良组年龄、NIHSS评分、冠心病、TOAST分型、三酰甘油、极低密度脂蛋白、ARWMC评分以及额叶、顶枕叶白质评分差异有统计学意义(均P<0.05)。多元Logistic回归分析发现,在未考虑白质损害的情况下,年龄(OR=1.051,P<0.01)及NIHSS评分(OR=1.597,P<0.05)为3个月预后的独立危险因素;当白质损害进入回归方程,调整年龄和NIHSS评分后,ARWMC总分(OR=1.118,P=0.008)及额叶白质评分(OR=1.223,P=0.017)为3个月预后的独立危险因素。Spearman秩相关显示白质损害严重程度与3个月mRS评分相关(r=0.21,P<0.05)。结论 白质损害的严重程度及部位可以预测首次急性缺血性卒中患者3个月功能结局,且NIHSS评分、ARWMC、年龄预测预后的作用独立且依次减小。
缺血性卒中;功能结局;MRI;白质损害
虽然在快速早期治疗缺血性卒中方面取了重大进展,但在世界范围内卒中仍是中老年人致残的主要原因[1],其不仅增加了社会负担,也增加了家庭的经济和照顾负担。急性缺血性卒中发生后,尽早和可靠地功能预后评估对制订最佳治疗和康复方案具有重要价值[2-3]。许多人口学和临床因素被认为能够预测其功能结局,如年龄、性别、卒中严重程度及各种血管性危险因素,但研究结果尚不一致[4-5]。最近一项综合46个纵向研究的Meta分析[6]显示,脑白质损害能够增加卒中患者痴呆及死亡风险。然而,脑白质损害与卒中功能结局的关系依然存在争议,本研究的目的是探讨脑白质损害对首次急性缺血性卒中患者3个月功能结局的影响,从而为缺血性卒中的治疗和预防提供帮助。
1 对象与方法
1.1 对象 2013年8月~2016年1月在河北省人民医院神经内科连续登记发病7 d内的首次急性缺血性卒中患者402例,并对所有患者进行随访。402例中失访42例,缺少头颅MRI者35例,发病前mRS ≥2分者15例,最后共310例纳入本研究。其中男213例,女97例,男∶女=2.2∶1。年龄20~80岁,平均(63.02±12.02)岁。纳入标准:符合第四次全国脑血管病学术会议修订的急性缺血性卒中诊断标准[7],并由头颅CT或MRI检查证实。排除标准:既往有卒中病史;发病后7 d以上入院者;年龄<18岁者;缺少头颅MRI;发病前mRS≥2分;既往存在明确认知功能障碍或痴呆者。所有研究对象或授权家属均签署了知情同意书。本研究得到我院伦理委员会批准。
1.2 方法
1.2.1 一般资料收集 入院后24 h内对患者进行详细的病史询问,收集人口学和临床资料,由统一规范培训的神经科医师进行NIHSS评分和TOAST分型,并于入院第2 d晨起抽血进行血液生化学检查。高血压病:既往已确认且目前正在服用降压药物,或急性期(1周)后采用2005年WHO确定的标准,至少2次测量收缩压 ≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压 ≥90 mmHg。糖尿病:既往确诊且目前正在应用降糖药物,或采用2010年WHO修订的标准,急性期后至少2次检验空腹血糖≥7.0 mmol/L,或随机血糖≥11.1 mmol/L,或经糖耐量试验明确诊断者。高脂血症:采用2003年美国成人脂代谢控制目标Ⅲ提出的最新血脂标准:以总胆固醇≥5.2 mmol/L,低密度脂蛋白≥2.6 mmol/L,高密度脂蛋白≤1.0 mmol/L,三酰甘油≥2.3 mmol/L为血脂异常指标,具有以上任何一项者为高脂血症。冠心病:为病史中记录有明确的冠心病,ECG有相应异常表现。吸烟:到确诊时为止患者一直吸烟(超过5年,≥5支/d)或已戒烟但未超过5年。
1.2.2 白质损害严重程度的评价 采用与年龄相关的白质改变评分(ARWMC)对脑白质损害严重程度进行评估。对额叶、颞叶、顶枕叶分别进行评分,0分表示无病损(包括对称性、平滑的帽和带);1分表示局灶性病损;2分代表病灶开始融合;3分代表弥漫累及整个区域伴或不伴“u”纤维受累。采用美国GE公司生产的3.0 T MRI机对入选患者行头颅MRI扫描,常规轴位T1WI(TR/TE=500/11 ms)、T2WI(TR/TE=3400/125 ms),快速Flair(TR/TE/TI=9002/56/2200 ms)。层厚5 mm,间距1 mm。白质损害的评分由两个经过培训的神经科医师共同测评,相差比较大时,申请上级医师进行评分,最后按照两个相近的给分。最后,白质损害严重程度分为3组:正常组(ARWMC得分0~1分)、轻度组(ARWMC得分2~8分)、重度组(ARWMC得分9~18分)。采用mRS对出院3个月后的患者进行电话随访,并根据预后的情况分为两组:预后良好组(mRS 0~1分)和预后不良组(mRS 2~5分及死亡)。
2 结 果
2.1 预后良好组和预后不良组临床资料比较 见表1。预后良好组177例(57.1%),其中女55例,男122例,平均年龄(61.00±11.81)岁;预后不良组133例(42.9%),其中女42例,男91例,平均年龄(65.71±11.81)岁。单因素分析显示两组年龄、NIHSS评分、冠心病、三酰甘油、极低密度脂蛋白、TOAST分型、ARWMC和额叶、顶枕叶评分具有统计学差异(均P<0.05)。
2.2 影响急性缺血性卒中3个月功能结局的多因素分析 见表2。采用二分类Logistic回归,分析影响患者3个月功能结局的独立危险因素。以预后良好与预后不良作为因变量,保守纳入在单因素分析中P<0.15的参数,包括年龄、冠心病、TOAST分型、NIHSS评分、三酰甘油、总胆固醇、低密度脂蛋白及极低密度脂蛋白,纳入回归方程发现年龄、NIHSS评分与结局显著相关(P<0.01)。在控制变量中加入ARWMC总分后发现ARWMC与预后相关(P<0.01)。在控制变量中加入不同白质损害部位(额叶、顶枕叶及颞叶评分)后发现额叶评分与预后相关(P<0.05)。以上结果提示在调整了年龄和病情严重程度后,白质损害严重程度和部位是首次急性缺血性卒中3个月功能结局的独立影响因素。
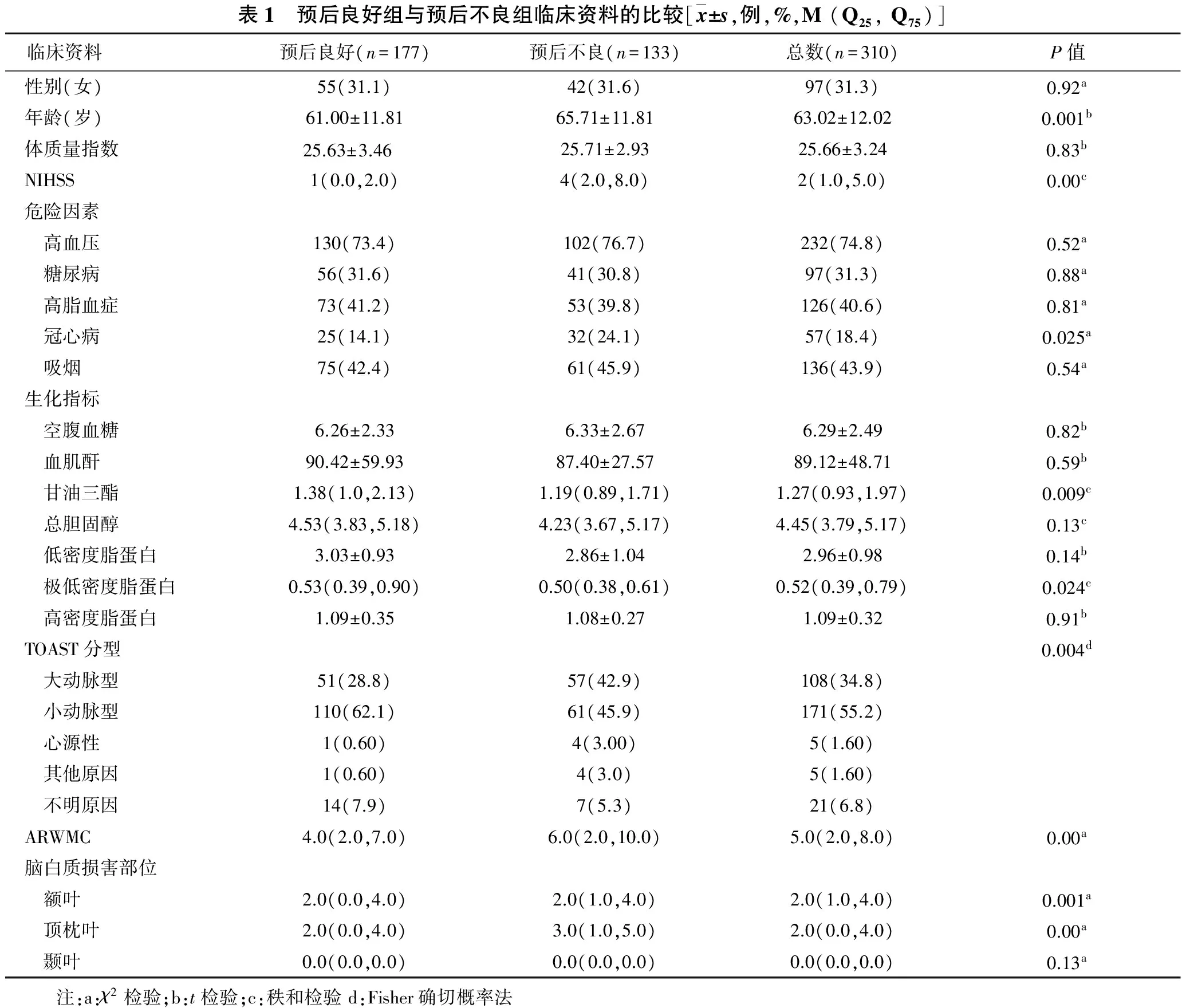
表1 预后良好组与预后不良组临床资料的比较[x±s,例,%,M(Q25,Q75)]临床资料预后良好(n=177)预后不良(n=133)总数(n=310)P值性别(女)55(31.1)42(31.6)97(31.3)0.92a年龄(岁)61.00±11.8165.71±11.8163.02±12.020.001b体质量指数25.63±3.46 25.71±2.9325.66±3.240.83bNIHSS1(0.0,2.0)4(2.0,8.0)2(1.0,5.0)0.00c危险因素 高血压130(73.4)102(76.7)232(74.8)0.52a 糖尿病56(31.6)41(30.8)97(31.3)0.88a 高脂血症73(41.2)53(39.8)126(40.6)0.81a 冠心病25(14.1)32(24.1)57(18.4)0.025a 吸烟75(42.4)61(45.9)136(43.9)0.54a生化指标 空腹血糖6.26±2.336.33±2.676.29±2.490.82b 血肌酐90.42±59.9387.40±27.5789.12±48.710.59b 甘油三酯1.38(1.0,2.13)1.19(0.89,1.71)1.27(0.93,1.97)0.009c 总胆固醇4.53(3.83,5.18)4.23(3.67,5.17)4.45(3.79,5.17)0.13c 低密度脂蛋白3.03±0.932.86±1.042.96±0.980.14b 极低密度脂蛋白0.53(0.39,0.90)0.50(0.38,0.61)0.52(0.39,0.79)0.024c 高密度脂蛋白1.09±0.351.08±0.271.09±0.320.91bTOAST分型0.004d 大动脉型51(28.8)57(42.9)108(34.8) 小动脉型110(62.1)61(45.9)171(55.2) 心源性1(0.60)4(3.00)5(1.60) 其他原因1(0.60)4(3.0)5(1.60) 不明原因14(7.9)7(5.3)21(6.8)ARWMC4.0(2.0,7.0)6.0(2.0,10.0)5.0(2.0,8.0)0.00a脑白质损害部位 额叶2.0(0.0,4.0)2.0(1.0,4.0)2.0(1.0,4.0)0.001a 顶枕叶2.0(0.0,4.0)3.0(1.0,5.0)2.0(0.0,4.0)0.00a 颞叶0.0(0.0,0.0)0.0(0.0,0.0)0.0(0.0,0.0)0.13a 注:a:χ2检验;b:t检验;c:秩和检验d:Fisher确切概率法
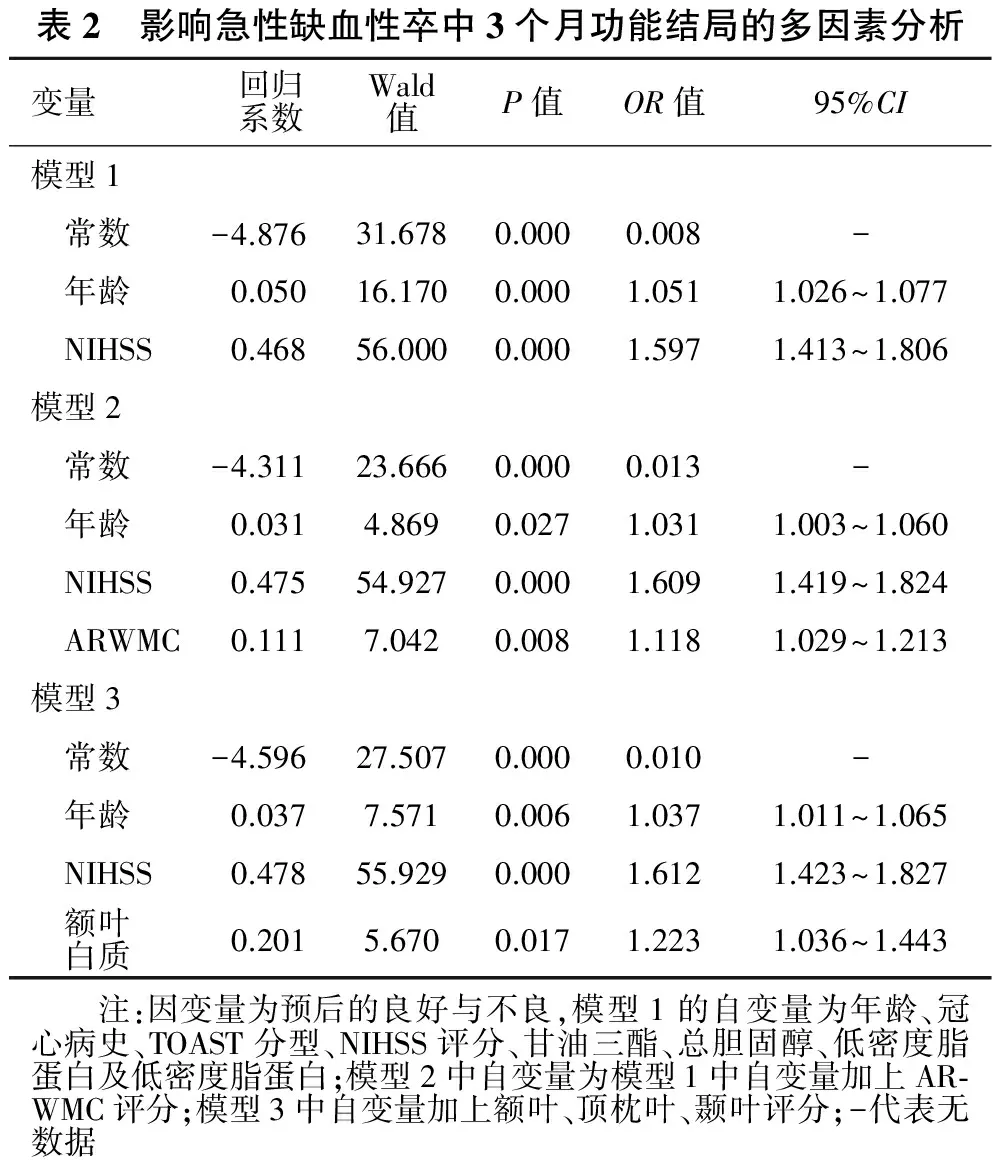
表2 影响急性缺血性卒中3个月功能结局的多因素分析变量回归系数Wald值P值OR值95%CI模型1 常数-4.876 31.6780.0000.008- 年龄0.05016.1700.0001.0511.026~1.077 NIHSS0.46856.0000.0001.5971.413~1.806模型2 常数-4.31123.6660.0000.013- 年龄0.0314.8690.0271.0311.003~1.060 NIHSS0.47554.9270.0001.6091.419~1.824 ARWMC0.1117.0420.0081.1181.029~1.213模型3 常数-4.59627.5070.0000.010- 年龄0.0377.5710.0061.0371.011~1.065 NIHSS0.47855.9290.0001.6121.423~1.827 额叶 白质0.2015.6700.0171.2231.036~1.443 注:因变量为预后的良好与不良,模型1的自变量为年龄、冠心病史、TOAST分型、NIHSS评分、甘油三酯、总胆固醇、低密度脂蛋白及低密度脂蛋白;模型2中自变量为模型1中自变量加上AR⁃WMC评分;模型3中自变量加上额叶、顶枕叶、颞叶评分;-代表无数据
2.3 白质损害严重程度与3个月mRS评分的相关性分析 根据ARWMC评分把白质损害严重程度分为正常、轻度与重度组,运用Spearman秩相关分析显示,白质损害严重程度与3个月mRS评分相关(r=0.21,P<0.05)。不同白质损害各组mRS评分的百分比见图1。
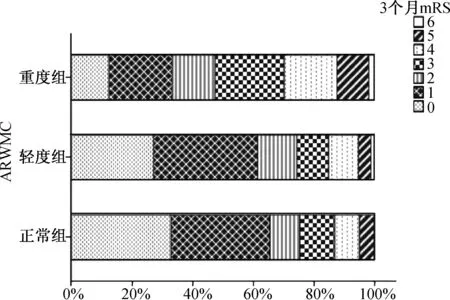
图1 白质损害各组mRS评分所占百分比(不同格纹分别代表mRS 0~6分)
3 讨 论
白质损害为脑小血管病的重要组成部分,其在MRI的T2或T2Flair加权相上呈现异常的高信号[8]。很多研究[9]通过CT视觉量表或者容积测量来评估白质损害的严重程度,进而探索与预后的关系。虽然容积测量白质损害严重程度更准确,但由于其花费时间较长、需要专业软件等因素在临床上并不实用。许多MRI视觉量表已经应用于评估白质损害的严重程度[10], ARWMC能够快速地评价白质损害的严重程度。研究[11]表明,使用视觉评分量表评估白质损害的严重程度能够作为预测卒中预后的一种方法。因此,本研究采用ARWMC评分法进行白质损害评估。
有研究[12-13]提示,白质损害的严重程度可能影响缺血性卒中的功能预后。白质损害和临床预后间的关系存在复杂的机制,白质损害区域血管的密度和脑血流量减少,可能增加缺血性卒中急性期病情的进展,进而说明白质损害严重的患者因为神经元网络功能障碍导致比较差的预后[14-15]。两侧大脑半球内和两侧大脑半球之间连通性的完整性对卒中后的功能恢复很重要[16]。白质损害患者可能由于髓鞘缺失、轴突缺失和神经胶质过多导致神经元的连通性降低[17]。这些可能通过减少皮质较远区域的功能连通性导致神经可塑性的降低。众所周知,白质损害是卒中后认知障碍和抑郁的重要危险因素,这可能对患者治疗和康复方案的依从性产生不利影响[18],从而导致较差的功能结局。本研究回归分析中发现校正一般资料后年龄(P<0.01)和NIHSS评分(P<0.01)与3个月功能结局相关;在控制变量中添加总的ARWMC评分后,调整NIHSS评分和年龄,总的ARWMC评分(P<0.01)仍为3个月功能预后的独立危险因素,并且NIHSS评分、ARWMC、年龄预测3个月功能预后的作用可能依次减少(OR值依次为1.609、1.118、1.031)。Liou等[19]在白质损害和急性缺血性卒中患者1个月功能预后关系的研究中发现,校正年龄、高血压病、初始NIHSS评分后,白质损害为其独立危险因素。Kang等[20]采用视觉评分量表评估白质损害和卒中后2周及1年的功能预后关系的研究发现,室周白质损害是其独立危险因素。而本研究证明了白质损害为3个月功能预后独立危险因素,与以上研究结果相似。
不同部位的白质损害对卒中后功能结局的影响尚未明了。本研究单因素分析显示,预后良好与预后不良两组中额叶、顶枕叶白质评分差异有统计学意义。多因素分析显示,在控制变量中添加不同脑叶白质评分后,额叶白质损害是卒中后3个月功能结局的独立危险因素。得出此结果的可能原因包括:(1)白质损害是脑内小动脉粥样硬化或者灌注不良导致的皮质下白质和灰质的缺血性改变,其损害前额叶-皮质下环路的结构和功能,进而破环神经元之间以及皮质-皮质下信号传递。有研究[21-22]认为,脑内其他区域的白质损害通过各种神经环路引起额叶葡萄糖代谢降低,导致患者出现以执行功能为主,包括记忆力、注意力等多方面的额叶认知功能障碍;我国也有研究[23]发现,额叶白质病变对皮质下缺血性脑血管病患者认知领域有损害,最后发现整体的认知功能下降,但以执行功能下降为主,其对患者的功能恢复和康复依从性产生不利影响。(2)通常情况下,白质损害最早累及额叶,以后逐渐发展到其他脑叶及基底节区等,并且以额叶损害最严重[24]。随着年龄增长,白质损害的发生率和严重程度逐渐增高。有研究[25]称60~70岁人群中87%存在白质损害;而80~90岁人群中白质损害的检出率高达95%~100%。本研究入组的患者年龄偏小,为(63.02±12.02)岁,白质损害以额叶最多见,由此可能说明在较年轻群体中额叶白质损害能够预测卒中患者的预后。有研究者[19-20,26]将白质损害分为皮质下深部脑白质损害和脑室旁白质损害两个区域进行研究,这是根据二者不同的病理生理意义进行分组,但是由于二者在解剖学上紧密联系,在MRI上不易区分[27],故白质损害采用此种分组仍有争议。不同脑叶白质损害和功能预后的研究较少报道,但不同脑叶白质损害和认知功能障碍的研究较多见,而本研究应用ARWMC评分将白质损害按不同脑叶进行分组研究,便于分析不同脑叶的皮质下环路,了解不同脑叶对认知的影响,操作更为简单、省时,可能更适于临床实践。
总之,本研究发现白质损害严重程度及部位与急性缺血性卒中患者3个月功能结局相关,提示伴有白质损害的缺血性卒中患者可能有更差的预后。
[1]Murray CJ, Vos T, Lozano R, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010 [J]. Lancet, 2012, 380: 2197.
[2]Veerbeek JM, Kwakkel G, van Weqen EE, et al. Early prediction of outcome of activities of daily living after stroke: a systematic review [J]. Stroke, 2011, 42: 1482.
[3]Romano A, Biraschi F, Tavanti F, et al. Role of multidetector CT in the recognition of hyperdense middle cerebral artery sign (HMCAS) in patients with acute cerebral ischaemia: correlation with DWI-MRI sequences and clinical data [J]. Radiol Med, 2015, 120: 222.
[4]Meijer R, Ihnenfeldt DS, de Groot IJ, et al. Prognostic factors for ambulation and activities of daily living in the subacute phase after stroke. A systematic review of the literature [J]. Clin Rehabil, 2003, 17: 119.
[5]Johnston KC, Connors AF, Waqner DP, et al. A predictive risk model for outcomes of ischemic stroke [J]. Stroke, 2000, 31: 448.
[6]Debette S, Markus HS. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and meta-analysis [J]. BMJ, 2010, 341:c3666.
[7]中华神经科学会. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29: 369.
[8]Imaizumi T, Inamura S, Nomura T. The severities of white matter lesions possibly influence the recurrences of several stroke types [J]. J Stroke Cerebrovasc Dis, 2014, 23: 1897.
[9]Arasva EM, Rahman R, Rosand J, et al. Severity of leukoaraiosis correlates with clinical outcome after ischemic stroke [J]. Neurology, 2009, 72:1403.
[10]King KS, Peshock RM, Warren MW, et al. Evaluation of a practical visual MRI rating scale of brain white matter hyperintensities for clinicians based on largest lesion size regardless of location [J]. AJNR Am J Neuroradiol, 2013, 34: 797.
[11]Leonards CO, Ipsen N, Malzahn U, et al. white matter lesion severity in mild acute ischemic stroke patients and functional outcome afte 1 year [J]. Stroke, 2012, 43: 3046.
[12]Onteddu SR, Goddeau RP, Minaeian A, et al. Clinical impact of leukoaraiosis burden and chronological age on neurological deficit recovery and 90-day outcome after minor ischemic stroke [J]. J Neurol Sci, 2015, 359: 418.
[13]Koton S, Schwammenthal Y, Merzeliak O. Cerebral leukoaraiosis in patients with stroke or TIA: clinical correlates and 1-year outcome [J]. Eur J Neurol, 2009, 16: 218.
[14]Bernbaum M, Menon BK, Fick G, et al. Reduced blood flow in normal white matter predicts development of leukoaraiosis [J]. J Cereb Blood Flow Metab, 2015, 35: 1610.
[15]Pires PW, Dams Ramos CM, Matin N, et al. The effects of hypertension on the cerebral circulation [J]. Am J Physiol Heart Circ Physiol, 2013, 304: 1598.
[16]Yin D, Song F, Xu D, et al. Patterns in cortical connectivity for determining outcomes in hand function after subcortical stroke [J]. PLoS One, 2012, 7: e52727.
[17]Salat DH. Imaging small vessel-associated white matter changes in aging [J]. Neuroscience, 2014, 276: 174.
[18]Masskulpan P, Riewthong K, Dajpratham P, et al. Anxiety and depressive symptoms after stroke in 9 rehabilitation centers [J]. J Med Assoc Thai, 2008, 91: 1595.
[19]Liou LM, Chen CF, Guo YC, et al. Cerebral white matter hyperintensities predict functional stroke outcome [J]. Cerebrovasc Dis, 2010, 29: 22.
[20]Kang HJ, Stewart R, Park MS, et al. White matter hyperintensities and functional outcomes at 2 weeks and 1 year after stroke [J]. Cerebrovasc Dis, 2013, 35: 138.
[21]Lamar M, Price CC, Libon DJ, et al. Alterations in working memory as a function of leukoaraiosis in dementia [J]. Neuropsychologia, 2007, 45: 245.
[22]Tullberq M, Fletcher E, de Carli C, et al. White matter lesions impair frontal lobe function regardless of their location [J]. Neurology, 2004, 63: 246.
[23]董荃, 徐群,李焰生. 皮质下缺血性脑血管病患者额叶白质病变对认知领域的损害研究[J]. 临床神经病学杂志, 2015, 28: 177.
[24]Tullberq M, Fletcher E, DeCarli C, et al. White matter lesions impair frontal lobe function regardless of their location [J]. Neurology, 2004, 63: 246.
[25]de Leeuw FE, de Groot JC, Achten E, et al. Prevalence of cerebral white matter lesions in elderly people: a population based magnetic resonance imaging study. The Rotterdam Scan Study [J]. J Neurol Neurosurg Psychiatry, 2001, 70: 9.
[26]Kissela B, Lindsell CJ, Kleindorfer D, et al. Clinical prediction of functional outcome after ischemic stroke: the surprising importance of periventricular white matter disease and race [J]. Stroke, 2009, 40: 530.
[27]Barkhof F, Scheltens P. Is the whole brain periventricular ?[J]. J Neurol Neurosurg Psychiatry, 2006, 77: 143.
Effect of white matter lesion severity on short-term functional outcome in the patients with acute ischemic stroke
HANNing,JIAYang-juan,WANGMei-rong,etal.
DepartmentofNeurology,HebeiGeneralHospital,Shijiazhuang050051,China
Objective To explore the effect of white matter lesion severity on short-term functional outcome in the patients with acute ischemic stroke. Methods A total of 402 patients with first acute ischemic stroke admitted from August 2013 to January 2016 were enrolled in the study and all patients underwent brain MRI, severity of white matter lesions was assessed by age related white matter changes (ARWMC) scale. Functional outcome was assessed by mRS at 3 months after onset. Multiple logistic regression models were used to identify the independent risk factors. Results Univariable analysis revealed that age, NIHSS, coronary heart disease, TOAST, triglyceride, very low density lipoprotein, ARWMC and frontal lobe scores, parietal-occipital lobe scores had significant difference between favorable prognosis group and unfavorable prognosis group (allP<0.05). The result of logistic regression analysis indicated that age (OR=1.051,P<0.01), NIHSS (OR=1.597,P<0.05) were independent risk factors of 3-month prognosis when the severity of white matter lesions was not considered. After adjustment for age and NIHSS score, ARWMC(OR=1.118,P=0.008)and frontal lobe scores(OR=1.223,P=0.017)were independent risk factors of 3-month prognosis when white matter lesions went into the regression equation. Spearman rank correlation showed that the severity of white matter lesions was slightly associated with 3-month mRS score (r=0.21,P<0.05). Conclusions The severity and locations of white matter lesions in the first acute ischemic stroke patients may predict the 3-month function outcome. The effect of NIHSS, ARWMC and age on prediction of prognosis are independent and decreases in turn.
ischemic stroke;functional outcome;MRI;white matter lesions
河北省重大医学科研课题(zd2013001);河北省科技支撑计划项目(12276104D-18)
050051 石家庄,河北省人民医院神经内科
王建华
R743.3
A
1004-1648(2017)03-0161-05
2016-08-05
2016-09-06)

