中枢神经系统脱髓鞘假瘤与胶质瘤的鉴别诊断和临床分析
尹慧敏,丁秋勤,景黎君,贾延劼
·学术交流·
中枢神经系统脱髓鞘假瘤与胶质瘤的鉴别诊断和临床分析
尹慧敏,丁秋勤,景黎君,贾延劼
目的 探讨CNS脱髓鞘假瘤(DPT)的临床特点,并与胶质瘤进行鉴别,以提高对DPT的认识。方法 收集均经病理证实的13例DPT和17例胶质瘤患者的临床资料,对比二者之间的临床、影像学、实验室检查及病理特点,并分析DPT的治疗与转归。结果 DPT组平均发病年龄高于胶质瘤组(P<0.05)。DPT组女性多见,胶质瘤组无明显性别差异。DPT组急性或亚急性起病(76.9%)常见,胶质瘤组慢性起病常见(70.5%)。DPT组首发症状以头痛(38.4%)多见,胶质瘤组以头痛(41.1%)、痫性发作(23.5%)多见。DPT组影像学部分病灶可见“垂直征”及特异性“开环征”,DWI高b值呈高信号,胶质瘤DWI高b值多呈低信号。MRS检查出现特异性β,γ-谷氨酸复合物(Glx)峰升高可与胶质瘤进行鉴别。两组CSF压力、蛋白相比差异有统计学意义(均P<0.05)。病理活组织检查出现特异性核分裂状的Creutzfeldt细胞及CD68免疫组化染色阳性有助于两者鉴别诊断。经激素治疗后DPT大部分病灶明显缩小或消失,部分可发展为多发性硬化。结论 DPT在临床表现及影像学等方面与胶质瘤相似。影像学检查出现“垂直征”、“开环征”及β,γ-Glx峰升高可能具有特异性,DWI/MRS检查有助于鉴别胶质瘤。激素实验性治疗可能有助于鉴别病变性质,但最终确诊仍需病理结果,部分可发展为多发性硬化。
脱髓鞘假瘤;胶质瘤;临床分析;鉴别诊断
CNS脱髓鞘假瘤(DPT)又称为炎性假瘤、假瘤性炎性脱髓鞘病等,是一种CNS比较少见的脱髓鞘性疾病。其临床表现为头痛、肢体无力、认知功能障碍等脑实质占位及神经功能缺损的局灶性定位体征[1]。影像学上有类似肿瘤占位病变的表现。本研究回顾分析了我院均经病理证实的13例DPT和17例胶质瘤,总结其二者之间的临床、影像学、实验室检查、病理学特点以及DPT的治疗与转归。
1 对象与方法
1.1 对象 收集我院2010年1月~2016年7月的13例DPT和17例胶质瘤,建立影像学、实验室检查及病理学资料库,定期随访DPT患者。入组标准:DPT具有占位效应;胶质瘤符合WHO分级标准;以上所有病例均经病理证实,临床,影像学,实验室,病理资料相对完整(头颅MRI平扫+增强、DWI和病理为必备)。
1.2 方法
1.2.1 起病方式及临床分期 DPT组和胶质瘤组均采用一致的分期:急性起病(≤2周),亚急性起病(2周~2个月),慢性起病(>2个月)。
1.2.2 影像学检查 两组患者均行头颅MRI平扫及增强、DWI检查。两组部分患者行磁共振波谱分析(MRS)检查,其中DPT组6例,胶质瘤组7例。
1.2.3 实验室检查 DPT组和胶质瘤组患者均行血常规、电解质、肝肾功能、血清肿瘤/副肿瘤标志物、血沉、C反应蛋白、抗核抗体(ANA)、抗中性粒细胞胞浆抗体(ANCA)相关检查,其中10例DPT及14例胶质瘤患者行CSF常规生化细胞学、寄生虫、病毒、抗酸、墨汁染色、腺苷脱氨酶(ADA)、结核特异性细胞免疫三项、肿瘤标志物、寡克隆区带及IgG合成率、自身免疫性脑炎抗体检查。
1.2.4 病理学检查 两组患者均行病灶活检,组织送检常规石蜡切片,行HE染色、CD68免疫组化染色及胶质纤维酸性蛋白(GAFP)染色。
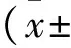
2 结 果
2.1 一般资料比较 DPT组发病年龄在17~71岁,平均(49.00±16.38)岁;胶质瘤组发病年龄在12~59岁,平均(36.52±13.03)岁;DPT组平均发病年龄高于胶质瘤组(P=0.048)。DPT组女性8例(61.5%),男性5例(38.5%),男∶女=1∶1.5;胶质瘤组女性9例(52.9%),男性8例(47.1%)。
2.2 临床表现
2.2.1 起病形式 DPT组急性或亚急性起病10例(76.9%),慢性起病3例(23.1%);胶质瘤组急性或亚急性起病5例(29.5%),慢性起病12例(70.5%)。两组相比较,DPT以急性或亚急性起病多见,而胶质瘤以慢性起病常见。
2.2.2 首发症状 DPT组头痛5例(38.4%)、肢体麻木无力5例(38.4%)、言语不利2例(15.4%),头晕、呕吐1例(7.8%)。胶质瘤组头痛7例(41.1%)、肢体麻木无力4例(23.5%)、痫性发作4例(23.5%)、头晕1例(5.8%),视力下降1例(5.8%)。两组均头痛最常见,DPT组无痫性发作。
2.3 实验室检查 两组常规实验室检查均未见明显异常。DPT组10例患者行CSF检查,CSF压力110~170 mmH2O(1 mmH2O=0.0098kPa)、WBC 0~6×106/L、蛋白14.5~42.5 mg/dl均正常,葡萄糖及氯化物、抗酸、墨汁染色、ADA、结核特异性细胞免疫三项、病毒、寄生虫均未见异常;IgG生成指数正常2例(20%),升高8例(80%),24 h IgG合成率正常8例(80%),升高2例(20%);寡克隆区带及自身免疫性脑炎抗体均阴性。胶质瘤组14例患者行CSF检查,CSF压力11例明显升高200~350 mmH2O,3例正常80~160 mmH2O;WBC 1~8×106/L均正常;蛋白正常或轻度升高29.1~80.9 mg/dL;葡萄糖及氯化物、抗酸、墨汁染色、ADA、结核特异性细胞免疫三项、病毒、寄生虫均未见异常;IgG生成指数正常8例(57.1%),轻度升高6例(42.9%),24 h IgG合成率正常12例(85.7%),轻度升高2例(14.3%);寡克隆区带及自身免疫性脑炎抗体均阴性。两组CSF压力(P=0.00)、蛋白(P=0.04)差异有统计学意义,细胞数(P=0.337)、IgG生成指数(P=0.458)、24 h IgG合成率(P=0.563)差异无统计学意义。
2.4 影像学检查
2.4.1 MRI检查 (1)DPT组患者MRI平扫中单发病灶9例(69.2%),主要累及大脑半球,也可累及小脑、脑干(图1)及脊髓;多发病灶4例(30.8%),同时累及小脑、桥脑或双侧颞、顶叶(图2),占位效应明显。13例病灶均呈长T1、长T2信号,部分病灶有“垂直征”(图2)。DWI高b值11例可见明显高信号(84.6%)(图3),2例可见略高信号(15.4%)。13例增强扫描均可见不同程度强化,开环状强化2例(15.4%)(图4),片状强化11例(84.6%)。(2)胶质瘤组MRI平扫中均为单发病灶,可累及CNS的任何部位。低级别胶质瘤8例均未见明显占位效应(47.1%),高级别胶质瘤9例可见不同程度的占位效应(52.9%)。7例病灶呈长T1、长T2信号(41.2%)(图5),10例呈不均匀混杂长T1、长T2信号(58.8%)。17例DWI高b值均呈低信号。低级别胶质瘤增强无明显强化3例(37.5%)、不均匀结节样或环状强化3例(37.5%)、均匀结节状强化2例(25%),高级别胶质瘤均呈不均匀花环状或结节样强化(图6)。
2.4.2 MRS检查 DPT组6例行MRS检查,4例出现不同程度的N-乙酰天门冬氨酸(NAA)峰下降、胆碱(Cho)峰升高(66.7%),2例出现NAA峰升高、Cho峰下降(33.3%),3例出现乳酸(Lac)峰(50%);另外出现特异性β,γ-谷氨酸复合物(Glx)峰3例(50%)。胶质瘤组7例行MRS检查,6例出现NAA峰明显下降、Cho峰明显升高(85.7%),1例出现NAA峰轻度升高、Cho峰轻度下降(14.3%),4例出现乳酸峰(57.1%),均未出现β,γ-Glx峰。两组相比较病灶侧NAA峰(P=0.215)、Cho峰(P=0.423)、NAA/Cr比值(P=0.479)、Cho/Cr比值(P=0.628)的差异无统计学意义。但出现特异性的β,γ-Glx峰可能有助于鉴别诊断。
2.5 病理特点 DPT组病理活检均提示脱髓鞘病变,病理可见巨噬细胞及反应性胶质细胞增生,血管周围淋巴细胞浸润(图7),部分可见到特异性核分裂状的Creutzfeldt细胞(肥胖型星形胶质细胞),GFAP染色部分呈阳性,CD68染色均阳性。而胶质瘤病理活检可见星形胶质细胞肿瘤、少突胶质细胞肿瘤、室管膜细胞肿瘤等(图8),GFAP染色均阳性,CD68染色均阴性。
2.6 DPT治疗与转归 13例DPT患者均行糖皮质激素治疗,临床症状明显改善,复查影像学病灶范围较前明显缩小。随访中3例出现复发,复发间隔为4个月~1年,平均复发间隔为7.3个月,复发病灶位置较前改变;复发后再次给予糖皮质激素治疗,症状仍可得到明显改善,最终临床确诊为多发性硬化。
图1 DPT延髓病灶T2WI上呈长T2信号 图2 DPT右侧颞顶叶、左侧顶叶病灶T2WI上均呈长T2信号,周围水肿明显,有“垂直征” 图3 DPT DWI弥散加权像高b值上呈高信号 图4 DPT增强扫描示“开环征”

图5 胶质瘤T2WI上病灶呈长T2信号,周围水肿明显 图6 胶质瘤增强呈不均匀“花环状”强化 图7 DPT镜下可见胶质细胞增生,伴较多巨噬细胞及少量淋巴细胞、浆细胞浸润,并可见血管周围炎细胞浸润(HE染色,×40) 图8 胶质瘤镜下可见间变型少突胶质细胞浸润,出现典型的致密鸡爪样分支毛细血管网(HE染色,×40)
3 讨 论
DPT于1979年由van der Velden等[2]首次报道,国内外陆续也不断有报道。发病机制目前尚不明确。Kepes等[3]认为与病毒感染或近期接种疫苗有关,但亦有研究者[4]认为除少数罕见情况外,DPT一般不发生于感染或注射疫苗后。其临床及影像学表现类似胶质瘤,但通过本研究可发现二者有诸多不同。
本研究发现,DPT多中年起病,以急性或亚急性起病为主,少数为慢性病程,与国内外报道相似[5-6]。本病多呈单时相病程,部分有复发-缓解样病程。而胶质瘤多慢性起病,在确诊前一般为单时相病程,本组患者发病年龄较DPT组稍年轻,因样本量较小,性别无明显差异。临床表现上DPT可表现为头痛、肢体麻木无力等颅内占位及神经功能缺损的定位体征,与胶质瘤类似,但DPT病灶一般不累及皮质,故很少出现痫性发作的临床表现。
本研究发现,DPT病灶多位于皮质下白质,可累及大脑半球、侧脑室旁等部位,也可发生于小脑、脑干,少数发生在脊髓[7]。多数为孤立性病灶,少数为多发[8]。MRI平扫多数病灶呈长T1、长T2信号,部分病灶有垂直侧脑室分布倾向[9]。增强扫描有不同程度的环状、片状等强化,出现特异性非闭合性环形强化(“开环征”)时[10],对DPT的诊断具有高度特异性。急性期DWI高b值可见明显高信号。国内也有报道[11],随着病灶中心坏死和周围出现新病灶,可呈现环状强化,DWI上信号亮度较前减低。本组胶质瘤病灶多为单发,可伴囊变、坏死等[12],增强扫描中,低级别胶质瘤一般无强化或轻度强化,高级别胶质瘤多表现为不均匀花环状或结节样强化。DWI高b值呈低信号或等信号[11],可以此与DPT鉴别。
本研究MRS检查显示,不论是DPT还是胶质瘤,均有不同程度的出现NAA峰降低、Cho峰升高,出现Lac峰。国外有报道[13]认为胶质瘤的Cho峰升高更为显著,多超过2倍的NAA峰。但本研究通过对DPT组与胶质瘤组相比较,发现两组病灶侧NAA峰、Cho峰、NAA/Cr比值、Cho/Cr比值的差异无统计学意义。本研究还发现DPT组出现特异性的β,γ-Glx峰,β,γ-Glx峰显著升高被认为是脱髓鞘疾病中炎性损伤及轴索损伤的重要标志[1];当MRS中出现特异性β,γ-Glx峰升高有助于与胶质瘤鉴别[14]。
本研究发现,两组常规实验室检查及CSF检查无特异性。国内有报道[1]认为DPT CSF检查压力多轻度升高,急性期白细胞可升高,CSF髓鞘碱性蛋白及寡克隆区带阳性率较高。本研究中10例DPT患者行CSF检查,发现其CSF压力、白细胞数目、葡萄糖及氯化物均未见明显异常;IgG生成指数正常或升高,24 h IgG合成率正常或升高,寡克隆区带及自身免疫性脑炎抗体检查均阴性;与上述国内报道有不同。本研究同时对两组的CSF压力、细胞数、蛋白、IgG生成指数及24 h IgG合成率进行对比分析,发现两者之间的压力、蛋白差异具有统计学意义,但细胞数、IgG生成指数及24 h IgG合成率无统计学差异。目前病理检查依然是DPT和胶质瘤鉴别的主要依据。本研究发现,DPT镜下可见病灶内巨噬细胞及反应性胶质细胞增生,血管周围淋巴细胞浸润,偶可见核分裂状的Creutzfeldt细胞;增生的胶质细胞中发现Creutzfeldt细胞具有重要意义,与脱髓鞘病变密切相关[15]。免疫组化CD68染色DPT组均阳性,胶质瘤组均阴性,因此可用于确诊颅内DPT[9]。
本组DPT患者经糖皮质激素治疗后,临床症状及病变范围均较前有明显改善,随访中部分患者复发出现新病灶,再次给予糖皮质激素治疗后症状仍可得到改善,提示DPT部分可转化为多发性硬化。有学者[16]认为,DPT是多发性硬化的一种特殊类型,或者是多发性硬化与急性播散性脑脊髓炎之间的过渡型。国内也曾报告1例以DPT为首发表现的多发性硬化患者[17]。Brex等[18]对71例临床孤立综合征患者随访发现,14年有68%发展成多发性硬化。本组患者随访4年后有23%患者发展成多发性硬化,因随访时间较短,发生率较上述报道较低,仍需进一步随访观察。
总之DPT虽然类似于颅内恶性肿瘤,但仔细辨别仍有许多不似之处,在临床工作中要进行综合比对分析,确诊仍需病理学检查。虽然病程多成单时相,糖皮质激素治疗有效,但不能以此作为与胶质瘤鉴别的依据。部分DPT可发展为多发性硬化,在临床工作中要注意长期随访。
[1]戴瑶, 杨琴. 肿瘤样脱髓鞘病变的诊治进展[J]. 中华神经科杂志, 2015, 48:136.
[2]van der Velden M, Bots GT, Endtz LJ. Cranial CT in multiple sclerosis showing a mass effect[J]. Surg Neurol , 1979, 12:307.
[3]Kepes JJ. Large focal tumor-like demyelinating lesions of the brain:Intermediate entity between multiple sclerosis and acute disseminated encephalomyelitis? A study of 31 patients[J]. Ann Neurol, 1993, 33:18.
[4]Given CA 2nd,Stevens BS,Lee C.The MRI appearance of tumefactive demyelinatin lesions[J].AJR Am J Roentgenol, 2004, 182:195.
[5]Kim DS,Na DG, Kim KH,et al.Distinguishing tumefactive demyelinating lesions from glioma or central nervous system lymphoma:added value of unenhanced CT compared with conventional contrast-enhanced MR imaging[J]. Radiology, 2009, 251:467.
[6]卢佩林, 姜绪涛, 辛涛,等. 脑脱髓鞘假瘤的临床和影像学特点(附1例报告)[J]. 临床神经病学杂志, 2014, 27:386.
[7]Wang Y, Wang M, Liang H, et al. Imaging and clinical properties of inflammatory demyelinating pseudotumor in the spinal cord[J]. Neural Regen Res, 2013, 8:2484.
[8]Ahintas A, Petek B, Isik N, et al. Clinical and radiologieal characteristics of tumefaetive demyelinating lesions: follow-up study[J].Mult Scler,2012,18:1448.
[9]Ning X, Zhao C, Wang C, et al. Intracranial demyelinating pseudotumor: a case report and review of the literature[J]. Turk Neurosurg, 2017, 27:146.
[10]Javalkar V, Manix M, Wilson J, et al. Open ring enhancement in atypical brain demyelination[J]. J Clin Neurosci, 2012, 19:910.
[11]王起, 戚晓昆, 刘建国,等. 脱髓鞘假瘤35例的临床表现和影像及病理特点[J]. 中华神经科杂志, 2007, 40:456.
[12]刘建国, 乔文颖, 郑奎宏,等. 瘤样脱髓鞘病与胶质瘤的临床、影像对比研究[J]. 中华医学杂志, 2014, 94:3047.
[13]Leclercq D, Trunet S, Bertrand A, et al. Cerebral tumor or pseudotumor?[J]. Diagn Interv Imaging, 2014, 95:906.
[14]罗海营, 黄飚, 刘红军,等. 短TE~1H-MRS β,γ-Glx峰鉴别脑内脱髓鞘假瘤和星形细胞瘤的价值[J]. 临床放射学杂志, 2011, 30:456.
[15]Adamek D, Radwanska E, Rog T, et al. Tumefactive demyelinating lesion. Trying to find unity in diversity. Comparison of two cases[J]. Clin Neurol Neurosurg,2014, 116:90.
[16]Jaffe SL, Minagar A. Demyelinating pseudotumor[J]. Arch Neurol, 2005, 62:1466.
[17]李守华, 邓菊凤, 张祥海,等. 以中枢神经系统脱髓鞘性假瘤为首发表现的多发性硬化一例并文献复习[J]. 中国现代神经疾病杂志, 2014, 14:60.
[18]Brex PA, Ciccarelli O, O’Riordan JI, et al. A longitudinal study of abnormalities on MRI and disability from multiple sclerosis[J]. N Engl J Med, 2002, 346:158.
Differential diagnosis and clinical analysis of central nervous system demyelinating pseudotumor and Glioma
YINHui-min,DINGQiu-qin,JINGLi-jun,etal.
DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
Objective To investigate the clinical features of CNS demyelinating pseudotumor (DPT), and to identify the glioma, in order to improve the understanding of DPT.Methods The clinical data of pathologically confirmed 13 cases of DPT and 17 cases of glioma patients were collected. Clinical, radiological and pathological features were compared, and treatment and outcome of DPT were analyzed. Results The mean age of onset in the DPT group was significantly higher than that in the glioma group (P<0.05). DPT group was predominatly females,while there was no significant gender difference in glioma group. DPT primarily had acute or subacute onset (76.9%), while glioma group had chronic onset in common(70.5%). Headache (38.4%) was the most common as the first symptom, but in glioma group headache (41.1%), seizures (23.5%) more were more common. DPT group imaging part of the lesion can show “vertical sign” and specific “open-loop sign”, DWI high b value was high signal, while in glioma group DWI high b value was mostly low signal. MRS examination showed specific β, γ-Glx peak elevation can be identified with glioma. There were significant difference in the CSF pressure and protein between the two groups (allP<0.05). Pathological biopsy of specific mitotic Creutzfeldt cells and CD68 immunohistochemical staining positive were helpful for the differential diagnosis of both. After hormone therapy, most of the DPT lesions were significantly reduced or disappeared, some could be developed as multiple sclerosis. Conclusions DPT is similar with glioma in clinical manifestations and imaging and other aspects. The presence of “vertical sign”, “open-loop sign” and β, γ-Glx peak elevation may be specific in imaging studies, DWI/MRS may help to identify glioma. Hormone experimental treatment may help to identify the nature of the lesion, but the final diagnosis still needs pathological results, some DPT can be developed into multiple sclerosis.
demyelinating pseudotumor;glioma;clinical analysis;differential diagnosis
450052,郑州大学第一附属医院神经内科(尹慧敏,景黎君,贾延劼);河南科技大学第一附属医院肿瘤内科(丁秋勤)
贾延劼
R739.4
A
1004-1648(2017)03-0213-04
2016-08-15
2017-01-26)

