肝移植术后发生急性排斥的患者外周血滤泡杀伤性T淋巴细胞的表达特点及临床意义
张 可, 杨 帆, 孙艳玲, 刘振文, 王福生, 施 明
(北京大学解放军三〇二医院教学医院 a.感染性疾病诊疗与研究中心; b.肝移植研究中心, 北京 100039)
肝移植术后发生急性排斥的患者外周血滤泡杀伤性T淋巴细胞的表达特点及临床意义
张 可a, 杨 帆a, 孙艳玲b, 刘振文b, 王福生a, 施 明a
(北京大学解放军三〇二医院教学医院 a.感染性疾病诊疗与研究中心; b.肝移植研究中心, 北京 100039)
目的 研究肝移植患者外周血中滤泡杀伤性T淋巴细胞(Tfc)的表达特征及其在急性排斥反应中的意义。方法 收集2015年12月-2017年2月解放军第三〇二医院肝移植研究中心接受肝移植患者36例,其中11例发生急性排斥反应(AR组),余下25例未发生排斥反应(NAR组),急性排斥反应均由病理诊断确诊。另选取体检中心健康者20例作为对照(HC组)。应用流式细胞仪检测外周血中Tfc的特点,并分析其与总B淋巴细胞、幼稚B淋巴细胞和类别转换记忆性B淋巴细胞和浆细胞以及肝功能指标之间的相关性。计量资料多组间比较采用Kruskal-WallisH检验,进一步两两比较采用Mann-WhitneyU检验,相关性分析采用Spearman秩相关。结果 3组之间患者外周血Tfc的频率差异有统计学意(H=32.18,P<0.001),AR组患者外周血中Tfc的频率明显高于NAR组(U=60,P=0.008)和HC组(U=2,P<0.001),NAR组Tfc的表达明显高于HC组(U=40,P<0.001)。Tfc频率与总B淋巴细胞、幼稚B淋巴细胞呈正相关(r值分别为0.665、0.462,P值均<0.001);与类别转换记忆性B淋巴细胞和浆细胞呈负相关(r=-0.453,P=0.001);与血清GGT水平呈正相关(r=0.371,P=0.026)。结论 肝移植术后发生急性排斥反应的患者外周血中Tfc频率升高,且与B淋巴细胞以及肝脏胆管损伤存在一定的相关性,Tfc可能参与了肝移植术后的急性排斥反应。
肝移植; 移植物排斥; T淋巴细胞
肝移植是治疗终末期肝病的重要方法。肝脏不同于其他器官,是“免疫特惠”器官,即使阳性T淋巴细胞交叉配型也不会发生超急性排斥反应[1]。但急性排斥反应仍是肝移植失败的重要原因之一[2]。已有的研究[3-6]表明,辅助性T淋巴细胞2、辅助性T淋巴细胞17、调节性T淋巴细胞、γδT淋巴细胞、自然杀伤细胞和树突状细胞等均参与了同种异体移植物的免疫反应。最近的研究[7-11]发现CD4+CXCR5+滤泡辅助性T淋巴细胞参与了小肠移植、肾移植、造血干细胞移植和肝移植后的免疫反应。CD8+CXCR5+T淋巴细胞被命名为滤泡杀伤性T淋巴细胞(follicular cytotoxic T cells,Tfc)[12],研究[13]表明其在某种程度上也可以支持淋巴器官中B淋巴细胞和IgG的产生。肝移植排斥患者肝脏组织中B淋巴细胞和浆细胞表达增加,且在肝移植排斥早期,B淋巴细胞及浆细胞的趋化因子表达亦增加[14]。但B淋巴细胞、浆细胞以及Tfc在肝移植排斥中的作用,特别是在急性排斥反应中的作用尚不清楚。本文对肝移植术后发生急性排斥反应患者外周血中Tfc和B淋巴细胞的频率进行研究,并结合临床指标,探讨Tfc在肝移植急性排斥免疫反应中可能发挥的作用。
1 资料与方法
1.1 研究对象 收集2015年12月-2017年2月本院肝移植研究中心收治的肝移植术后患者36例,其中移植术后未发生急性排斥反应者(NAR组)25例,术后1年内患者一般情况良好,未出现急性排斥反应和原发病的复发,也未出现慢性排斥反应及其他相关并发症。NAR组中男19例,女6例,年龄32~66岁,平均(50.7±8.5)岁。移植术后发生急性排斥反应者(AR组)11例,其中男8例,女3例,年龄38~69岁,平均(49.2±10.2)岁。急性排斥反应均由病理诊断确诊。所有患者在移植术后早期采用“糖皮质激素+钙调磷酸酶抑制剂(FK506)+吗替麦考酚酯”三联免疫抑制方案,术后3个月内停用激素,3个月后根据患者情况,单独使用FK506或联合使用吗替麦考酚酯。另选取20例本院体检中心的健康人作为对照(HC组),其中男16例,女4例,年龄36~60岁,平均(49.3±6.4)岁,肝功能及其他检查结果均正常,既往无肝病史。所有受试者均签署知情同意书。
1.2 研究方法
1.2.1 标本处理 所有研究对象均于清晨空腹采集静脉血7 ml,肝素钠抗凝。用淋巴细胞分离液(天津美德太平洋有限责任公司)以密度梯度离心法分离外周血单个核细胞,采用PBS洗涤2次并计数。
1.2.2 流式细胞仪检测外周血Tfc及B淋巴细胞 取新鲜分离的外周血单个核细胞100 μl (共1×106个细胞),加入流式抗体CD3-BV510、CD8-Percp、CXCR5-Alexa Fluor 488、CD19-PE、IgD-Percp、CD27-APC,室温避光孵育20 min,PBS洗涤后,加1%多聚甲醛固定,4 ℃保存,24 h内使用FACS Verse流式细胞仪检测。
2 结果
2.1 外周血Tfc及B淋巴细胞亚群的表达特点 CD8+T淋巴细胞中Tfc的频率在3组间比较差异有统计学意义(H=32.18,P<0.001),其中肝移植术后患者外周血中Tfc频率AR组高于NAR组(U=60,P=0.008)和HC组(U=2,P<0.001),NAR组高于HC组(U=40,P<0.001)(图1,2a)。总B淋巴细胞(CD19+)和幼稚B淋巴细胞(CD19+IgD+CD27-)3组间比较差异均有统计学意义(H值分别为14.21、23.46,P值分别为0.001、<0.001),进一步比较,总B淋巴细胞(CD19+)和幼稚B淋巴细胞(CD19+IgD+CD27-)频率NAR组和AR组均高于HC组(U值分别为103、40、60、19,P值分别为0.001、0.004、<0.001、<0.001)(图2b,c)。而类别转换记忆性B淋巴细胞和浆细胞(CD19+IgD-CD27+) 频率3组间比较差异亦有统计学意义(H=25.24,P<0.001),进一步比较结果显示HC组高于NAR和AR组(U值分别为54、17,P值均<0.001)(图2d)。
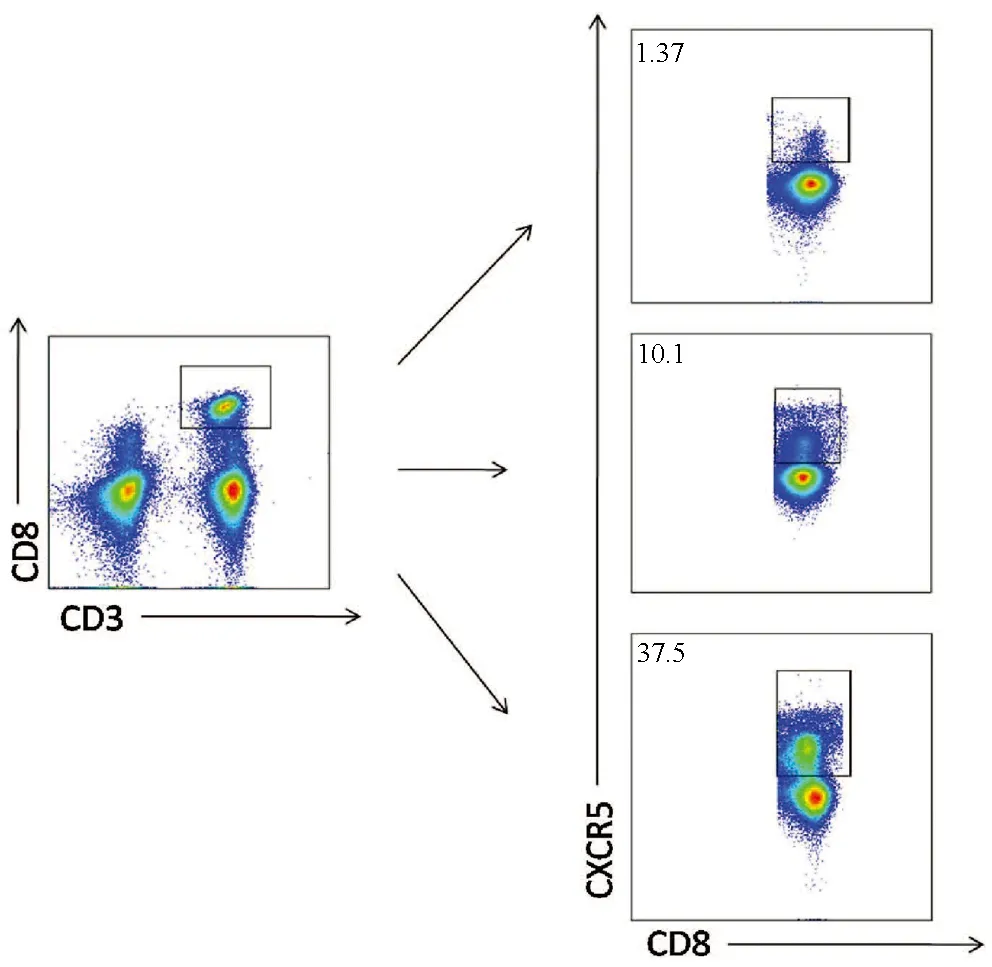
图1 3组外周血Tfc频率流式图
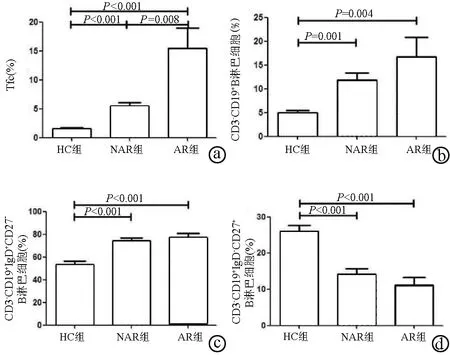
图2 3组外周血Tfc、总B淋巴细胞、幼稚B淋巴细胞以及类别转换记忆性B淋巴细胞和浆细胞频率比较
2.2 外周血Tfc与B淋巴细胞的相关性 外周血Tfc频率与总B淋巴细胞和幼稚B淋巴细胞频率均呈正相关(r值分别为0.665、0.462,P值均<0.001)(图3a,b);与类别转换记忆性B淋巴细胞和浆细胞呈负相关(r=-0.453,P=0.001)(图3c)。
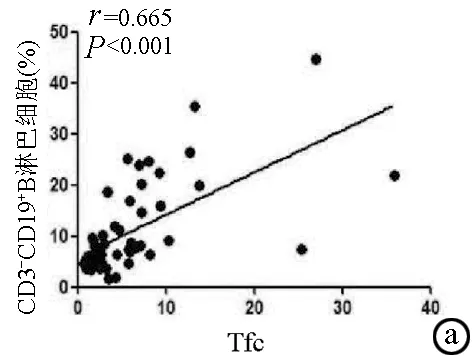
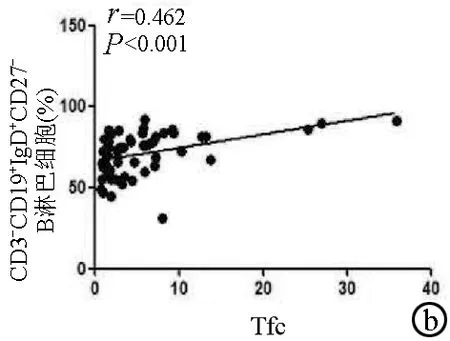
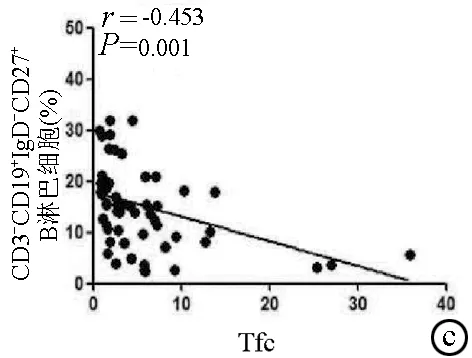
图3 外周血中Tfc与总B淋巴细胞、幼稚B淋巴细胞、类别转换记忆性B淋巴细胞和浆细胞的相关性分析
2.3 外周血Tfc与肝功能指标之间的相关性 外周血中Tfc频率与患者ALT和AST水平无明显相关性,但与GGT水平呈正相关(r=0.371,P=0.026)(图4)。
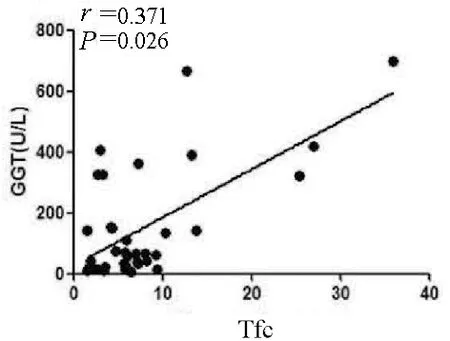
图4 Tfc频率与GGT水平的相关性
3 讨论
本实验初步研究了肝移植术后发生与未发生急性排斥患者以及健康对照者外周血Tfc和B淋巴细胞频率的特征。研究结果发现,AR组患者Tfc的频率明显高于NAR组和NC组,提示Tfc可能参与了肝移植术后的免疫排斥反应。
CXCR5通常在CD8+T淋巴细胞上不表达,但当CD8+T淋巴细胞需要迁移到滤泡B淋巴细胞区时,CXCR5的表达会上调。在HIV感染未治疗患者体内,细胞毒性T淋巴细胞通过高表达CXCR5进入B淋巴细胞滤泡,并能清除病毒感染的滤泡性辅助性T淋巴细胞和B淋巴细胞,从而控制感染[12]。在淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)慢性感染的小鼠模型的淋巴组织中,大约30%的CD8+T淋巴细胞表达CXCR5,且脾脏中Tfc的数量保持稳定。Tfc比CD8+CXCR5-T淋巴细胞亚群表达的抑制性受体如程序性细胞死亡蛋白1和T淋巴细胞免疫球蛋白黏蛋白3少,表达的共刺激分子如杀伤性细胞凝集素样受体G1多,且刺激后Tfc比CD8+CXCR5-T淋巴细胞亚群产生更多IFNγ和TNFα。因此,Tfc在LCMV慢性感染小鼠模型中,消耗较少且比CD8+CXCR5-T淋巴细胞具有更强的抗病毒功能[15]。Jiang等[16]发现沙眼衣原体感染的小鼠模型中,Tfc还能表达调节性T淋巴细胞的分子标志,如叉状头/翅膀状螺旋转录因子3、CD25和糖皮质激素诱导肿瘤坏死因子受体,而未表达杀伤性细胞的标志物,如穿孔素。
Tfc在移植免疫中的功能研究尚未见报道,CD8+T淋巴细胞在移植排斥反应中主要发挥辅助或杀伤性作用。在肾移植排斥患者的肾活组织检查中也发现了大量CD8+T淋巴细胞的浸润[17]。本研究发现Tfc在肝移植术后急性排斥患者的外周血中频率增加,CD8+T淋巴细胞上CXCR5的表达会使CD8+T淋巴细胞迁移到滤泡B淋巴细胞区。CD4+CXCR5+T淋巴细胞可以促进B淋巴细胞的分化和浆细胞的产生[18]。Tfc在某种程度上也能够支持扁桃体中B淋巴细胞和IgG的产生[13]。在原发性抗体缺乏症患者中,CD4+T淋巴细胞和CD8+T淋巴细胞上CXCR5的表达均增加,可能与T淋巴细胞辅助B淋巴细胞分化产生免疫球蛋白有关[19]。本研究结果显示,Tfc与总B淋巴细胞、幼稚B淋巴细胞均呈明显正相关,与类别转换记忆性B淋巴细胞和浆细胞呈明显负相关。急性排斥患者外周血中类别转换记忆性B淋巴细胞和浆细胞的频率下降,可能与其迁移至移植肝脏中有关。Krukemeyer等[14]通过对肝移植排斥反应的患者肝脏组织研究发现,发生排斥的患者比非排斥患者有更多的B淋巴细胞和浆细胞迁移到移植肝脏中。还有研究[20]发现,移植后肝穿刺组织中有超过30%浆细胞浸润的患者,发生了严重的排斥反应;有超过10%浆细胞浸润的,发生了中度或重度的排斥反应。Tfc与患者的GGT水平呈明显的正相关,提示可能与患者的胆管损伤有关。本实验初步研究了Tfc在肝移植排斥患者外周血中频率的变化,并推测了它与B淋巴细胞可能存在的关系,但Tfc在肝移植排斥反应中表达受体和分泌细胞因子的功能的变化,以及如何对B淋巴细胞发挥作用还有待进一步研究。
本研究首次初步探讨了Tfc在肝移植急性排斥反应中可能发挥的作用。但由于本研究样本量有限,Tfc功能复杂,且肝移植急性排斥有多种免疫细胞的参与,过程复杂,因此,Tfc在肝移植免疫中的作用机制还有待进一步探究。
[1] INAL A. Immunology of liver transplantation[J]. Exp Clin Transplant, 2014, 12(Suppl 1): 5-10.[2] CARBONE M, NEUBERGER JM. Autoimmune liver disease, autoimmunity and liver transplantation[J]. J Hepatol, 2014, 60(1): 210-223.
[3] WANG Y, ZHANG M, LIU ZW, et al. The ratio of circulating regulatory T cells (Tregs)/Th17 cells is associated with acute allograft rejection in liver transplantation[J]. PLoS One, 2014, 9(11): e112135.
[4] YU X, LIU Z, WANG Y, et al. Characteristics of Vδ1+and Vδ2+γδ T cell subsets in acute liver allograft rejection[J]. Transpl Immunol, 2013, 29(1-4): 118-122.
[5] BENICHOU G, YAMADA Y, YUN SH, et al. Immune recognition and rejection of allogeneic skin grafts[J]. Immunotherapy, 2011, 3(6): 757-770.
[6] VASSALLI G. Dendritic cell-based approaches for therapeutic immune regulation in solid-organ transplantation[J]. J Transplant, 2013, 2013: 761429.
[7] MEIER D, DOCENA GH, RAMISCH D, et al. Immunological status of isolated lymphoid follicles after intestinal transplantation[J]. Am J Transplant, 2014, 14(9): 2148-2158.
[8] de GRAAV GN, DIETERICH M, HESSELINK DA, et al. Follicular T helper cells and humoral reactivity in kidney transplant patients[J]. Clin Exp Immunol, 2015, 180(2): 329-340.[9] SHAO L, LIE AK, ZHANG Y, et al. Aberrant germinal center formation, follicular T-helper cells, and germinal center B-cells were involved in chronic graft-versus-host disease[J]. Ann Hematol, 2015, 94(9): 1493-1504.
[10] SHI YC, SUN YL, LIU ZW, et al. Characteristics of Tfh cells in the peripheral blood in recipients of liver allograft: a pilot study[J]. Med J Chin PLA, 2014, 39(12): 965-968. (in Chinese) 石彦超, 孙艳玲, 刘振文, 等. 肝移植患者外周血Tfh细胞特征的初步研究[J]. 解放军医学杂志, 2014, 39(12): 965-968.
[11] ZHANG K, SHI M, SUN YL, et al. Characteristic changes and their significance of peripheral follicular helper T cell subsets in liver transplant patients[J]. Med J Chin PLA, 2016, 41(10): 833-836. (in Chinese) 张可, 施明, 孙艳玲, 等. 肝移植后患者外周血Tfh细胞亚群的变化特征及意义[J]. 解放军医学杂志, 2016, 41(10): 833-836.
[12] LEONG YA, CHEN Y, ONG HS, et al. CXCR5+follicular cytotoxic T cells control viral infection in B cell follicles[J]. Nat Immunol, 2016, 17(10): 1187-1196.
[13] QUIGLEY MF, GONZALEZ VD, GRANATH A, et al. CXCR5+CCR7-CD8 T cells are early effector memory cells that infiltrate tonsil B cell follicles[J]. Eur J Immunol, 2007, 37(12): 3352-3362.[14] KRUKEMEYER MG, MOELLER J, MORAWIETZ L, et al. Description of B lymphocytes and plasma cells, complement, and chemokines/receptors in acute liver allograft rejection[J]. Transplantation, 2004, 78(1): 65-70.[15] HE R, HOU S, LIU C, et al. Follicular CXCR5-expressing CD8+T cells curtail chronic viral infection[J]. Nature, 2016, 537(7620): 412-428.
[16] JIANG J, CHAMPION CI, WEI B, et al. CD8+CXCR5+T cells regulate pathology in the genital tract[J]. Infect Dis Obstet Gynecol, 2013, 2013: 813238.[17] van DOESUM WB, ABDULAHAD WH, van DIJK MC, et al. Characterization of urinary CD4+and CD8+T cells in kidney transplantation patients with polyomavirus BK infection and allograft rejection[J]. Transpl Infect Dis, 2014, 16(5): 733-743.[18] FAZILLEAU N, MARK L, McHEYZER-WILLIAMS LJ, et al. Follicular helper T cells: lineage and location[J]. Immunity, 2009, 30(3): 324-335.
[19] PAYNE D, DRINKWATER S, BARETTO R, et al. Expression of chemokine receptors CXCR4, CXCR5 and CCR7 on B and T lymphocytes from patients with primary antibody deficiency[J]. Clin Exp Immunol, 2009,156(2): 254-262.
[20] ALEXANDER J, CHU W, SWANSON PE, et al. The significance of plasma cell infiltrate in acute cellular rejection of liver allografts[J]. Hum Pathol, 2012, 43(10): 1645-1650.
引证本文:ZHANK K, YANG F, SUN YL, et al. Characteristics and clinical significance of peripheral follicular cytotoxic T cells in patients experiencing acute rejection after liver transplantation[J]. J Clin Hepatol, 2017, 33(7): 1336-1339. (in Chinese) 张可, 杨帆, 孙艳玲, 等. 肝移植术后发生急性排斥的患者外周血滤泡杀伤性T淋巴细胞的表达特点及临床意义[J]. 临床肝胆病杂志, 2017, 33(7): 1336-1339.
(本文编辑:葛 俊)
Characteristics and clinical significance of peripheral follicular cytotoxic T cells in patients experiencing acute rejection after liver transplantation
ZHANKKe,YANGFan,SUNYanling,etal.
(TreatmentandResearchCenterforInfectiousDiseases, 302MilitaryHospitalofChina-PekingUniversityTeachingHospital,Beijing100039,China)
Objective To investigate the expression characteristics of peripheral follicular cytotoxic T (Tfc) cells in patients undergoing liver transplantation and their significance in acute rejection. Methods A total of 36 patients who underwent liver transplantation in Liver Transplantation Research Center in 302 Hospital of PLA from December 2015 to February 2017 were enrolled, and among these patients, 11 experienced acute rejection (AR group) and 25 did not experience acute rejection (NAR group). A confirmed diagnosis of acute rejection was made by pathological diagnosis. Another 20 healthy volunteers in Physical Examination Center were enrolled as controls (HC group). Flow cytometry was used to investigate the characteristics of Tfc in peripheral blood and its correlation with total B lymphocytes, juvenile B lymphocytes, memory B lymphocytes, plasma cells, and liver function parameters. The Kruskal-WallisHtest was used for comparison of continuous data between multiple groups, and the Mann-WhitneyUtest was used for further comparison between any two groups; Spearman rank correlation was used for correlation analysis. Results The AR group had a significantly higher frequency of Tfc in peripheral blood than the NAR group (U=60,P=0.008) and the HC group (U=2,P<0.001), and the NAR group had a significantly higher frequency of Tfc than the HC group (U=40,P<0.001). The frequency of Tfc was positively correlated with total B lymphocytes and juvenile B lymphocytes (r=0.665 and 0.462, bothP<0.001), negatively correlated with memory B lymphocytes and plasma cells (r=-0.453,P=0.001), and positively correlated with serum gamma-glutamyl transpeptidase level (r=0.371,P=0.026). Conclusion There is an increase in the frequency of peripheral Tfc in patients who experience acute rejection after liver transplantation, which is correlated with B lymphocytes and hepatic bile duct injury. Tfc may be involved in acute rejection after liver transplantation.
liver transplantation; graft rejection; T-lymphocytes
10.3969/j.issn.1001-5256.2017.07.027
2017-01-12;
2017-02-09。
国家自然科学基金(81571567)
张可(1991-),女,主要从事肝病的基础与临床研究。
施明,电子信箱:shiming302@sina.com。
R617
A
1001-5256(2017)07-1336-04

