2017年美国放射学会适宜性标准:可切除胰腺癌
祁 冰 译, 尚 东 审校
(大连医科大学附属第一医院 普外三科, 辽宁 大连 116000)
2017年美国放射学会适宜性标准:可切除胰腺癌
祁 冰 译, 尚 东 审校
(大连医科大学附属第一医院 普外三科, 辽宁 大连 116000)
胰腺肿瘤; 肿瘤辅助疗法; 美国; 诊疗准则
据美国癌症协会统计,2015年新发胰腺癌患者48 960例(男女比为1∶1),其中约40 560人死亡。尽管过去40年里,对肿瘤治疗的研究进展迅速,但胰腺癌患者的5年总体生存率改善不容乐观,仅从2%(1975-1977年)增加到6%(2003-2009年),当前手术仍是胰腺癌首选的治疗手段。然而,在众多胰腺癌患者之中,仅15%的患者可以进行手术,绝大多数患者由于肿瘤的转移或局部晚期进展而失去了手术机会。但是可切除胰腺癌患者即使行手术切除,术后依旧存在极高的局部和远处复发可能,这一现状凸显了高质量术后辅助治疗的重要价值。现有的胰腺癌文献体系中缺乏高质量的随机对照试验,对术后综合的辅助治疗尚未达成共识。本文回顾性分析与可切除胰腺癌相关的文献,并讨论可切除胰腺癌的生物学行为和术后综合辅助治疗的方法。
1 肿瘤标志物
CA19-9,作为一种可直接拮抗Lewis抗原的血清糖链抗原,是胰腺癌最具特征性的肿瘤标志物之一。术前和术后CA19-9水平均可作为胰腺癌的预后评价指标:(1)术前CA19-9水平与肿瘤的生长阶段及可切除性相关,并与肿瘤腹膜播散呈正相关;(2)术后CA19-9持续性高水平多提示预后不良或早期出现转移灶。但CA19-9的检测仍存在一定的局限性:(1) 5%~10%的人群因Lewis抗原基因的缺陷,导致CA19-9的检测可能出现假阴性结果;(2)血糖控制不良的糖尿病患者或有胆道梗阻的患者CA19-9的水平也会升高,从而影响临床的判断。据相关报道显示CA19-9检测胰腺癌的总体敏感性80%,特异性90%。尽管CA19-9是唯一经美国食品药物监督管理局认可的可用于胰腺癌检测的肿瘤标志物,但由于其局限性,探索新的肿瘤标志物的重要性不言而喻。
SMAD4(DPC4)是一种抑制KRAS基因的重要肿瘤抑制因子,其在胰腺导管腺癌中的失活比例>50%。 Blackford等的研究发现,胰腺癌中SMAD4基因的失活预示患者总生存期下降,同时SMAD4基因的缺失与肿瘤高侵袭性、淋巴结高转移率及肿瘤直径密切相关。
2 预后因素
除CA19-9以外,肿瘤标本切缘和相关淋巴结受累情况,也是决定患者术后预后的重要因素。其他次要的相关因素还包括年龄、肿瘤大小、肿瘤分级等。因此对于可切除胰腺癌患者是否接受高水平的外科手术,也影响其预后:(1)切缘病理。若病理切缘的术中冰冻为阳性结果,则提示患者的预后较差。切缘哪怕仅仅是镜检阳性(肿瘤灶距切缘1 mm以内),也会导致其总生存期以及无病生存期的下降。(2)淋巴结转移的情况。阳性淋巴结转移的比例(淋巴结受累的程度)越高,患者总生存期越差。同时,肿瘤生长的位置也是判断患者预后的指标之一,胰头肿瘤相比胰体或胰尾部肿瘤,更易早期发现(特别是有早发性黄疸的患者),手术相对及时;而胰体及胰尾部肿瘤常因发现较晚而失去手术机会,预后较差。
3 辅助治疗
在过去的40年间,关于可切除胰腺癌术后辅助治疗的高质量的随机对照研究廖廖无几,大多数研究存在方法学缺陷。
最先研究辅助治疗的是胃肠道肿瘤研究组织(GITSG),其临床试验编号为GITSG9137,该试验纳入了1974-1982年行胰腺癌切除且切缘阴性的患者,患者接受分程40 Gy剂量放射治疗,同时使用5-氟尿嘧啶(5-Fu)化疗,随后维持5-Fu化疗2年。由于入组过慢,该试验被提前终止,但仍有42例患者随机分配到了观察组和放化疗组,结果显示放化疗组生存受益较观察组明显升高,放化疗组中位总生存期为20个月,观察组为11个月。另有30例患者为验证研究结果随后进入了辅助治疗组,其2年、5年生存率分别为46%和17%。尽管该试验在技术和设计上有一定的瑕疵而受质疑,但仍以此为基础建立了可切除胰腺癌术后辅助治疗的先河,为寻求更佳的治疗标准做了铺垫。
随后,欧洲癌症研究组织(EORTC)试图通过增加病例数来提高GITSG试验的可信度。与GITSG入选标准不同的是,EORTC纳入的病例包括了壶腹周围癌和切缘阳性的患者。试验方案与GITSG类似,患者随机分配到观察组和治疗组,治疗组接受以5-Fu化疗为基础、总量为40 Gy的分程放疗,在首次接受总量为20 Gy的放疗后,停2周再完成剩余放疗,不维持长期5-Fu化疗。EORTC研究的结果显示:(1)本研究纳入标准宽松,纳入了更多病例。由于研究纳入了壶腹周围肿瘤,其预后较好,且无病生存期和总生存期均高于胰腺肿瘤,因此降低了观察组和治疗组生存期存在差别的可能性;(2)约20%的患者未能按照计划接受辅助放化疗,44%的患者未按照预定方案执行化疗,因此本研究认为辅助治疗没有获益结果(即使亚组分析显示治疗组有轻微受益);(3)对胰头癌患者的亚组分析显示,应用双侧对数秩和检验,观察组与治疗组2年的总生存期分别为26%和34%,差异无统计学意义(P=0.099)。但应用单侧检验重新分析了EORTC胰头癌研究数据,结果显示联用放化疗,在P<0.05水平上,治疗组和观察组两者差异有统计学意义。
由胰腺癌欧洲学组(ESPAC)开展的关于胰腺癌辅助治疗效果的前瞻性Ⅲ期随机试验(ESPAC-1),纳入541例患者。根据随机原则,患者术后被分到了2×2析因组,或由内科医生直接将受试者分配到2个随机组,即:化疗组与观察组和放化疗组与观察组。对中位数为10个月的所有幸存者(至2001年)的随访结果显示:在有效生存期方面,放化疗组和观察组之间的差异无统计学意义(15.5个月 vs 16.1个月,P=0.24);而有效生存期在非化疗组和化疗组之间,差异具有统计学意义(14.0个月 vs 19.7个月,P=0.000 5);该试验因方法学缺陷,数据分析困难,对可切除胰腺癌术后是否适用于辅助治疗仍没有定论。
德国胰腺癌研究组织(CONKO)研究了胰腺癌术后单纯使用吉西他滨作为辅助治疗的效果。其试验编号为CONKO-001,这项高质量、设计良好的Ⅲ期临床试验选择了354例术后CA19-9≤2.5倍正常值上限且切缘为R0或R1的胰腺癌切除术后患者作为研究对象,此研究将患者分为观察组和治疗组,治疗组使用吉西他滨单独治疗6个周期。研究中超过80%的患者行R0切除术,患者平均随访136个月。研究显示,治疗组5年生存率和无病存活率均优于对照组(表1)。

表1 78岁男性患者,高分化的可切除胰头癌,pT1N0M0, 切缘阴性,无腹膜转移证据
注:术后CA19-9=80。Karnofsky功能状态评分80。评定量表:1,2,3通常为不适合;4,5,6可能适合;7,8,9通常适合;RT:放疗
肿瘤放射治疗组织 (RTOG),其试验编号为RTOG 97-04,首次运用现代放射治疗技术,纳入了进行高质量外科切除术和淋巴结清扫术的患者,术后应用吉西他滨联合放疗,对肿瘤生存期等指数进行效果分析。RTOG的研究结果,强调了术后CA19-9水平对于评价预后的重要性。术后血清CA19-9≥90 U/ml的患者中位生存期降低,使用吉西他滨可改善3年生存状况,但对5年生存率改善效果不佳(P=0.08)。CA19-9<90 U/ml并按方案接受放疗的胰头癌组患者的生存率有所提高,其中位生存期为24个月,5年生存率为34%。
依据辅助放疗副作用处理建议,ESPAC启动了另外3个试验。其中编号为ESPAC-3的试验是一项以胰腺癌根治性切除术后患者为对象的多中心Ⅲ期随机对照试验,最初设计有3个对照组。患者被随机分配到观察组、6周期5-Fu组和6周期吉西他滨组。由于ESPAC-1的试验结果已经证实了辅助化疗组的疗效优于观察组,此试验顺势取消了观察组,将1088例患者随机分配到2个化疗组,即5-Fu组和吉西他滨组,2组的肿瘤无进展生存期或中位生存期差异均无统计学意义。然而5-Fu组的严重不良事件发生率高于吉西他滨组,且差异有统计学意义。进一步研究表明,相比延迟辅助治疗的患者,术后12周内进行完整辅助治疗的患者预后更好。这可以解释为什么在EORTC 40891和ESPAC-1试验中的治疗组没有明显受益,因为这两项临床试验治疗组的部分患者并未完整地完成指定治疗方案。近期,德国进行的编号为CONKO-005的研究以摘要形式发布了结果,他们正在研究吉西他滨联合厄洛替尼的辅助化疗方案是否有益于患者。这项研究将胰腺肿瘤切缘阴性的患者随机分为单独使用吉西他滨治疗组和吉西他滨联合厄洛替尼治疗组,然而联合使用厄洛替尼治疗组的中位无病生存期和中位总生存期均未优于单独使用吉西他滨的治疗组。
尽管以上这些研究针对“可切除胰腺癌的辅助治疗”这个课题留有许多悬而未决的问题,但综合这些研究结果,可以证明术后辅助治疗的必要性。这些研究也表明,术后进行单纯化疗或高质量放化疗,其治疗效果优于仅进行肿瘤切除治疗。
复发的风险越高,系统性化疗的疗效越好,所以辅助治疗(包括放疗)可能会变得愈发重要。对于术后局部肿瘤复发,局部放疗有较好的治疗效果。尸检研究揭示了一个常规影像不易检测到但局部复发率高达75%的隐匿性腹膜后浸润的肿瘤复发模式。一些大型独立机构的研究也支持放化疗联合运用能够达到控制局部肿瘤复发的效果。1993-2005年,约翰霍普金斯医院的一个前瞻性数据库分析显示,与单纯手术相比,以5-Fu为基础的放化疗能够使81.9%的淋巴结阳性患者和48%的切缘阳性高危患者的总生存期提高。1975-2005年,梅奥诊所的一个相似的回顾性研究分析了一些手术切缘阴性患者的数据,证实了联合放化疗能够改善他们的总生存期。尽管高级别肿瘤有较多的阳性淋巴结和更高的肿瘤分期,但接受辅助放化疗的患者的中位总生存期有25.2个月,而观察组的中位总生存期为19.2个月。约翰斯霍普金斯医院与梅奥诊所合作,对两所机构中的1092例胰腺癌切除术后的患者进行了回顾性分析,将患者分为以5-Fu为基础的放化疗组和观察组。配对分析证实:尽管有67%的患者存在淋巴结阳性,60%的患者肿瘤直径≥3 cm,三分之一的患者肿瘤手术切缘阳性,进行术后同步放化疗也能够改善这些相对高危患者的总生存期(21.9个月 vs.14.3个月)(表2,3)。

表2 65岁女性患者,中分化的可切除胰头癌,pT2N1M0, 切缘阴性,15个淋巴结有1个受累,无腹膜转移证据
注:术后CA19-9=120。Karnofsky功能状态评分80。评定量表:1,2,3通常为不适合;4,5,6可能适合;7,8,9通常适合

表3 70岁男性患者,低分化的可切除胰头癌,pT3N0M0, 钩突切缘阳性
注:术后CA19-9=140。Karnofsky功能状态评分80。评定量表:1,2,3通常为不适合;4,5,6可能适合;7,8,9通常适合
4 新辅助治疗
手术治疗仍是可切除胰腺癌患者的首选方法。然而,过去的40年传统治疗方法停滞不前,因此研究新的治疗方法十分必要。新辅助化疗在很多肿瘤中不仅局限于理论,而且具有实际应用价值,在胰腺癌治疗中也可发挥重要的作用。丰富的血供提高了放化疗药物转运至靶器官的效率,同时术前辅助治疗提高了所有既定手术治疗方案实施的可能性。术前的治疗可以使肿瘤降期,以提高手术质量、降低淋巴结转移率。一项包含5414例手术切除且术前或术后行放疗的研究中,行新辅助治疗的患者具有较高的切缘阴性率(82% vs 72%)和较低的淋巴结转移率(41% vs 65%)。此外,早期治疗可使伴微转移的患者或伴有广泛转移的患者达到接受手术治疗的标准,或拥有更多的治疗选择。
MD Anderson癌症研究中心结合他们丰富的治疗经验对几组小样本病例研究显示,新辅助治疗在可切除胰腺癌中具有重要的作用。以吉西他滨为基础的新辅助治疗具有显著的疗效及较高的切缘阴性率和局部控制率。一项来自MD Anderson研究中心的多种新辅助治疗的对比研究表明,相比于之前使用5-Fu或者紫杉醇,以吉西他滨为基础的新辅助化疗方案并行胰十二指肠切除术的患者生存时间延长。一项多机构的Ⅱ期全剂量吉西他滨和放疗的新辅助研究也是支持其可行性的证据之一。招募41例可行手术切除的胰腺癌患者,以全剂量的吉西他滨(1000 mg/m2)行3周期治疗,在第2周期予以36 Gy的三维放射治疗。与MD Anderson研究中心的经验一致,行手术治疗的20例患者中手术成功率高,在17例患者中有16例切缘阴性,11例淋巴结阴性。该化疗方案耐受尚可,仅2例患者发生4级化疗毒性反应,分别为血液系统疾病和幽门梗阻。3级的中性粒细胞减少(12.8%)、3级的恶心(10.3%)、3级的呕吐(10.3%)为患者最常见的副反应。仅有一项关于可切除胰腺癌新辅助放化疗的随机病例研究,但因缺乏足够的患者而提前结束。在此Ⅱ期随机病例研究中,患者术前运用与CONKO-001试验相同的吉西他滨辅助化疗或者行三维适形放疗加吉西他滨和顺铂化疗的新辅助放化疗方案,放疗剂量为肿瘤组织55.8 Gy,局部淋巴结50.4 Gy。只有29例患者行新辅助放化疗,虽然2组病例总生存期中位数差异无统计学意义,但是行手术切除及化疗组中位总生存期是18.9个月,而新辅助化疗为25.0个月,术后并发症发生率方面差异亦无统计学意义。一项来自Wisconsin医学院的回顾性研究表明,在可能切除和可切除胰腺癌患者中,新辅助放化疗后R0切除有所增加,并且完成治疗方案的患者平均生存时间为26个月。一项单中心研究表明,在术前行大分割质子放疗(25Gy/5Gy/5f)同时口服卡培他滨1~2周的方案安全可行,并可以达到局部控制,但是在长期疗效方面尚需要更多的数据。虽然新辅助放化疗在可切除胰腺癌中具有一定的作用,但是目前仍未得到证实,尚属于临床注册研究(表4)。
5 放疗
由于放射肿瘤学技术(肿瘤成像、治疗计划和治疗实施)的日益进步,使得放疗学家面临着越来越大的挑战。RTOG 97-04试验分析结果显示,48%的放疗质量得分都低于既定方案,并且这类质量欠佳的放疗与患者总生存期降低相关。传统上,二维放疗依靠X射线可视化椎体来识别靶点,现代三维成像技术证实淋巴管与骨骼解剖之间存在相对的位置变异关系,这也强调了全方位了解解剖学的重要性。
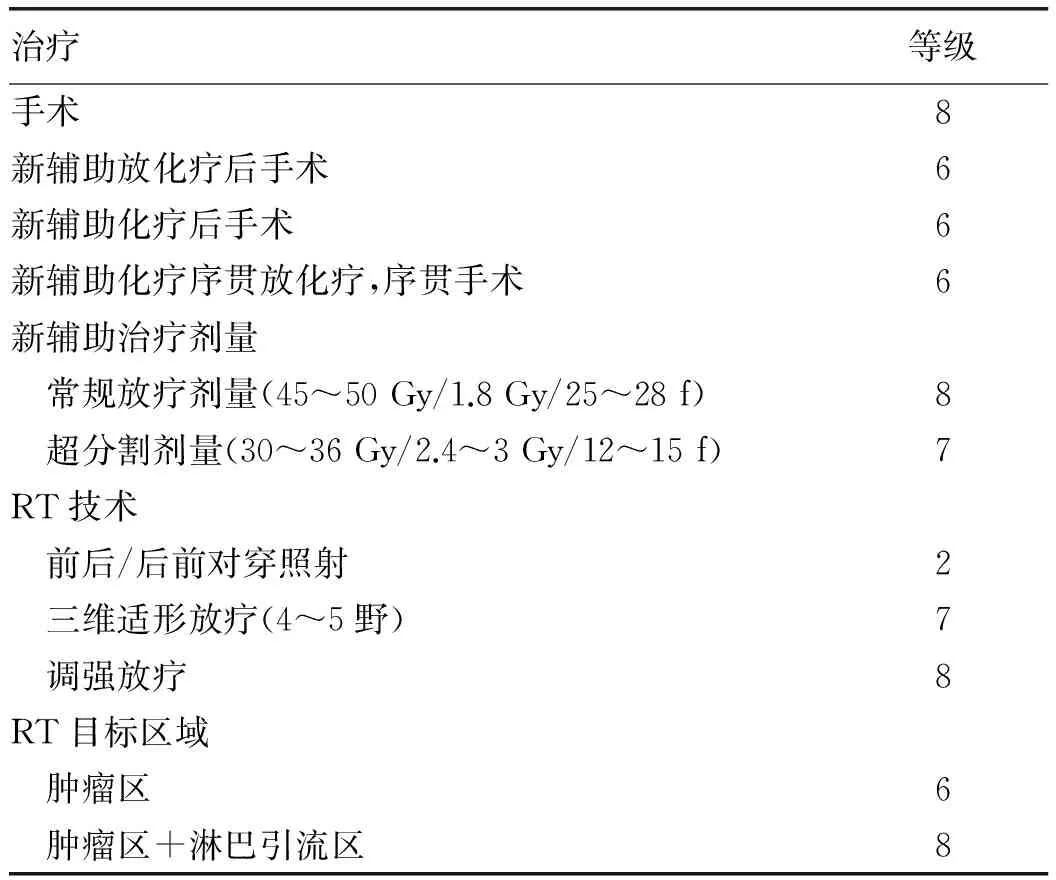
表4 65岁女性患者,中分化的可切除胰头癌,cTN0M0
注:术后CA19-9=140。Karnofsky功能状态评分90。评定量表:1,2,3通常为不适合;4,5,6可能适合;7,8,9通常适合
调强放疗可能会降低放射剂量对周围器官(如肾、胃、肝脏和小肠)的危害,还可能减少小肠并发症的发生,包括减少3~4级的恶心、呕吐和腹泻的发生。然而,调强放疗会增加因没有正确认识和评估机体运动而出现的定位遗漏的可能性。比如胰腺易受呼吸和胃充盈的影响,此时不得不扩大计划靶体积,来消除对定位的影响。美-法共识指南中关于局部进展性胰腺癌治疗方案提到:“当不使用影像引导放射治疗时,向前、向后、向外侧分别扩展1.5~2 cm,向头尾侧扩展2~3 cm以达到预期的靶区;使用影像引导放射治疗时,利用腹部加压以尽量减少呼吸运动,可以大大减少所需的计划放射量。”已出版的“靶区勾画指南”可指导医生对局部复发风险最大的位置进行准确定位。指南用于靶区勾画,而RTOG发布的步骤说明图,用于调强放疗的放射区域设计。基于证据指导的靶区勾画指南和运动控制可帮助设计出高质量的调强放疗,可以在降低局部复发率的同时不增加边缘丢失率。
越来越多的适形治疗如调强放疗使胰腺癌治疗中的剂量递增成为可能。自GITSG研究以来,对胰腺癌的放射剂量一直在增加,大多数研究在辅助治疗中使用50~54 Gy(每日剂量1.8~2.0 Gy)。值得关注的是,ESPAC-1研究允许的放射剂量非常宽泛,为40~60 Gy。尽管没有公认的最佳剂量,但根据美国国家癌症数据库中1998-2002年的辅助放疗数据,利用多变量生存分析和Kaplan-Meier模型进行分析,发现最佳剂量在50~55 Gy范围内,较高或较低剂量均与总生存期缩短相关。虽然尚未有明确证据,但低生存率可能与使用陈旧的、更高放射剂量的放射技术引起的治疗相关毒性有关。
6 未来治疗研究方向
可切除胰腺癌治疗的临床相关试验很多,各自的结果不尽相同。理想状态下,研究者可通过增加纳入患者例数来解决现有问题,并提出新的治疗方案,而实际情况中,患者往往在疾病已经进展或无法切除时才出现症状,因此急需发现一个可靠的肿瘤标志物以提供早期诊断依据,使更多患者不错过手术的最佳时机。近期研究发现磷脂酰肌醇蛋白聚糖-1可作为胰腺癌新的外源性标志物进行辅助诊断早期胰腺癌,但需要有临床数据来证实其是否适用。
在过去的40年里,传统治疗方法止步不前,因此需要探索新的治疗方法。目前的研究多致力于新化疗药物和生物治疗药物的开发,联合或不联合局部放射治疗。针对胰腺癌的新化疗药物和生物治疗药物的研发实验主要包括:(1)RTOG 0848试验,可切除胰腺癌患者随机分为化疗组和放化疗组,化疗是在吉西他滨的基础上加用埃罗替尼。遗憾的是由于化疗组的某些原因,该试验于2014年4月2日被迫终结;(2)当肿瘤出现转移时,多药化疗(如FOLFINOX和吉西他滨联合紫杉醇)显示出优于单用吉西他滨的效果。虽然,辅助和新辅助治疗效果在相关临床试验中均已体现,但目前仍缺乏可靠的前瞻性临床研究;(3)其他的联合用药方案,比如吉西他滨联用卡培他滨,吉西他滨联用顺铂或奥沙利铂,作为辅助或新辅助治疗的评估结果不一,有待于进一步临床试验的证实。
除此之外,治疗胰腺癌的新药正在研究中,研究显示可应用联合免疫疗法(疫苗)将肿瘤识别为外来物,进而激活固有免疫系统,并且可以改善转移性胰腺癌患者的总生存期,并被证实其安全、有效。可切除胰腺癌患者接受以Fu为基础的辅助放化疗之后,Ⅱ期使用GVAX疫苗可促进T淋巴细胞识别各种肿瘤相关抗原,以达到治疗效果,结果显示患者无病生存期为17.3个月,中位生存期为24.8个月。通过以上试验可知,肿瘤基质微环境在肿瘤的生物学行为中扮演着重要的作用,其可作为新的靶标进而研发治疗药物,目前应用免疫抑制因子是胰腺癌治疗中极具潜力的研究热点。最后,联合应用多种药物的新辅助化疗和用光子或质子立体放疗也可改变肿瘤病理反应和结果,然而仍需大量研究加以证实。
7 总结
(1)CONKO-001高质量研究显示:患者在胰腺癌手术切除后,没有或很少有局部复发的风险,可能得益于单纯的辅助性化疗。单纯的辅助化疗可能更适合于机体机能状态受损的患者和不能耐受联合放化疗的患者。
(2)接受手术切除的胰腺癌患者受益于辅助治疗,包括化疗或放化疗联合的辅助治疗。治疗方案主要取决于患者是否能够耐受多重疗法以及对于远处复发和局部复发的危险因素的评估来进行选择。
(3)手术切缘阳性的患者会增加局部复发的风险,可能会受益于辅助治疗,包括联合放化疗。
(4)尽管前期手术仍然是可切除的胰腺癌患者的标准治疗方案,但多项临床试验已证明新辅助放化疗的可行性和较好的预后。该治疗方案的受益之处主要在于可合理选择患者进行手术治疗,可针对巨大肿瘤尽最大的努力进行治疗。
证据总结:
(1)在《ACR适宜性标准:可切除胰腺癌》中引用的78篇参考文献,69篇被分类为治疗性的参考文献,包括21篇设计完好的研究和34篇高质量的研究。除此之外,另外9篇被分类为诊断性的参考文献,包括1篇设计完好的研究和4篇可能存在设计局限性的研究。有18篇文献作为原始证据是无效的。
(2)在《ACR适宜性标准:可切除胰腺癌》中引用的78篇参考文献都发表于1985-2015年。
(3)尽管在该报告中的有些研究存在设计上的缺陷,但有56篇设计完好或高质量的研究可以提供很好的证据。
[本文首次发表于Am J Clin Oncol, 2017, 40(2): 109-117] 引证本文:QI B, SHANG D. ACR appropriateness criteria®resectable pancreatic cancer[J]. J Clin Hepatol, 2017, 33(7): 1249-1254. (in Chinese) 祁冰, 尚东. 2017年美国放射学会适宜性标准:可切除胰腺癌[J]. 临床肝胆病杂志, 2017, 33(7): 1249-1254.
(本文编辑:王 莹)
ACR appropriateness criteria®resectable pancreatic cancer
QIBing,SHANGDong.
(ThirdDepartmentofGeneralSurgery,TheFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian,liaoning116000,China)
pancreatic neoplasms; neoadjuvant therapy; United States; practice guideline
10.3969/j.issn.1001-5256.2017.07.008
2017-04-30;
2017-05-11。
祁冰(1985-),男,主治医师,博士,主要从事胆胰疾病的中西医结合治疗。
尚东,电子信箱:tougao1971@163.com。
R735.9
B
1001-5256(2017)07-1249-06

