植物和真菌双重荧光染色方法研究
张 杰,刘 军"
(1.周口师范学院生命科学与农学学院,河南周口466001;2.邓州市成人教育教学研究室,河南邓州474100)
植物和真菌双重荧光染色方法研究
张 杰1,刘 军2"
(1.周口师范学院生命科学与农学学院,河南周口466001;2.邓州市成人教育教学研究室,河南邓州474100)
双重荧光染色便于观察细胞的显微结构,它具有精确、稳定、可靠的优势.通过改进透化细胞壁和增加抗荧光淬灭剂的方法研究了植物细胞和真菌孢子的双重荧光染色的方法.实验结果表明:改进双重荧光染色步骤后能够使植物细胞和真菌孢子在荧光显微镜下显示出清晰的双重荧光.
双重荧光染色;植物;真菌
随着生物技术工作的不断拓展和深入,双重荧光染色法越来越受到生物学研究者的重视.双重荧光染色方法有助于生物学工作者简便、准确地了解研究对象[1].由于两种染料有不同的荧光光谱,可以在荧光显微镜下显示不同的颜色,因此能够更加准确、可靠地显示出研究对象静态或动态的变化[2].双重荧光染色法已广泛用于观察细胞发育、细胞凋亡、蛋白互作[3].由于在实际应用中存在一些问题而受到一定限制,例如染色后内细胞团成云雾状,导致无法准确分辨结构;染色后细胞内的亚显微结构界限模糊,不能清晰地区分;试验步骤繁琐,所需时间较长等[4].用双重荧光染色的方法观察植物细胞和真菌细胞内结构的研究尚未见报道,鉴于此,该试验在前人试验的基础上,简化双重荧光染色的步骤,确定了适合植物和真菌的最佳染料浓度与处理时间,同时增加了抗荧光淬灭的双重荧光染色方法,由此尝试建立了一种针对植物和真菌的双重荧光染色方法.
1 材料与方法
材料:洋葱表皮细胞和绿僵菌孢子.
试剂:罗丹名标记actin抗体染色剂,核染色剂DAPI,PBS缓冲液pH 6.8.
改进方法:P______BS清洗细胞2次→0.5%曲拉通室温透化细胞10min→5μg/mL的FITC-鬼笔环肽37oC染色60min→PBS清洗细胞2次→DAPI染色10min→PBS清洗细胞2次→滴一滴抗荧光淬灭封片液于载玻片上→盖玻片封片→指甲油封边→荧光显微镜观察.
2 结果与分析
2.1 洋葱表皮细胞染色结果
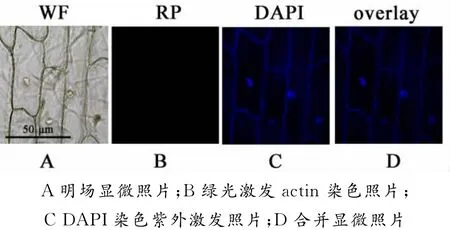
图1 处理前洋葱表皮细胞双重荧光染色效果图
由图1可知,用未改进的方法处理洋葱细胞后,在荧光显微镜下拍摄不到罗丹明标记的红色actin(图1B),而只拍摄DAPI标记的蓝色细胞核的荧光信号(图1C),细胞壁也呈现了蓝色荧光,表明其专一性不强,进行整合后不能清晰显示细胞核与actin结构关系图(图1D).

图2 处理后洋葱表皮细胞双重荧光染色效果图
处理方法改进后,在荧光显微镜下拍摄得到两种信号(图2),红色的罗丹明标记的actin(图2 B),蓝色为DAPI标记的细胞核(图2C),然后进行整合,可以得到如图2D所示的细胞核与actin结构关系.由图2可知经过上述方法处理后,洋葱表皮细胞的细胞壁和细胞核部位能够被罗丹明标记的actin抗体染上清晰的红色荧光;细胞核能够被DAPI染上清晰的蓝色;经过整合后,可以看到actin不仅作用于细胞核,而且在细胞壁部位也含有大量的actin.该结果表明经过上述方法处理后能够使两种染色剂稳定地结合到目标部位.
2.2 真菌孢子染色结果
由图3可知,用未改进的方法处理绿僵菌孢子后,在荧光显微镜下拍摄不到罗丹明标记的红色actin(图3B),而只拍摄到DAPI标记的蓝色细胞核的荧光信号(图3C),进行整合后不能清晰显示细胞核与actin结构关系图(图3D).

图3 处理前绿僵菌孢子双重荧光染色效果图

图4 处理后绿僵菌孢子双重荧光染色效果图
处理方法改进后,由图4可知在荧光显微镜下拍摄得到两种荧光信号,红色的罗丹明标记的actin(图4B),蓝色为DAPI标记的细胞核(图4C),然后进行整合,可以得到如图4D所示的细胞核与actin结构关系.由图4可知经过上述方法处理后,真菌孢子细胞质能够被罗丹明标记的actin抗体染上清晰的红色荧光;细胞核能够被DAPI染上清晰的蓝色;经过整合后,可以看到actin与细胞核部位重合,但是不能清晰地标记细胞壁部位.该结果表明经过上述方法处理后能够使两种染色剂稳定地结合到真菌孢子的目标部位,但是不能清晰地标记真菌细胞壁.
3 讨论
双重荧光染色技术是细胞组织学研究最基本的技术,借助于染料与细胞特定的生化成分,使细胞内的不同组织呈现出不同的荧光颜色,以便观察.通过双重荧光染色分析能够准确可靠地定位细胞核和actin的位置.罗丹明标记actin抗体染色时首先要通过0.5%曲拉通室温透化细胞,否则该染料不能透过细胞膜导致染色失败.曲拉通透化后能够使罗丹明标记的actin抗体结合到actin上,actin能够在荧光显微镜下显示出清晰的红色荧光,并且不影响下一步的复染结果(图1和图2).该方法比通过水解细胞壁的方法缩短了染色时间[2,5].与吖啶橙染色细胞核相比[6],DAPI复染细胞核结果是结构更加清晰,易于观察.DAPI染料与DNA的结合是非嵌入式的,主要结合在DNA的AT碱基区,用紫外光激发时发射出明亮的蓝色荧光.DAPI染色并不影响植物细胞和真菌孢子细胞中actin的装配(图1和图2).在染色后封片时加上抗荧光淬灭剂能够长时间地保持荧光而不淬灭.这样更便于在显微镜下寻找理想的视野.
该实验所用染色方法在植物细胞和真菌孢子中染色都能得到良好的效果,但是对真菌孢子染色时由于真菌孢子太小而不能清晰地区分出真菌孢子的细胞壁.故在该荧光染色方法的基础之上,可以进一步地用细胞壁特异结合的荧光染料进行第三次染色进而观察细胞壁的显微结果.荧光染色方法虽然具有精确、稳定、可靠等优点,但是实验周期比较长、实验试剂比较昂贵,而且对于实验人员的技术要求较高[7].通过改进操作方法和实验流程能够保持荧光染色方法的精确、稳定、可靠等优势,同时降低了对于实验人员的技术要求,进而能够使荧光染色方法在生物学研究领域普及推广.
[1]刘甜甜,周倩,吴秋云,等.马铃薯晚疫病菌侵染的Solophenyl Flavine荧光染色方法研究[J].植物科学学报,2016(02):316-324.
[2]乔飞,曹晶潇,江雪飞,等.香蕉叶片微管免疫荧光染色方法的建立与应用[J].热带作物学报,2012(08):1409-1411.
[3]王萍,栾非时,陈克农,等.4种染色方法对甜瓜白粉病菌染色效果的观察比较[J].菌物学报,2008(05):673-678.
[4]孙尉峻,于学颖,胡庭溪,等.一种同时进行牛囊胚差异染色和凋亡染色的方法[J].畜牧兽医学报,2015,16(11):1967-1973.
[5]Millanes Ana María,Fontaniella Blanca,Legaz María Estrella,et al.Glycoproteins from sugarcane plants regulate cell polarity of Ustilago scitaminea teliospores[J].Journal of Plant Physiology,2005,162(3):253-265.
[6]张雪英,尹增芳.毛竹组织荧光染色显微观察方法的研究[J].竹子研究汇刊,2008,27(04):26-29.
[7]蔡欣.标记减数分裂遗传重组的免疫荧光染色方法[J].中国生物化学与分子生物学报,2010,26(11):1068-1071.
S865.1
A
1671-9476(2017)02-0114-03
10.13450/j.cnkij.zknu.2017.02.028
2016-10-20;
2016-11-16
河南省教育厅自然科学资助项目(No.2011B180061)
张杰(1975-),男,河南太康人,讲师,在读博士,主要研究方向:分子生物学与生物工程.

