甜面酱中黑曲霉的分离及制曲条件的优化
谢光杰,叶碧霞,左勇*,张晶
(1.四川化工职业技术学院,四川 泸州 646000;2.四川理工学院 生物工程学院,四川 自贡 643000)
甜面酱中黑曲霉的分离及制曲条件的优化
谢光杰1,叶碧霞2,左勇2*,张晶2
(1.四川化工职业技术学院,四川 泸州 646000;2.四川理工学院 生物工程学院,四川 自贡 643000)
对从甜面酱中分离的黑曲霉进行初步鉴定,采用Box-Behnken法优化制曲条件。在单因素试验的基础上,选取制曲温度、湿度及时间为响应因素,以成曲的糖化酶活力为响应值,设计三因素三水平的分析试验,建立回归模型,获得最佳制曲工艺条件为:温度31 ℃、湿度90%、时间57.5 h,在此条件下糖化酶活力达到717.42 U/g干曲。
甜面酱;黑曲霉;制曲条件;响应面试验
甜面酱作为一种传统酿造调味品,是以面粉为主要原料,经蒸煮后在微生物代谢产生的糖化酶作用下将淀粉水解为还原糖,在蛋白酶的作用下将蛋白质水解为小分子多肽及氨基酸[1]。因其具有特殊的滋味和体态,深受广大消费者青睐。
甜面酱生产主要经过通风制曲、低盐固态发酵等阶段制成[2]。制曲阶段主要是通过米曲霉等微生物生长繁殖代谢产生多种酶类,从而在拌盐水发酵阶段利用多种酶对原料进行降解[3]。目前,甜面酱的生产菌种主要采用米曲霉3.042[4],米曲霉在固态制曲时,能够分泌较多酶系[5,6]。程会欣[7]、李保英等[8]研究多曲种混合酿制酱油中,利用米曲霉和黑曲霉共同作用可以提高原料的蛋白利用率以及酱油品质。金华勇[9]研究了不同曲霉菌种用于甜面酱接种制曲工艺,结果表明黑曲霉制曲具有可行性。付雯等[10]研究了黑曲霉、根霉双菌种制曲工艺,与米曲霉分别制曲后混合发酵,提高了曲料糖化酶活力。大量的研究[11-13]表明:丰富制曲菌种可以提高曲料糖化酶活力。黑曲霉作为生产糖化酶的主要工业菌株,具有较大的应用潜力[14-17],因而筛选优良的黑曲霉糖化菌株具有现实意义。
本研究拟从甜面酱中分离筛选获得黑曲霉,并对其固态制曲条件进行优化,其研究结果可丰富甜面酱的制曲菌种选择,并为进一步扩大甜面酱的产业化,提高产品质量提供依据。
1 材料与方法
1.1 材料
甜面酱样品:来源于四川省自贡市某食品厂。
培养基:分离单菌落采用PDA培养基;菌落形态学鉴定采用查氏培养基;种子液采用液体PDA培养基。
1.2 主要仪器
AR1140电子天平 奥豪斯公司;TW-2000W可调温电炉 成都市永兴电器厂;立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;HL MJ-250恒温恒湿箱;SKY-2012C恒温摇床 上海沪粤明科学仪器有限公司。
1.3 实验方法
1.3.1 菌种的分离与纯化
无菌条件下,称取10 g甜面酱样品于盛有90 mL无菌水的250 mL锥形瓶中,35 ℃,270 r/min条件下振荡30 min。采用无菌水进行梯度稀释。选取适宜的梯度稀释液,涂布于PDA培养基上,每个稀释度接种3个平板,将其置于28 ℃的培养箱内培养48 h后进行观察,挑选培养基上菌落形态不同的单菌落各自进行多次划线分离,直至获得纯培养物。获得的纯化菌种同时进行斜面保藏,保存菌种备用。
1.3.2 菌落形态特征的观察
对所分离纯化的菌株点样接种于平板,培养后观察菌株在固体培养基上的形态特征[18]。
1.3.3 霉菌的鉴定
采取插片培养法[19]:将无菌盖玻片以45°左右的角度插入平板培养基中,插入深度为盖玻片的1/3左右。用无菌接种环挑取霉菌孢子,划线接种于盖玻片与琼脂培养基的交界线上。放置于28 ℃的培养箱内培养3~5天。用无菌镊子将长有菌体的盖玻片取出,放置在干净的载玻片上,在显微镜下用低倍镜找准观察区域,再在高倍镜下观察霉菌形态。
1.3.4 酶活力测定方法
采用斐林试剂标准糖液反滴定法测定[20]。糖化酶活力定义:1.0 g干曲在40 ℃,pH 4.6的条件下,1 h分解可溶性淀粉生成1 mg葡萄糖,为1个酶活力单位,用U/g表示。
1.3.5 种子液制备
斜面活化的纯种黑曲霉,用无菌接种环挑取1~2环孢子接入灭菌的装有玻璃珠的PDA液体培养基中,置于30 ℃,180 r/min,振荡培养至孢子数为107个/mL。
1.3.6 制曲工艺
面粉经蒸煮后,按照孢子数为8×108个/g干基的接种量接入熟料中,充分拌匀后平铺,置于恒温恒湿培养箱中,依据试验设计的工艺条件进行试验,视情况翻曲1~2次。
1.3.7 单因素试验
影响黑曲霉产酶活力的因素有多种,主要考察制曲温度、湿度以及时间对黑曲霉产糖化酶活力的影响。
1.3.8 Box-Behnken试验设计
在单因素试验基础上,根据中心组合试验设计原理,以糖化酶活力为评价指标,设计三因素三水平响应面分析试验。试验的设计、模型建立以及数据采用Design-Expert[21]软件分析,从而确定最优制曲工艺参数。
1.3.9 验证试验
为了确定通过响应面分析所建立的模型与试验结果是否吻合,以优化后的最佳制曲条件进行试验,重复3次。
2 结果与分析
2.1 霉菌的形态学观察
霉菌在PDA培养基上生长3天的菌落形态特征见图1。
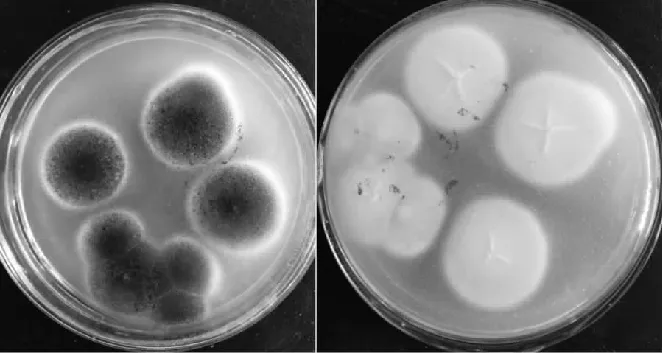
图1 霉菌菌株的菌落形态
由图1可知,通过肉眼观察微生物生长于PDA培养基上的形态,发现菌落最初为白色,菌落形态近似圆形,表面粗糙,呈粉状,菌丝为白色,孢子为黑色,从培养基上观看正面为黑色,背面为白色。
插片培养结束后,无菌镊子夹取盖玻片放置于10×10倍显微镜下观察分生孢子头的形态,显微镜检结果见图2。

图2 霉菌菌株的形态特征
由图2可知,分生孢子头的顶囊近似球形,小梗双层,第一层粗大,第二层相对短小,呈放射排列,布满整个顶囊,呈现黑色,顶端有链形孢子。再结合图1菌落形态观察结果,判断其为曲霉科,属于黑曲霉(Aspergillusniger)。
2.2 产酶条件的单因素试验结果
2.2.1 制曲温度对甜面酱曲中糖化酶活力的影响
控制湿度为90%,培养时间为60 h及其他条件相同的情况下,比较在28,30,32,34,36 ℃不同温度培养下的糖化酶活力,确定菌株的适宜产酶温度。制曲温度对所产糖化酶活力的影响见图3。
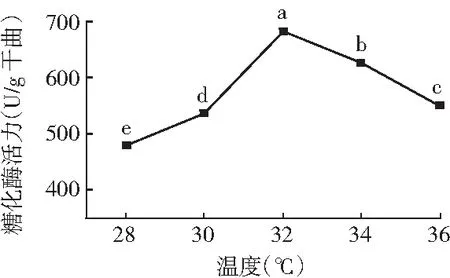
图3 制曲温度对糖化酶活力的影响
由图3可知,温度的设置水平对试验指标糖化酶活力的影响均表现为显著性差异。随着温度的升高,黑曲霉产糖化酶活力逐渐增大,当温度达到32 ℃时,糖化酶的活力最大,制曲温度继续升高,酶活力呈现下降趋势。分析可能的原因在于,前期随着温度的增加,微生物生长旺盛,菌丝体大量繁殖,产酶量增加;超过32 ℃后,温度过高可能产生了烧曲现象,导致酶活力开始下降。故选择制曲温度30~34 ℃作为响应面试验的因素水平。
2.2.2 制曲湿度对甜面酱曲中糖化酶活力的影响
在温度为30 ℃,培养时间为60 h以及其他培养条件相同的条件下,比较在75%,80%,85%,90%,95%不同湿度梯度条件下黑曲霉产糖化酶活力,确定合适的产酶湿度。制曲湿度对所产糖化酶活力的影响见图4。
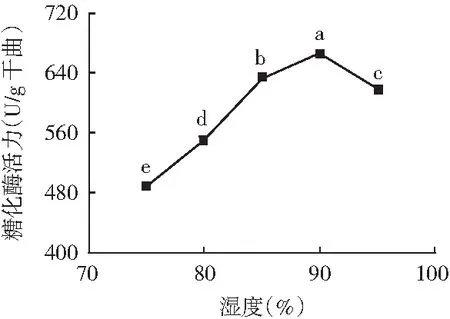
图4 制曲湿度对糖化酶活力的影响
由图4可知,不同湿度的选择对试验结果影响显著。在一定湿度范围内,酶活力随着制曲湿度的升高而增加,达到最大值时湿度为90%;随着湿度的继续增大,酶活力逐渐降低。可能的原因在于,前期微生物的生长需要一定的湿度维持,微生物在前期大量生长产热的同时使得物料水分流失,此时随着湿度的补充,微生物能够大量生长产酶,超过一定湿度后,曲料湿度过大影响氧气及营养物质传递,酶分泌的界面消失使得酶活力下降。故选择制曲湿度85%~95%作为响应面试验的因素水平。
2.2.3 制曲时间对甜面酱曲中糖化酶活力的影响
控制培养温度为30 ℃,湿度为90%的条件下,分别考察36,48,60,72,84,96 h的糖化酶活力,确定最佳产酶时间。制曲时间对糖化酶活力的影响见图5。

图5 制曲时间对糖化酶活力的影响
由图5可知,随着制曲时间的延长,糖化酶活力逐渐增大,达到峰值的时间为60 h,随着制曲时间的继续延长,糖化酶活力呈现下降趋势。分析可能的原因在于,微生物生长与时间密切相关,制曲时间的选择关系到糖化酶活力的高低。培养时间过短,菌丝没有得到大量生长,分泌的糖化酶含量较低;时间过长,霉菌大量生长繁殖产孢子,原料更多地用于微生物的生长繁殖,最后分泌的酶也相对较少[22]。前期主要是微生物菌丝萌芽及其分泌酶的阶段,随着时间延长,微生物开始大量产孢子,分泌的酶相对减少,酶活力下降。因此,选择制曲时间在48~72 h之间。
2.3 响应面法优化制曲条件
响应面分析试验因素及水平的设定见表1。
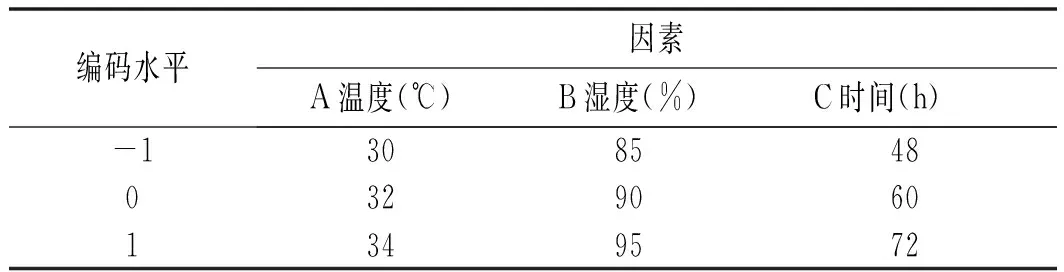
表1 Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken tests
2.3.1 Box-Behnken试验结果
根据单因素试验结果,设计三因素三水平的Box-Behnken试验,试验结果见表2。
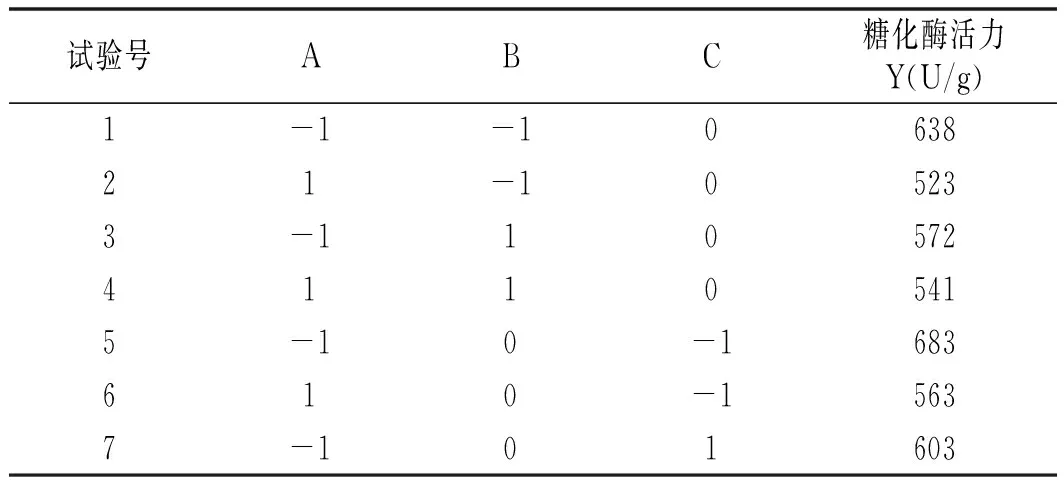
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken test
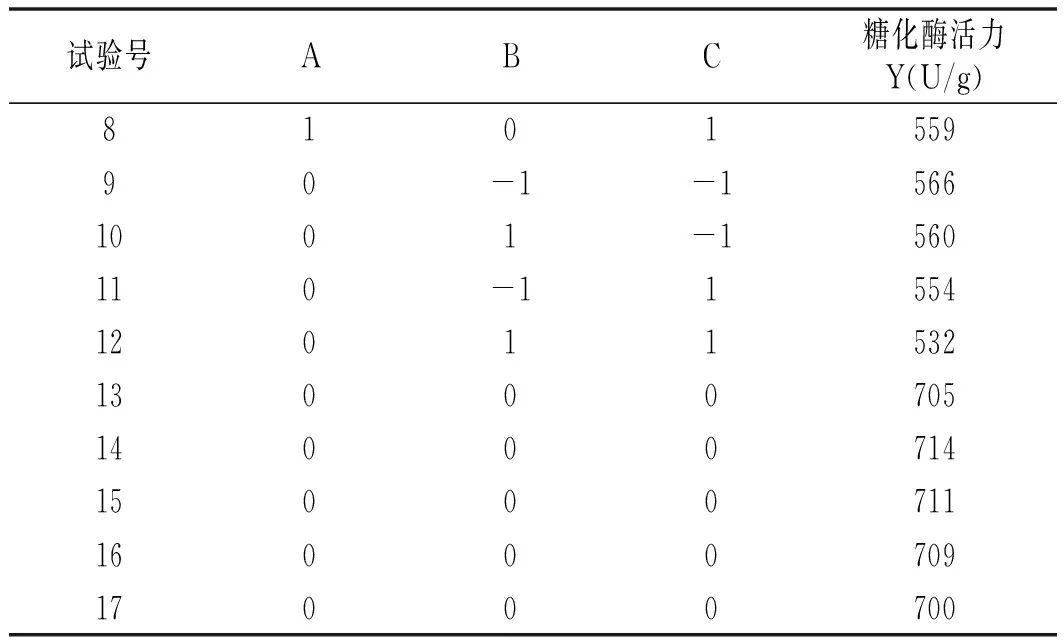
续 表
2.3.2 响应面试验方差分析
方差分析验证模型及其各参数的显著性情况见表3。
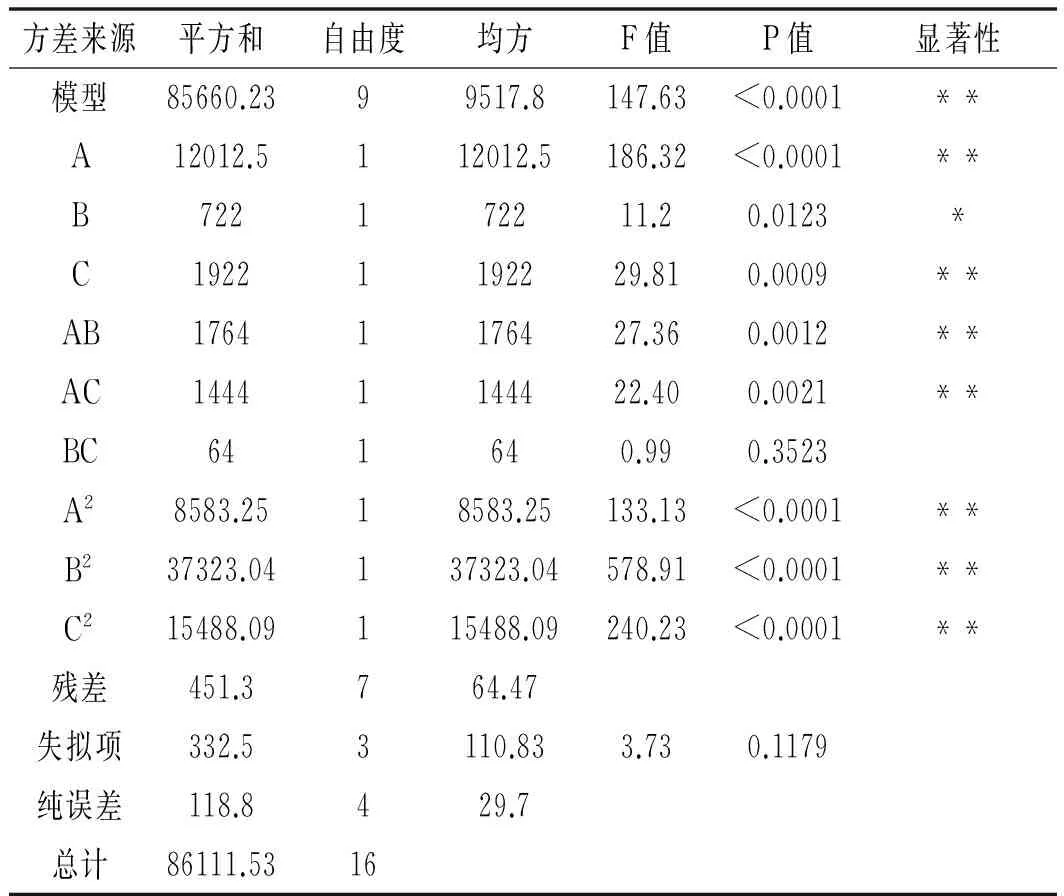
表3 回归模型方差分析结果Table 3 Variance analysis of regression equation
注:“*”表示影响显著(P<0.05);“**”表示影响极显著(P<0.01)。
运用Design-Expert 8.0.6软件对上述试验结果进行整理分析,通过回归拟合后,得到回归方程预测模型方程:
Y=707.8-38.75A-9.5B-15.5C+21AB+19AC-4BC-45.15A2-94.15B2-60.65C2。
由表3可知,模型P<0.0001,表明回归模型达到极显著水平,失拟项P=0.1179>0.05,不显著。模型的相关系数R2=0.9948,RAdj2=0.9880。模型信噪比为30.78,通常认为模型的可接受信噪比大于4,表明该回归模型拟合程度以及可信程度较高。响应值的变化有99.48%来源于所考察的变量因素,也就是制曲温度、湿度以及时间。故回归方程可以较好地描述各因素与响应值之间的真实关系,能够利用该回归模型方程确定最佳制曲条件。结合回归模型的方差分析看,A,C,AB,AC,A2,B2,C2为极显著性影响因素(P<0.01),B为显著性影响因素(P<0.05)。
2.3.3 响应面交互作用分析与优化
依据二次方程模型所得的试验因素间交互作用的三维立体响应曲面和等高线图,见图6~图8。
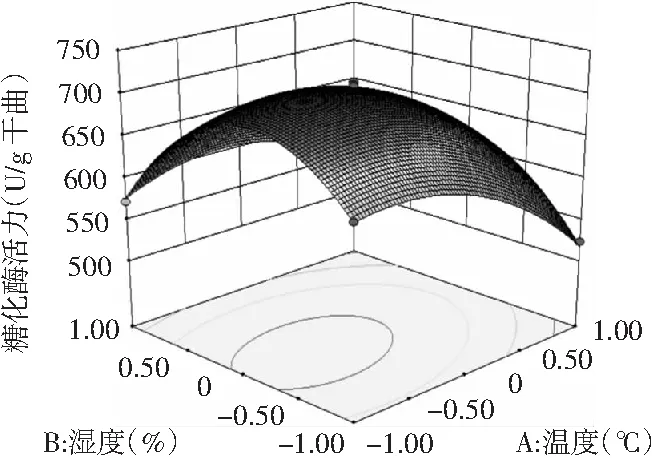
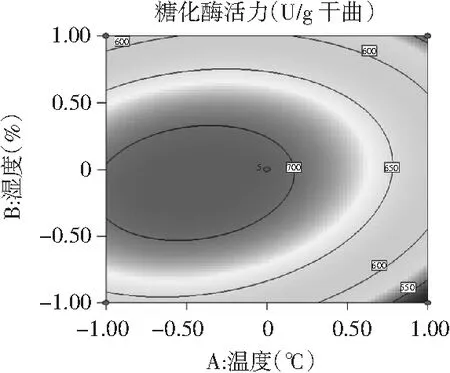
图6 温度与湿度交互作用影响糖化酶活力的响应面及等高线
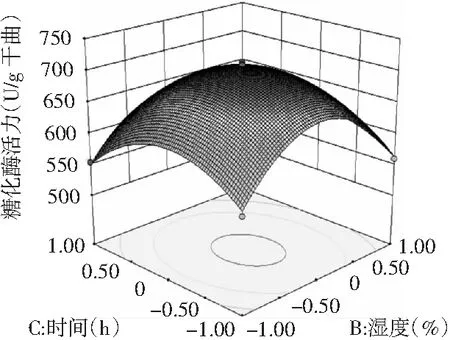
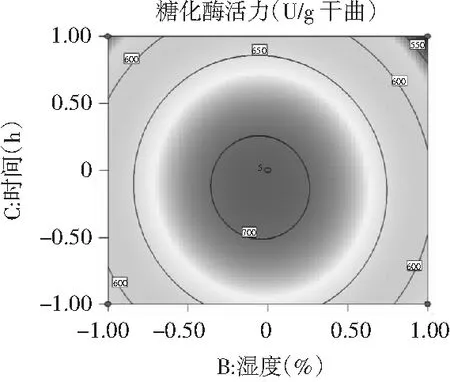
图7 时间与湿度交互作用影响糖化酶活力的响应面及等高线

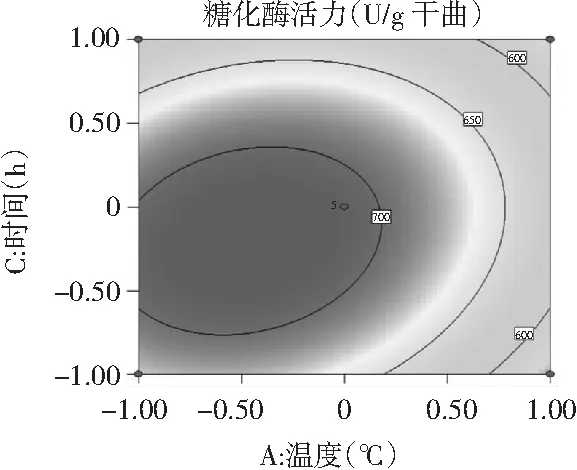
图8 时间与温度交互作用影响糖化酶活力的响应面及等高线
为了进一步分析相关变量间的交互作用以及确定最优点,通过等高线图能较为直观地分析出两因素的交互作用对试验指标的影响,椭圆形表示两因素交互作用显著,而圆形则表示两因素交互作用不显著[23]。由图6~图8可知,3个因素在所选择的范围内均存在响应极值,AB,AC交互作用显著,而BC交互作用不显著,结果与方差分析所得结果相一致。
对回归模型进行数学分析,该模型存在极大值点。当糖化酶活力达到最大估计值719.442 U/g干曲时,模型预测条件为:温度(A)31.01 ℃、湿度(B)89.49%、时间(C)57.57 h。
2.3.4 回归模型的验证
为了进一步验证回归模型的拟合程度以及回归方程的合适性与有效性,选取糖化酶活力最大响应值对应的响应因素进行验证试验,结合实际操作情况对响应因素值进行修正,温度(A)为31 ℃,湿度(B)为90%,时间(C)为57.5 h,平行试验3次,糖化酶活力为±717.42 U/g干曲,与预测结果(719.442 U/g干曲)相对偏差为0.28%。
3 结论
本研究从甜面酱中筛选出的霉菌经形态学初步鉴定为黑曲霉,并对其固态制曲条件进行了优化。在单因素试验的基础上,通过Box-Behnken试验获得其制曲的最优工艺条件为:温度31 ℃、湿度90%、时间57.5 h,在此条件下糖化酶活力达到±717.42 U/g干曲。通过Box-Behnken试验建立的回归模型拟合度较好,能够用来预测设定条件范围内的制曲工艺参数的响应值。
[1]黄明泉,王璐,孙宝国.甜面酱中非挥发性有机酸成分分析[J].食品科学,2013,34(18):123-130.
[2]付雯.多菌种耦合发酵甜面酱工艺研究[D].武汉:湖北工业大学,2011.
[3]张静,邓静,吴华昌,等.甜面酱保温发酵过程中酶活的变化规律[J].食品与发酵科技,2014(3):32-35.
[4]沈芳,吴华昌,邓静,等.四川甜面酱不同发酵工艺中的菌相分析[J].中国调味品,2013,38(6):41-45,54.
[5]周其洋,陶文沂.米曲霉多酶系优良菌株的诱变选育[J].中国调味品,2009,34(9):57-60.
[6]Sahnoun M,Jemli S,Trabelsi S,et al.AspergillusoryzaeS2 alpha-amylase domain C involvement in activity and specificity: in vivo proteolysis,molecular and docking studies[J].PLoS One,2016,11(4):e0153868.
[7]程会欣.不同米曲霉和黑曲霉菌株组合发酵酱油的研究[D].保定:河北大学,2010.
[8]李保英,姜佳丽,蒋予箭.酱油生产中应用米曲霉和黑曲霉混合制曲的探索[J].中国酿造,2011(12):70-74.
[9]金华勇.甜面酱发酵工艺试验研究[D].武汉:湖北工业大学,2009.
[10]付雯,李冬生,黄红霞,等.甜面酱双菌种制曲工艺条件的研究[J].中国调味品,2010,35(10):85-90.
[11]阚清华.酱油多菌种发酵关键技术研究[D].芜湖:安徽工程大学,2010.
[12]李云霞.小麦酱发酵菌相分析与人工发酵技术研究[D].武汉:武汉工业学院,2012.
[13]苏东林,张忠刚,谭欢,等.永丰辣酱人工接种双菌种制曲工艺的优化研究[J].食品工业科技,2009(6):159-163.
[14]颜守保.产耐酸性α-淀粉酶菌株的筛选、发酵条件及酶学性质研究[D].合肥:安徽农业大学,2007.
[15]孙海彦,黎娟华,赵平娟,等.一株生淀粉酶高产菌的选育[J].轻工科技,2012(9):19-20,23.
[16]张帅,陈懿,董基,等.黑曲霉固态发酵橘皮生产纤维素酶及淀粉酶[J].食品科学,2012(11):190-193.
[17]Kim K H,Brown K M,Harris P V,et al.A proteomics strategy to discover beta-glucosidases fromAspergillusfumigatuswith two-dimensional page in-gel activity assay and tandem mass spectrometry[J].J Proteome Res,2007,6(12):4749-4757.
[18]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:28-34.
[19]姚粟,李辉,程池.23株曲霉属菌种的形态学复核鉴定研究[J].食品与发酵工业,2006,32(12):37-43.
[20]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2014:618-619.
[21]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015(8):41-45.
[22]孟甜,黄韬睿,李玉锋.响应面法优化郫县豆瓣制曲工艺[J].食品科学,2014(15):193-197.
[23]Montgomery D C.Design and analysis of experiments[M].London:John Wiley and Sons Inc.,1991.
Separation of Aspergillus niger from Sweet Flour Paste and Optimization of the Koji-making Conditions
XIE Guang-jie1, YE Bi-xia2, ZUO Yong2*, ZHANG Jing2
(1.Sichuan Vocational College of Chemical Technology, Luzhou 646000, China;2.College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,China)
Aspergillusnigerseparated from sweet flour paste is primarily identified and then the koji-making conditions are optimized by Box-Behnken test. Based on single-factor experiments, koji-making temperature, humidity and time are chosen as the independent variables, and saccharifying enzyme activity is as the response variable. Subsequently, Box-Behnken design principle of response surface experiment is applied to establish a mathematical model with three factors-three levels design. As a result, the optimal koji-making conditions for sweet flour paste are determined as temperature of 31 ℃, humidity of 90% and time of 57.5 h. Under the optimal conditions, the saccharifying enzyme activity reaches up to 717.42 U/g.
sweet flour paste;Aspergillusniger;koji-making conditions;response surface experiment
2017-01-17 *通讯作者
四川省教育厅重大培育项目(15CZ0022);2015大学生创新创业训练计划项目(y2015011)
谢光杰(1980-),男,讲师,主要从事生物工程方面的研究; 左勇(1972-),男,教授,主要从事发酵食品方面的研究。
TS264.24
A
10.3969/j.issn.1000-9973.2017.07.017
1000-9973(2017)07-0076-06

