家禽活疫苗中禽白血病病毒污染检测方法比较
楚电峰,杜元钊,冯嫣芳,薄智勇,刘秋云,马洪芹,刘相娥
(青岛易邦生物工程有限公司,山东青岛 266114)
家禽活疫苗中禽白血病病毒污染检测方法比较
楚电峰,杜元钊,冯嫣芳,薄智勇,刘秋云,马洪芹,刘相娥
(青岛易邦生物工程有限公司,山东青岛 266114)
本研究对家禽活疫苗中禽白血病病毒的不同检测方法进行了对比,通过直接ELISA检测法、RT-PCR法、病毒分离法和SPF鸡抗体检测法,对不同来源的家禽活疫苗进行了禽白血病病毒污染的检测。通过进一步测序验证发现,直接ELISA检测法和RT-PCR检测法都可出现“假阳性”。试验结果表明,病毒分离法虽然结果准确,但是操作难度大、技术要求高,而SPF鸡抗体检测法既简单、准确,又能确切反映疫苗的纯净性,利于推广应用。
活疫苗;禽白血病病毒;检测方法;SPF鸡抗体检测法
禽白血病病毒(Avian leukosis virus,ALV)是禽反转录病毒科C型肿瘤病毒亚属的一种单股RNA病毒。不同鸟类可感染不同的ALV。ALV根据与宿主细胞特异性相关的囊膜蛋白抗原性不同,可分为A、B、C、D、E、F、G、H、I和J等10个亚群。鸡的ALV可分为外源性和内源性两大类。其中:A、B和 J亚群为鸡群感染的主要外源性ALV,而J亚群的致病性和传染性最强[1];E亚群属于内源性ALV,为非致病性或者致病性很弱的病毒[2]。外源性ALV可以形成完整的病毒颗粒,主要通过种鸡垂直传播,不会通过宿主细胞染色体传递。内源性ALV是指前病毒cDNA可整合进宿主细胞染色体基因组中,可通过染色体垂直传播的ALV。它可能只是基因组的不完全片断,不会产生传染性病毒,通常没有致病性或致病性很弱[3-4],但会干扰对禽白血病的鉴别诊断,尤其干扰RTPCR的检测[5-6]。种鸡群ALV净化在现阶段主要是净化外源性病毒,内源性ALV目前还无法彻底净化。检测鸡群有无ALV感染,目前主要是指有无外源性病毒感染。目前监测疫苗中外源性ALV感染的最常用的方法有细胞分离法[7]、SPF鸡抗体检测法[8],RT-PCR[9-10]、ELISA法[10-11]等。本研究对比了几种常见的检测方法,以期为一线检测人员提供一种能准确检测疫苗中外源ALV污染的方法,为广大养殖户选择纯净的疫苗提供参考。
1 材料与方法
1.1材料
1.1.1家禽活疫苗。收集目前市场上国产与进口家禽活疫苗,按家禽组织来源和尿囊液来源分组。家禽国产组织来源活疫苗为鸡传染性法氏囊活疫苗(B87株)、鸡传染性喉气管炎活疫苗(K317株);家禽国产尿囊液来源活疫苗为鸡新城疫活疫苗(La Sota株)、鸡传染性支气管炎活疫苗(H120株)、进口组织苗1、进口组织苗2、进口尿囊液苗3。以上疫苗均为1 000羽/瓶。
1.1.2主要试剂。IDEXX公司禽白血病抗原检测试剂盒(批号AJ944),购自北京爱德士元亨生物科技有限公司;Taq酶和dNTP等试剂,购自宝生物工程(大连)有限公司;引物和测序,由上海生工完成;DF-1细胞,购自ATCC(美国组织培养中心);新城疫阳性血清、鸡传染性法氏囊阳性血清,均购自中国兽医药品监察所。
1.2方法
1.2.1ELISA直接检测法。将组织来源疫苗和尿囊液来源疫苗(均为1 000羽/瓶)分别加入2 mL灭菌0.01 mol/L PBS稀释,则100 μL含有疫苗50羽份;以此为检测样本,采用IDEXX公司禽白血病抗原检测试剂盒,按试剂盒说明书要求进行ELISA检测。
1.2.2RT-PCR检测法
1.2.2.1样品处理。将组织来源疫苗和尿囊液来源疫苗(均为1 000羽/瓶)分别用2 mL灭菌0.01 mol/L PBS还原。
1.2.2.2RT-PCR检测。针对ALV不同亚群病毒共有的p27基因设计检测引物,扩增片段长度为348 bp。上游引物:5′-CACAAGACTGGCTGATACGGT-3′;下游引物:5′-GACGCCGTAATAGCAACCA-3′。
1.2.2.3核酸提取与凝胶电泳。按照Takara公司一步法(RT-PCR)试剂盒说明书操作要求,进行核酸提取与基因扩增,采用凝胶电泳鉴定。
1.2.3细胞培养分离病毒法
1.2.3.1疫苗处理接种。将鸡传染性法氏囊活疫苗(B87株)用不含血清的M-199培养基溶解,使最终为500羽份/2 mL,置2~8 ℃,10 000 g离心10 min;取上清2 mL与等量的鸡传染性法氏囊病病毒特异性血清混合,37 ℃作用60 min,接种CEF细胞;将鸡新城疫活疫苗(La Sota株)用不含血清的M199培养基溶解,使最终为200羽份/0.8 mL,2~8 ℃,10 000 g离心10 min,取上清2.0 mL与等量的鸡新城疫病毒特异性血清混匀,37 ℃作用60 min后,接种CEF细胞;将鸡传染性喉气管炎活疫苗(K317株)和鸡传染性支气管炎活疫苗(H120株)用不含血清的M-199培养基溶解,使终浓度为500羽份/2.0 mL,置2~8 ℃,10 000 g离心10 min;不中和(因K317和H120在CEF上不产生细胞病变),取上清2.0 mL接种CEF细胞。
1.2.3.2细胞培养的传代与处理。待细胞培养5~7 d后,按常规方法消化、收获细胞;将其中1/2细胞(P1),置于-70 ℃冰箱保存留作检验用,其余细胞分散到2个瓶中继续培养。培养5~7 d后,按同样方法收获细胞,置-70 ℃,留样(P2)。按同样方法培养收获第3代(P3)。对照组细胞按相同方法培养。将P1、P2、P3的细胞培养物(包含样品及所有对照组)反复冻融3次,置2~8 ℃,5 000 g离心3 min,取上清作为待检样品,利用IDEXX公司禽白血病抗原检测试剂盒进行p27检测。
1.2.4SPF鸡抗体检测法
1.2.4.1样品处理。取尿囊液类和组织类疫苗样品,每瓶样品加入5 mL无菌PBS溶解;同一样品取3瓶苗混合均匀作为待检样品,最终浓度为20羽份/0.1 mL。对进口组织苗1、进口组织苗2、进口尿囊液苗3,按照瓶签注明羽份稀释使其终浓度为20羽份/0.1 mL。
1.2.4.2免疫接种。接种适用本疫苗日龄的SPF鸡20只/组,每只鸡同时滴鼻、点眼各10羽份,肌肉注射100羽份,同时在另一隔离器中饲养同批SPF鸡20只作对照。首免21 d后,再以相同剂量和方法二免,第1次免疫后42 d采血。采用商品化的IDEXX禽白血病抗体检测试剂盒,检测ALVAB和ALV-J特异性抗体。
2 结果与分析
2.1ELISA直接检测法
通过IDEXX禽白血病抗原检测试剂盒,直接检测活疫苗中是否存在禽白血病抗原(表1)。
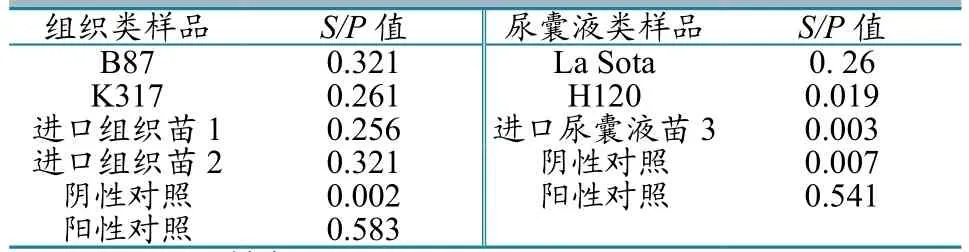
表1 ELISA直接检测活疫苗中禽白血病抗原S/P值
如表1所示,组织类疫苗组:鸡传染性法氏囊活疫苗B87株、鸡传染性喉气管炎活疫苗K317株以及进口组织苗1、2检测结果为阳性;尿囊液类疫苗组:新城疫活疫苗La Sota株检测为阳性,传染性支气管炎活疫苗H120株为阴性。有研究表明,不同检测材料对ELISA方法检测ALV-P27抗原的结果有较大的影响[12]。采用禽白血病ELISA抗原检测试剂盒,直接检测疫苗中的ALV,检测结果可能会显示较高的“假阳性”。实际上IDEXX公司禽白血病抗原检测试剂盒说明书已注明,该试剂盒仅适用于蛋清、泄殖腔拭子和血清样品中的ALV-p27的检测,ELISA直接检测法不适用于检测疫苗中ALV,尤其不适用于检测用鸡胚组织生产的疫苗样品。
2.2RT-PCR检测法
尿囊液类样品中:新城疫活疫苗La Sota株、鸡传染性支气管炎活疫苗H120株及阴性尿囊液检测结果为阴性(图1);所示组织类样品中:鸡传染性法氏囊活疫苗B87株、进口组织苗1和阴性组织样品均检测为阳性(图2)。
将阳性样品348 bp处条带回收测序,在GenBank上对比,结果见表2。
如上阳性样品均为内源性ALV的基因序列。由此可见,RT-PCR检测法不能准确区分内和外源性ALV,并且容易受到检测样品中非特异性物质的干扰,还会因实验室气溶胶污染,造成假阳性。因此,RT-PCR法不适合用于禽用活疫苗中的禽白血病的检测,尤其不适宜于检测组织类活疫苗,会呈现较高的假阳性。
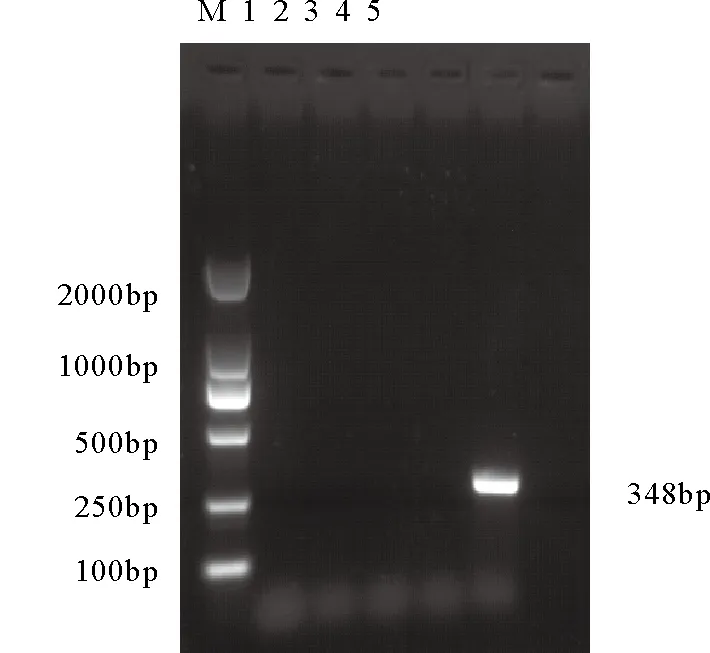
图1尿囊液类样品PCR检测ALV结果
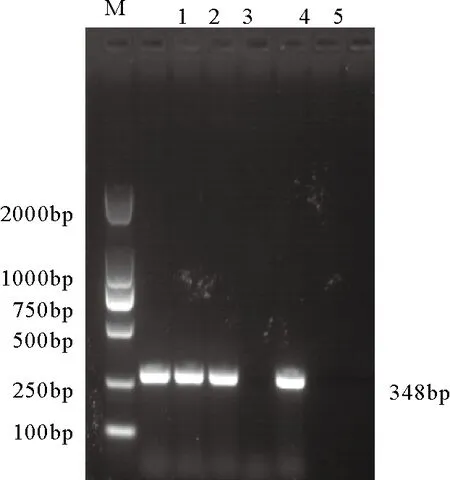
图2组织类样品PCR检测结果ALV检测ALV
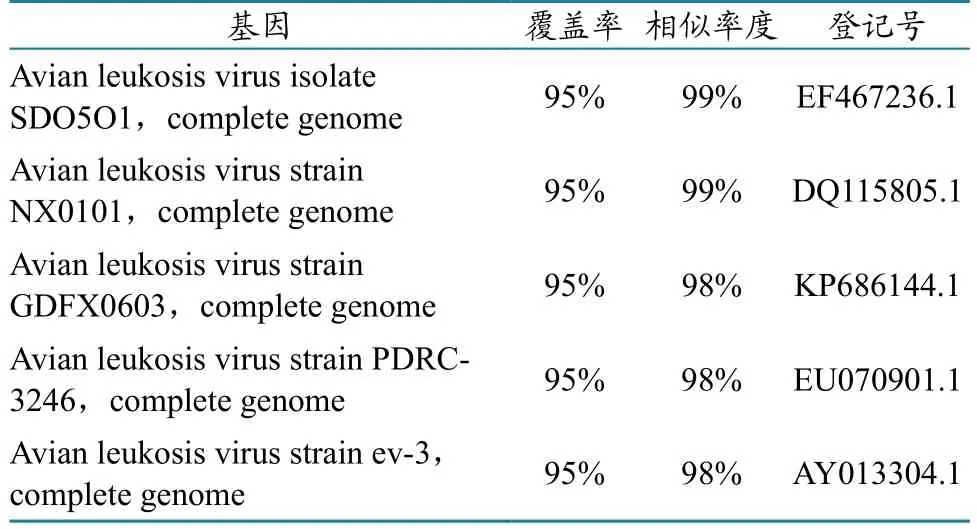
表2 PCR阳性样品测序比对
2.3细胞培养分离病毒法
利用IDEXX禽白血病毒抗原检测试剂盒,分别检测不同活疫苗样品经细胞培养3个代次分离的禽白血病抗原(表3)。
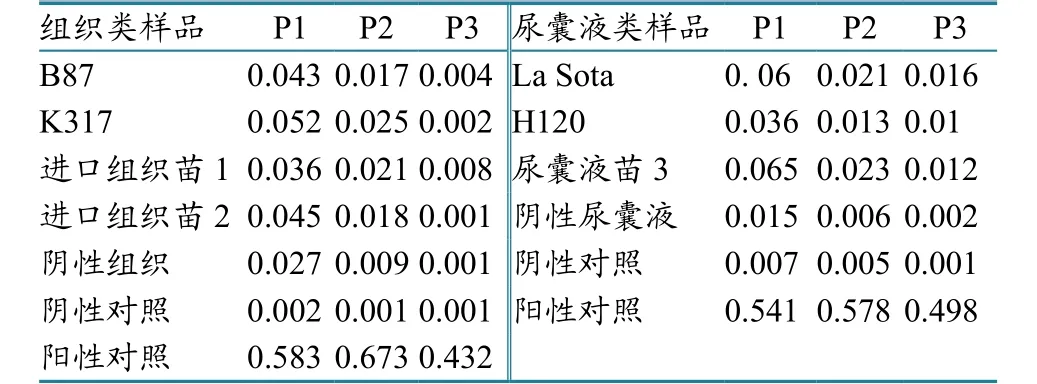
表3 ELISA直接检测活疫苗中禽白血病抗原S/P值
通过表3检测结果可知,不同疫苗样品组中均未检测到ALV。这种方法的优点是通过连续3代的细胞培养,能较准确检测出疫苗中是否污染了ALV。缺点是检测周期较长,检测单位需要具有-70 ℃超低温冰箱,而且能开展细胞检测工作;需具有中和效价较高的单特异性阳性血清,用于中和疫苗毒株,以免疫苗株在CEF上感染,产生细胞病变,不利于ALV的培养。
2.4SPF鸡抗体检测法
通过IDEXX公司禽白血病抗体检测试剂盒,检测不同疫苗样品免疫的20只SPF鸡血清抗体,结果见表4、表5。由表4可知,所有疫苗免疫组及对照组AB亚群抗体检测全部为阴性。由表5可知,所有疫苗免疫组及对照组J亚群抗体检测全部为阴性。
3 讨论
3.1ELISA直接检测法对结果影响
采用IDEXX禽白血病抗原检测试剂盒,直接检测家禽活疫苗中ALV,可能会出现假阳性的情况,尤其是组织活疫苗样品。该检测试剂盒采用的是双抗夹心ELISA检测法,而鸡胚组织类疫苗含有较多的蛋白成分,同时尿囊液疫苗中含有的其它赋形剂,如脱脂奶、蔗糖、明胶、海藻糖等保护剂成分,具有一定的粘滞性,在洗板时不易冲洗干净,这样在加入二抗时,会使二抗粘附于孔底,接触底物显色;在进行ELISA检测时,还会造成酶标抗体的非特异性吸附,使酶标抗体粘附于孔底,当接触底物时会显色,导致假阳性出现[13]。因此,随着抗体检测试剂盒检测假阳性的不断出现,确保试剂盒的准确性和可重复性对该方法的可靠性非常重要。

表4 ELISA检测免疫鸡抗体的S/P值(ALV-AB)

表5 ELISA检测免疫鸡抗体的S/P值(J亚群)
3.2RT-PCR法对检测结果影响
针对ALV不同亚群病毒共有的p27基因设计引物,采用RT-PCR法直接检测疫苗中的ALV,结果有时会出现阳性率较高的现象。究其原因,PCR仅对病毒的一段基因进行检测,不能区分内源性和外源性ALV,也不能区分死毒和活毒[14];因家禽组织的基因组中整合有ALV内源性基因片段,而鸡胚组织类疫苗是由鸡胚体组织经研磨生产的,组织成分比较复杂,干扰检测结果,所以很大程度上呈现“假阳性”结果,不能对疫苗的纯净性作出正确判断。只有对完整env基因进行测序鉴定,才能进一步确定检测样品是外源性ALV,还是内源性ALV污染。
同时某些细胞基因组中带有ALV-AB、J的gp85基因,单独扩增出gp85基因仍不能作为依据,同时需确保扩增到完整Env基因及其相连的3′-末端序列,并证明其3′-末端序列中的LTR也是外源性ALV特异性的,才有较大把握作出判断。目前,市场上的纠纷均是由于检测gp85基因测序后发现是ALV-J的gp85序列造成,针对env未曾出现问题。但要最终定论,还要靠分离到病毒,才更为可靠[15]。
3.3病毒分离法(细胞培养法)对检测结果影响
通过对样品的连续3代细胞培养,取培养后的样品,采用IDEXX公司禽白血病抗原检测试剂盒进行ALV的检测。若3代样品均为阴性,判定该批产品为阴性;若3代样品检测为阳性,并且检测数值呈上升趋势,判定该批产品为阳性;若3代样品中第1代为阳性,后2代为阴性,则判定为可疑,须作进一步鉴定。
对阳性或可疑样品进一步鉴定,可接种DF-1细胞(对E亚群ALV有抵抗力)培养,培养7 d为1代,收取细胞培养物标记为P1代,一部分放-70 ℃冰箱保存,一部分作为接种物,再接种DF-1细胞,继续培养7 d,作为P2代,依次类推培养至P3代;采用IDEXX公司禽白血病抗原检测试剂盒,对3代培养物进行检测,若有ALV污染,3代培养物检测的数值逐代升高;若3代均为阴性,则判定样品无外源ALV污染;若仅P1或P1、P2同为阳性,P2和P3或P3为阴性,但数值逐步下降,可将阳性样品再用DF-1重检1次,结果判定同上。此种方法能较准确地检测出疫苗中是否污染ALV。但此方法耗时太长,且对细胞培养的操作要求较高,可能造成人为操作污染,影响结果判定,不利于在基层普遍采用。
3.4抗体检测法对检测结果影响
将疫苗接种适宜日龄SPF鸡。这一方法操作简单结果可靠,也更具说服力,不会受到其它因素的干扰,是目前检测外源ALV污染最经典的检测方法[16]。但该方法试验周期较长,成本高,且需要具有SPF鸡的饲养条件,方可开展检测。
4 小结
综上所述,列举的4种检测方法外,还有其它检测方法,如IFA(需有特异性单克隆抗体)[17]、接种SPF鸡后临床诊断和组织病理学诊断(此法只有对ALV感染鸡临床症状和组织病理学有较丰富的经验,才可作出判断,不适宜大多数疫苗公司和养殖场采用)。上述检测方法中,在国内外被普遍认可的是SPF鸡抗体检测法。这种方法检测结果更为准确,但因由于时间周期较长、成本高,在基层没有被广泛采用,而以操作简便的ELISA和RT-PCR检测法取而代之,但检测结果却不能真实反映疫苗的纯净性。为了给广大养殖生产企业提供真正纯净疫苗,需要动物疫苗生产者和养殖企业认真对待禽白血病的检测,采用正确可靠的检测方法,排除一切ALV污染,只有这样才能为家禽养殖业的健康发展保驾护航。
[1] GAO Y L,YUN B L,QIN L T,et al. Molecular Characteristics of 3′ Untranslated Regions of Avian Leukosis Virus Subgroup J in Layer Flocks[J]. Chinese Journal of Animal & Veterinary Sciences,2012,43(11):1841-1846.
[2] SMITH E J,CRITTENDEN L B. Genetic cellular resistance to subgroup E avian leukosis virus in slow-feathering dams reduces congenital transmission of an endogenous retrovirus encoded at locus ev21[J]. Poultry Science,1988,67(12):1668-73.
[3] BIETH E,DARLIX J L. Characterization of a molecular clone of a highly infectious avian leukosis virus.[J]. C R AcadSci III. 1993,316(8):754-762.
[4] PAYNE L N. HPRS-103:A retro virus strikes back. The emergence of subgroup J avian leukosisvirus[J]. Avian Pathology,1998,27(S1):36-45.
[5] BIETH E,DARLIX J L. Complete nucleotide sequence of a highly infectious avian leukosis virus[J]. Nucleic Acids Research,1992,20(2):367.
[6] OCHI A,OCHIAI K,NAKAMURA S,et al. Molecular characteristics and pathogenicity of an avian leukosis virus isolated from avian neurofibrosarcoma[J]. Avian Diseases,2016,56(1):35.
[7] LANDMAN W J M,POST J,BOONSTRA-BLOM A G,et al. Effect of an in ovo infection with a Dutch avian leukosis virus subgroup J isolate on the growth and immunological performance of SPF broiler chickens[J]. Avian Pathology,2002,31(1):59-72.
[8] 黄向阳,蒋丽香. 中华人民共和国兽药典:2015年版(三部)[M]. 北京:中国农业出版社出版,2016:附录16.
[9] HÄUPTLI D,BRUCKNER L,OTTIGER H P. Use of reverse transcriptase polymerase chain reaction for detection of vaccine contamination by avian leukosis virus.[J]. Journal of Virological Methods,1997,66(1):71-81.
[10] DHANUTHA N R,REDDY M R,RAO S S L. Evidence of avian leukosis virus subgroup E and endogenous avian virus in Marek´s disease vaccines derived from chicken embryo fibroblasts[J]. International Journal of Animal & Veterinary Advances,2012,4(6):363-369.
[11] 胡晓苗,张丹俊,侯宏艳,等. 活毒疫苗中禽白血病病毒污染的检测方法探讨[J]. 安徽农业科学,2013(26):10669-10670.
[12] 沈学怀,张丹俊,潘孝成,等. 不同检测材料对ELISA检测禽白血病病毒-p27抗原结果的影响[J].中国畜牧兽医,2015,42(5):1294-1300.
[13] SMITH E J,FADLY A,OKAZAKI W. An enzymelinked immunosorbent assay for detecting avian leukosissarcoma viruses[J]. Avian Diseases,1979,23(3):698-707.
[14] 关云涛,李昌文,张立成,等. 应用PCR和琼脂扩散检测禽白血病病毒的比较[J]. 中国比较医学杂志,2002,12(5):306-308.
[15] 崔治中. 鸡白血病病毒及其综合防控措施[EB/OL].(2010-11-30)[2017-06-15]. http://topics.gmw.cn/2010-11/30/ content_1427250_4.htm.
[16] LI X,LI DQ,ZHAO P,et al. The ALV-A/B specific antibodies correlation between ELISA and IFA detection in chicken serum[J]. Chinese Journal of Virology,2012,28(6):615.
[17] 奚德华,梁有志,尹丽萍,等. 规模化种禽场禽白血病检测方法的比较及初步应用[J].中国家禽,2014,36(3):14-17.
(责任编辑:朱迪国)
Comparison of Diagnostic Methods of Avian Leukosis Virus Contamination in Live Poultry Vaccines
Chu Dianfeng,Du Yuanzhao,FengYanfang,Bo Zhiyong,Liu Qiuyun,Ma Hongqin,Liu Xiang´e
(Qingdao YEBIO Bioengineering Co.,Ltd.,Qingdao,Shandong 266114)
The comparative study of different detection methods for Avian leukosis virus in poultry live vaccine were carried out using direct ELISA method,RT-PCR method,virus isolation and SPF chicken antibody detection method. Avian leukosis virus contamination was detected in live poultry vaccines of different origins. By further sequencing,it was found that both the direct ELISA assay and the RT-PCR assay were “false positive”. The test results showed that although the virus separation method was accurate,it was diff i cult to operate and high technology should be required. The SPF chicken antibody detection method was simple and accurate. And the purity of the vaccine could be ref l ected,which was conducive to popularization and application.
live vaccines;Avian leukosis virus;diagnosis method;antibody test of SPF chicken
S855.3
A
1005-944X(2017)08-0108-06
10.3969/j.issn.1005-944X.2017.08.028
青岛市高新区科技计划(QGX-15-KJ2-05)
杜元钊

