一株副猪嗜血杆菌的分离鉴定及其遗传进化分析
赵子惠,成伟伟,陈伯祥,杨 明
(甘肃省畜牧兽医研究所,甘肃平凉 744000)
一株副猪嗜血杆菌的分离鉴定及其遗传进化分析
赵子惠,成伟伟,陈伯祥,杨 明
(甘肃省畜牧兽医研究所,甘肃平凉 744000)
为确认导致甘肃省平凉市一农场猪群死亡的原因,采集病死猪不同组织样品进行检测,从病死猪的脏器组织中分离到1株革兰阴性杆菌,并对其进行生化鉴定、16S rRNA鉴定及遗传进化分析,同时进行分离菌的致病性试验、耐药性分析、V因子需要试验、“卫星现象”观察。结果表明:分离菌生化特性均符合副猪嗜血杆菌;其16S rRNA基因序列与Genbank中副猪嗜血杆菌株的同源性均高达99%。因此,将该分离菌鉴定为副猪嗜血杆菌,将其命名为PL2016。动物试验及耐药性试验表明,该分离菌具有较强的致病性和多重耐药性。16S rRNA 遗传进化分析表明,该分离菌与副猪嗜血杆菌其他菌株具有很高的同源性,其核酸序列相似性高达99%以上。遗传进化分析表明,该分离菌的ompP2、sodA基因与副猪嗜血杆菌其他菌株具有很高的同源性,其核酸序列相似性高达95%以上。
副猪嗜血杆菌;分离;鉴定;药敏试验
副猪嗜血杆菌(Haemophilus parasuis,Hps)是巴氏杆菌科嗜血杆菌属的一种革兰阴性小杆菌,具有多种不同的形态,从单个的球杆菌到长的、细长的致丝状菌体,革兰染色阴性,主要导致保育期仔猪发生多发性纤维素性浆膜炎、关节炎和脑膜炎[1-3]。近年来,副猪嗜血杆菌引起的猪的疾病在世界范围内广泛流行,发病率及死亡率仍持续上升[4]。我国严格要求必须淘汰Hps感染动物,加之防治的高昂费用及其耐药性问题[5-7],该病已给我国的养猪业造成了巨大的经济损失,严重威胁了当前养猪业的发展[8]。
2016年10月,甘肃省平凉市某猪场的猪群临床表现为发热、呼吸困难、关节肿胀、跛行、皮肤及黏膜发绀、耳尖发紫,站立困难甚至瘫痪;剖检病变表现为多发性浆膜炎、关节炎、脑膜炎等,并导致20多头猪只死亡,损失惨重。本研究对采集的病料进行了病原分离鉴定,确定该疫情由Hps感染所引起。基于此,对分离菌株进行了药物敏感试验及16S rRNA基因、毒力基因的克隆和系统进化分析,以期为Hps感染的诊断和防治提供参考。
1 材料和方法
1.1病料
采自平凉市发病猪场病死猪的心、肝、脾、肺、肾等组织及关节液。
1.2培养基及试剂
麦康凯琼脂培养基、伊红美蓝琼脂培养基、TSA培养基、SS琼脂培养基,均购自青岛海博生物技术有限公司;细菌DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,均为OMEGA公司产品;2×PCR Mix,购自广州东盛生物科技有限公司;pMD19-T载体,为Takara公司产品;T4 DNA ligase,购自Thermo公司;DL5000 DNA Marker、DL2000 DNA Marker,均为北京康为世纪生物科技有限公司产品;药敏纸片,购自杭州滨和微生物试剂有限公司;生化试剂及其他试剂,均为国产分析纯产品。大肠杆菌DH5 α感受态细胞由本室保存。
1.3组织抹片镜检
无菌取病猪心脏、肺脏、脾脏等组织抹片,经革兰染色后镜检。并依此制备培养基进行细菌的分离鉴定。
1.4细菌的分离培养
在无菌条件下,取各组织病料,分别划线接种于营养琼脂平板、血平板(含NAD)、麦康凯琼脂平板、伊红美蓝琼脂平板及SS琼脂平板,TSA平板,置37 ℃培养24~48 h,观察菌落形态特征。挑选典型菌落进一步纯化,并取纯化菌经革兰染色后观察菌体形态及染色特征。
1.5V因子需要试验
将分离的细菌分别接种于TSA 平板和添加了NAD 的TSA 平板,于5%的CO2环境37 ℃条件下培养24~48 h,检查其生长特性及对V因子的需要性。
1.6“卫星现象”观察
取2个TSA 平板,分别接种所分离的细菌。在其中1个平皿的中心线位置,划线接种金黄色葡萄球菌,于5% CO2环境37 ℃条件下培养24~48 h。观察其是否在金黄色葡萄球菌周围长出“卫星现象”。
1.7生化试验
从TSA平板上挑取分离菌的单个菌落,接种于含NAD的葡萄糖、乳糖、蔗糖、麦芽糖、甘露醇、山梨醇、苯丙氨酸、赖氨酸,三糖铁,靛基质,M.R,V-P,枸橼酸盐,H2S、触酶及尿素酶等培养基中,按常规方法进行生化鉴定,37 ℃培养24 h后观察结果,并按Krieg等[9]所述的鉴定标准进行结果判定。
1.8药敏试验
参照刁菁等[10]所述方法进行药敏试验,步骤如下:将分离纯培养物无菌划线于TSA平板,静置5 min后,用无菌镊子取药敏纸片分别贴于培养基表面,置于5% CO237 ℃培养24 h后,测量各种药敏纸片的抑菌圈直径并判定结果。
1.9分离菌16S rRNA基因序列扩增及进化分析
参照Oliveira 等[12]的文献,根据Hps 16S rRNA(M75065)的基因序列设计引物,PCR扩增产物片段约为821 bp左右。引物由金唯智生物有限公司合成:Hps 16SF:5′-GTGATGAGGAAGGGTGGTGT-3′;Hps 16S R:5′-GGCTTCGTCACCCTCTGT-3′。反应体系为30 μL:上、下游引物各0.5 μL,分离菌基因组DNA 2 μL,2×PCR Mix 15 μL,ddH2O 12 μL。扩增条件为:95 ℃ 10 min,95 ℃ 50 s,55 ℃ 45 s,72 ℃45 s,30个循环后,72 ℃延伸10 min。PCR产物经琼脂糖凝胶回收并与pMD19-T载体在16 ℃温度条件下过夜连接后转化大肠杆菌DH5 α感受态细胞,应用蓝、白斑筛选并经PCR的进一步验证,阳性克隆送金唯智公司测序。将测序正确的分离菌株16S rRNA 核苷酸序列与GenBank 上其它Hps参考株16S rRNA 序列,用DNAStar 软件包中的MegAlign 软件进行核苷酸序列比对,分析核苷酸的同源性,构建系统进化树,分析其遗传进化关系,初步确定其血清型[13]。
1.10动物试验
动物试验分1个攻毒组和1个对照组,每组随机分取5只BALB/c小鼠。攻毒组每只腹腔注射0.3 mL过夜培养的分离菌菌液,对照组每只注射0.3 mL生理盐水,观察并记录小鼠发病和死亡情况,小鼠死亡后剖检观察病理变化,并取肺脏组织涂片染色镜检。
1.11细菌毒力基因扩增及进化树构建
参照GenBank Hps的两种毒力基因(sodA、ompP2)序列,设计并合成引物(表1)。分别扩增分离菌的相关毒力基因。反应体系为30 μL:上、下游引物各0.5 μL、基因组DNA 2 μL、2×PCR Mix 15 μL、ddH2O 12 μL。反应条件为:95 ℃ 5 min,95 ℃ 1 min,55 ℃ 45 s,72 ℃ 90 s,30个循环后,72 ℃延伸10 min。扩增产物经10 g/L琼脂糖凝胶电泳后回收,连接至pMD19-T载体并转化大肠杆菌DH5 α感受态细胞,阳性克隆送金维智公司测序。

表1毒力基因引物序列
2 结果
2.1细菌的分离培养
该菌涂片,经革兰染色,镜检,为革兰阴性小杆菌(图1)。该菌在含NAD的TSA平板上培养24~48 h,生长良好,形成针尖大小、圆形、半透明、光滑湿润的菌落,在巧克力培养基上长成较细小、半透明露珠样菌落;在普通琼脂和营养肉汤上培养24~48 h后,未见细菌生长;在含NAD 的血平板上培养24~48 h,可见有针尖大小、圆形、边缘整齐、灰白色半透明的小菌落生长,未见溶血现象。在普通琼脂平板、麦康凯培养基中均未见生长。

图1细菌革兰染色(1 000×)
2.2V 因子需要试验
副猪嗜血杆菌对营养要求较严格,生长需要血液中的生长因子,人工培养时必须供给V因子才能生长。在未添加NAD 的TSA平板上于5% CO237 ℃条件下培养24~48 h 未见细菌生长,而在添加NAD的TSA平板上生长良好,说明其生长需要V因子。
2.3“卫星现象”观察
在金黄色葡萄球菌两侧可见有针尖大小、圆形、边缘整齐的菌落生长,离金黄色葡萄球菌愈近菌落生长越好,愈远菌落越小,呈现出明显的“卫星现象”(图2);而在未接种金黄色葡萄球菌的另外一个平板则不见细菌生长。
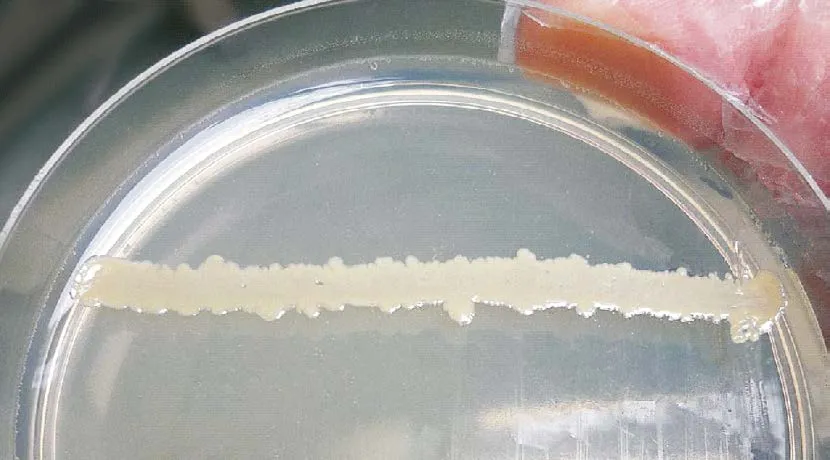
图2卫星现象
2.4生化试验
试验结果与Hps生化特征一致(表2),因此初步判定该菌为Hps。
2.516S rRNA鉴定
16SrRNA基因扩增结果显示,其PCR扩增产物约为821 bp(图3)。测序结果表明,该菌16S rRNA基因序列与Hps 16S rRNA基因序列的同源性为99%,因此确定分离菌为Hps。

表2细菌生化试验结果
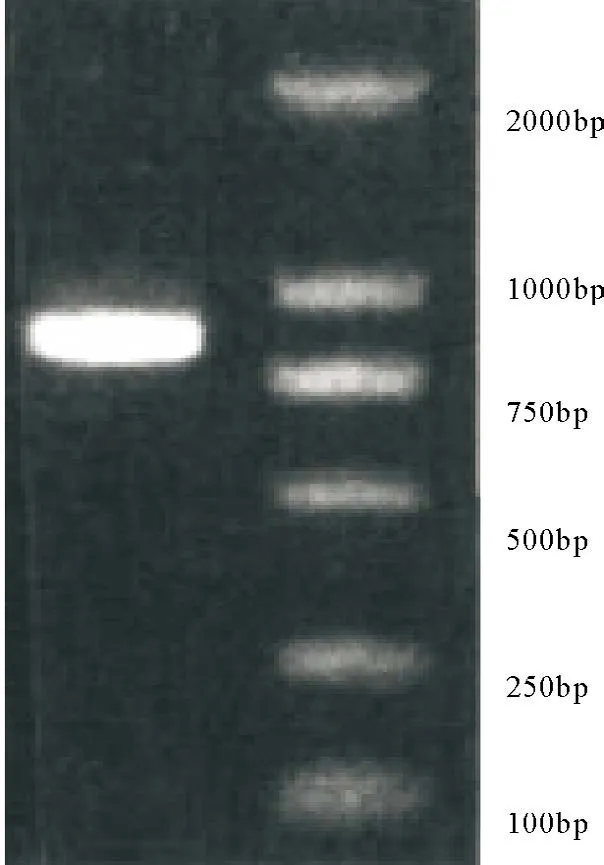
图3 16S rRNA基因PCR扩增
2.6动物试验
动物接种试验结果表明,接种分离菌的试验组小白鼠均在接种4 h出现精神沉郁、被毛逆立、站立不稳、呼吸急促等临床症状,24 h内5只小白鼠全部死亡;肺脏点状出血,肝脏肿大,并再次从病死小白鼠肺脏分离到相同细菌,而对照组小鼠均未见任何异常变化,表明该细菌对小白鼠具有较强的致病性。
2.7药敏试验
在所选择的18种常用抗生素中,分离菌对链霉素、妥布霉素、左氟沙星、苯唑西林、哌拉西林、头孢哌酮氯霉素、红霉素、卡那霉素高度敏感,对庆大霉素、诺氟沙星、多粘菌素B等中度敏感,而对磺胺甲唑、氨曲南等其余几种抗生素耐受(表3)。
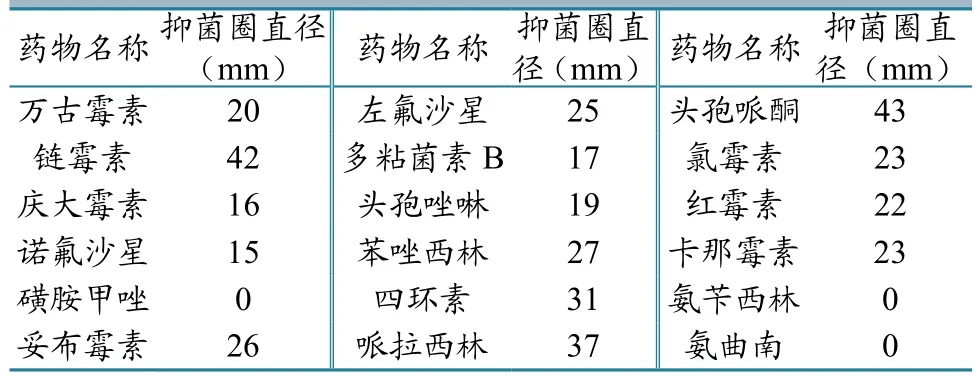
表3药敏试验结果
2.8Hps分离株16S rRNA基因的遗传进化分析
将PL2016分离株16S rRNA基因核苷酸序列与GenBank中公布的其它Hps参考株序列,利用DNAStar软件进行遗传进化分析。由图4可知,Hps分离株及其它Hps参考株位于进化树的两个不同分支上,属于两个不同的亚群。其中,分离株PL2016 株16S rRNA与3株血清5型Hps参考株AB078972、AB078973、AB078974的16S rRNA序列位于一个分支上,属于一个亚群,它们之间的核苷酸同源性在99.0%~99.4%之间。

图416S rRNA基因系统进化树
2.9毒力基因及进化树构建
两种毒力基因sodA、ompP2均被成功扩增(图5)。
2.9.1sodA基因的遗传进化分析。对分离菌sodA基因的PCR扩增产物进行测序,并将其序列与其他Hps菌株的sodA基因序列进行遗传进化分析,结果显示分离菌株与其他所有菌株同源性相对较高(图6)。
2.9.2ompP2基因的遗传进化分析。对分离菌ompP2基因PCR扩增产物测序及遗传进化分析结果表明,分离菌与其他Hps株分属两个不同的亚群(图7),但分离菌与其他菌株的ompP2基因同源性较近。

图5毒力基因PCR扩增
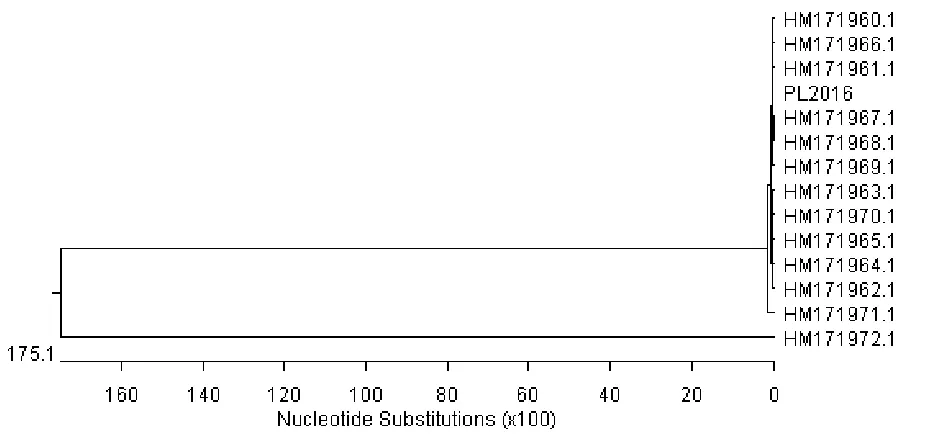
图6 sodA基因系统进化树
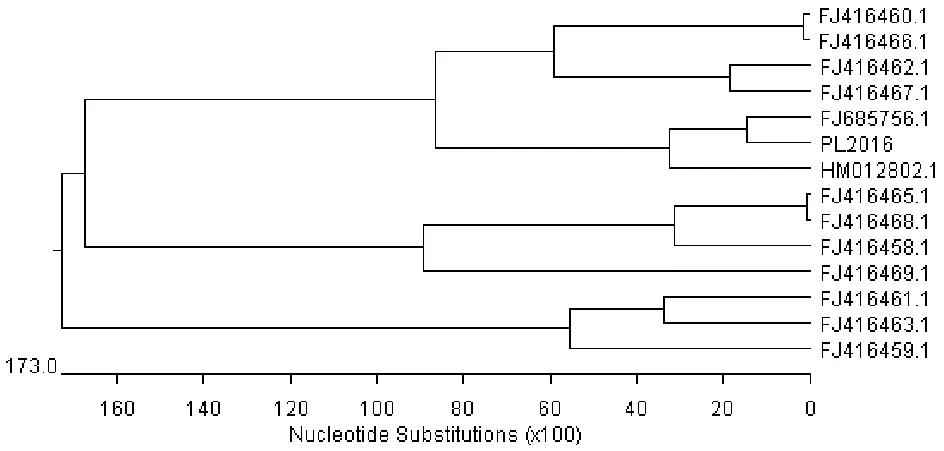
图7ompP2基因系统进化树
3 讨论
Hps在健康猪群的呼吸道中常在,在饲养环境恶劣、机体免疫力低下等特定条件下,Hps可导致猪群发病,多发于秋冬季节[14]。近年来,国内外由Hps引起疾病的报道较多。该菌的临床分离株多数具有多重耐药和强致病性,从而导致临床治疗困难加大。本研究对引起平凉市某猪场猪只发病死亡的病原菌进行了分离鉴定,从肺脏中分离到1株革兰阴性的多态性的细菌。通过对其进行生化试验鉴定、16S rRNA鉴定及序列分析、V因子需要试验、“卫星现象”观察,最终确定分离菌为Hps。
基于16S rRNA序列分析的细菌鉴定,为细菌的快速鉴定和其所致疾病的快速诊断提供了新的手段。本试验从分离菌基因组扩增出约821 bp的16S rRNA基因,对分离菌的16S rRNA基因序列分析结果表明该菌与副猪嗜血杆菌的同源性达到了99%,进一步确证了分离菌为Hps。由此可见,应用传统的生化试验鉴定细菌法,并结合16S rRNA鉴定方法,所得结果更为确切。
动物感染试验中,接种了分离菌菌悬液的试验组小白鼠均在24 h内死亡,且死亡小鼠各脏器病变明显,表明分离菌致病性强,但其毒力的确定有待进一步完成。此外,药敏试验结果显示,分离菌耐药谱广泛,兽医临床常用的多种抗菌药物对其均无明显的作用,这就是临床病例的治疗过程中应用多种抗菌药物均未有效控制疫情的主要原因,这也可能与该猪场在饲养过程中抗菌药物的使用不当有关。
本研究分离株PL2016株16S rRNA与其它Hps参考株16S rRNA的遗传进化关系,表明分离株PL2016株16S rRNA与3株血清5型Hps 参考株AB078972、AB078973、AB078974的16S rRNA序列位于一个分支上,属于一个亚群,它们之间的核苷酸同源性在99.0%~99.5%之间。
在两个毒力基因中,ompP2编码外膜蛋白,sodA编码的金属镁依赖的超氧化物歧化酶蛋白是一种防御蛋白,可以使细胞抵御氧化应激,及时修复受损细胞。对于一些具有侵袭性的细菌病原来说,超氧化物歧化酶在致病过程中非常重要,两种毒力基因的遗传进化分析结果显示分离菌株与其他Hps菌株具有很高同源性,且非常保守,说明这两个基因在Hps生长繁殖和致病过程中有着非常重要的作用。
本研究采集临床病料,通过细菌的分离鉴定及药物敏感试验,为分离菌株所致疾病的临床治疗提供了参考。通过16S rRNA基因的扩增及其遗传进化分析,为Hps分子流行病学的分析提供了依据,也为研究该菌的致病机制奠定了一定的基础。
[1] AMANO H,SHIBATA M,KAJIO N,et al. Pathologic observations of pigs intranasally inoculated with serovar 4 and 5 of Haemophius parasuis using immunoperxidase method [J]. Journal of Veterinary Medical Science,1994,56(4):639-644.
[2] WIEGAND M,KIELSTIN P,POHLE D,et al. Examination of primary SPF swine after experimental infection with Haemophius parasuis and in the parameters of the cerebrospinal fl uid [J]. TierarztlPrax,1997,25(3):226-232.
[3] VAHLE J L,HAYHES J S,ANDREWS J J. Experimental reproduction of Haemophilus parasuis infection in swine:clinical,bacteriological,and morphological fi nding [J]. J Vet Diagn Invest,1995,7(4):476-480.
[4] 斯特劳,阿莱尔,蒙加林,等. 猪病学[M]. 8 版. 赵德明,张中秋,沈建中,译. 北京:中国农业大学出版社,2000.
[5] 蔡旭旺,刘正飞,陈焕春,等. 副猪嗜血杆菌的分离培养和血清型鉴定[J]. 华中农业大学学报,2005,24(1):55-58.
[6] 李鹏,李军星,李玉峰,等. 中国东南部地区副猪嗜血杆菌分离株ERIC-PCR 指纹图谱分析[J]. 中国兽医学报,2009,29(12):1566-1570.
[7] 李雪松,陈欣,符芳,等. 副猪嗜血杆菌黑龙江株的分离与鉴定[J]. 中国预防兽医学报,2011,33(3):236-238.
[8] OLVERA A,CERDÀ-CUÉLLAR M,NOFRARIAS M,et al. Dynamics of Haemophilus parasuis genotypes in a farm recovered from an outbreak of Glässer′s disease[J]. Vet Microbiol,2007,123 (1/2/3):230-237.
[9] KRIEG N R,HOLT J G. Bergey′s manual of systermatic bacteriology:volume 1[M]. Bltimore:Williams & Wilkins,1984.
[10] 刁菁,杨秀生,李天保,等. 病原微生物药敏检测方法的研究进展[J]. 中国农学通报,2013,29(8):1-5.
[11] OLIVEIRA S,GALINA L,PIJOAN C. Development of a PCR test to diagnose Haemophius parasuis infections. J Vet Diagn Invest,2001,13 :495-501.
[12] 李曦婷,王超,薛彦杰,等. 一例副猪嗜血杆菌的分离鉴定及16S rRNA生物信息学分析[J]. 沈阳农业大学学报,2016,35(5):438-444.
[13] 刘沛杰,丁勇,郭秀丽. 副猪嗜血杆菌病的流行特点及防控[J]. 养殖与饲料,2017,39(6):50 -52.
(责任编辑:朱迪国)
Isolation,Identif i cation and Genetic Evolution Analysis on a Strain of Swine Haemophilus parasuis
Zhao Zihui,Cheng Weiwei,Chen Boxiang,Yang Ming
(Gansu Institute of Animal and Veterinary Science,Pingliang,Gansu 744000)
In order to confirm the pathogenic bacteria which caused the death of swine that came from a farm of Pingliang city of Gansu province,the different tissues samples from dead swine were collected and one gram-negative,rod-shaped bacterium was isolated from viscera tissue of dead swine. Biochemical identification,16S rRNA gene sequence analysis,pathogenicity test,drug resistance analysis,V factor test and satellite phenomenon observation were carried out. The results demonstrated that all biochemical characteristics of the isolate were consistent with Haemophilus parasuis,and the 16S rRNA sequence of the isolate shared 99% homology with most Haemophilus parasuis from Genbank. Therefore,the isolate was finally identified as Haemophilus parasuis,and it was named as PL2016. Animal test and drug sensitivity test indicated that the Haemophilus parasuis strain PL2016 has stronger pathogenicity and multiple drug resistance. The genetic evolution analysis showed that the homology of 16S rRNA gene from the strain PL2016 and the other strains of Haemophilus parasuis were higher,it´s similarity of nucleotide sequence was over 99%. The genetic evolution analysis showed that the ompP2 and sodA genes from the strain PL2016 and the other strains of Haemophilus parasuis were higher homology at nucleotide level with over 95% identities.
Haemophilus parasuis;isolation;identif i cation;drug sensitivity test
S851.3
A
1005-944X(2017)08-0092-06
10.3969/j.issn.1005-944X.2017.08.024
甘肃省省级科技计划项目(GNSW-2007-14)

