塞尼卡谷病毒重组酶聚合酶扩增技术(RPA)实时荧光检测方法的建立
樊晓旭,哈登楚日亚,2,王英丽,王 姣,刘春菊,迟田英,赵永刚,张志诚,吴晓东,王志亮
(1. 中国动物卫生与流行病学中心,国家外来病研究中心,山东青岛 266032;2. 内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;3. 常州市动物疫病预防控制中心,江苏常州 213002)
塞尼卡谷病毒重组酶聚合酶扩增技术(RPA)实时荧光检测方法的建立
樊晓旭1,哈登楚日亚1,2,王英丽1,王 姣3,刘春菊1,迟田英1,赵永刚1,张志诚1,吴晓东1,王志亮1
(1. 中国动物卫生与流行病学中心,国家外来病研究中心,山东青岛 266032;2. 内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;3. 常州市动物疫病预防控制中心,江苏常州 213002)
塞尼卡谷病毒(Seneca valley virus,SVV)可感染猪,引起类似口蹄疫病毒感染造成的水疱性病变,新生仔猪病死率达30%~70%。本研究利用重组酶聚合酶扩增技术(RPA),针对SVV 3D基因设计了引物和探针,并进行筛选、反应条件优化以及敏感性、特异性和重复性试验,建立了实时荧光RPA方法。结果显示,本方法在40 ℃、10 min内检测的最低浓度为28拷贝/µL;与口蹄疫病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒无交叉反应;通过3次重复试验检测2.8×106~2.8×101拷贝/μL的6个稀释度样品,在荧光强度达1 500 mV所需时间变异系数范围在2.44%~14.95%。该等温、快速扩增方法为猪群出现水疱性疾病的鉴别诊断提供了技术支持,对及时采取适当防控措施具有重要意义。
塞尼卡谷病毒;实时;荧光;重组酶聚合酶扩增
塞尼卡谷病毒(Seneca Valley virus,SVV),又称为Senecavirus A(SVA),是猪原发性疱疹病(Swine idiopathic vesicular disease,SIVD)的主要病原。SVV感染猪群后,尽管不会造成与口蹄疫病毒相同的较大政治、经济损失,但所引起的水疱性病变,与口蹄疫、猪水泡病、水泡性口炎、猪水疱疹等造成的病变相似,给临床鉴别诊断造成了一定的困难[1]。目前,北美、南美地区以及澳大利亚都有猪群发生SIVD的报道[2]。我国于2016年也首次分离到了SVV[3]。目前,国内外已经开发了RT-PCR、荧光定量PCR、ELISA等SVV实验室诊断方法,但上述方法操作繁琐,需依赖昂贵的仪器,且耗时较长(2 h以上)[4-5]。本研究采用的重组酶聚合酶等温扩增技术(Recombinase polymerase amplif i cation,RPA)是近年来出现的恒温、核酸快速扩增技术,已广泛用于病毒、细菌、寄生虫诊断研究[6]。在扩增反应中,重组酶首先与上下游引物结合,寻找、定位同源的双链DNA,进行链交换;聚合酶从上下游引物的3´端启动模板合成,形成两条双链DNA。该方法在37~42 ℃,10~30 min,对核酸进行特异性扩增,最低可检测1~1 000个拷贝的DNA或RNA分子。RPA结果读取方式多样,可采用琼脂糖凝胶电泳、实时荧光、侧流层析试纸条的方式,如已成功建立了犬细小病毒2型RPA琼脂糖凝胶电泳检测方法、中东呼吸综合征冠状病毒RPA实时荧光方法、贾第鞭毛虫RPA侧流层析试纸条检测方法[7-9]。目前国际上尚无采用实时荧光RPA检测SVV的报道。本研究建立了实时荧光RPA检测方法,为SVV快速诊断及防控提供了技术参考。
1 材料与方法
1.1毒株及核酸
口蹄疫病毒O型缅甸98株(FMDV)cDNA、猪繁殖与呼吸综合征病毒(PRRSV) CH-1R株cDNA、猪瘟病毒C株(CSFV)cDNA、猪流行性腹泻病毒(PEDV)CV777株和猪传染性胃肠炎病毒华毒株(TGEV)cDNA,由本实验室保存。
1.2实时荧光RPA标准品的制备
根据NCBI中登录的SVV全基因序列(NC_011349.1),合成基因共7.31 kb。全基因由上海生工生物工程技术服务有限公司合成。选择BamH I和EcoR I酶切位点,将目的基因克隆于pUC19载体中构建重组质粒pUC19-SVV,载体为pUC19,重组质粒浓度为300 ng/μL,约为2.8×1010拷贝数,作为实时荧光RPA标准品。
1.3主要仪器和试剂
实时荧光RPA监测仪器TwistaTM,购自TwistDX公司;2×Probe qPCR Mix试剂盒,购自Takara公司;Twist Amp exo试剂盒,购自TwistDX公司。
1.4引物和探针设计
根据NCBI中登录的SVV 3D基因序列(NC_011349.1),分别使用Primer 5.0软件设计3组引物和探针,分别为:组合1(P-1),包括F1、R1、Pb1;组合2(P-2),包括F2、R2a、Pb2;组合3(P-3),包括F2、R2b、Pb2(表1)。将探针和引物进一步通过NCBI的BLAST进行序列比对分析,比较设计的探针和引物序列与主要猪病病毒(FMDV、CSFV、PRRSV、PEDV、TGEV)的序列匹配度,确定引物和探针的特异性,由上海生工生物工程技术服务有限公司合成。
1.5实时荧光RPA反应条件的优化
在pUC19-SVV质粒模板浓度为10-3ng的条件下,按照Twist Amp exo试剂盒说明书,在50 μL反应体系中,在预添加exo酶的PCR反应管中加入Rehydration Buffer 29.5 μL,ddH2O 8.2 μL,10 μmol/L上游引物(F)2.1 μL,10 μmol/L下游引物(R)2.1 μL,10 μmol/L探针(P)0.6 μL,DNA模板5 μL,Mg2+2.5 μL;将PCR管放入实时荧光RPA监测仪器TwistaTM,设定反应温度和时间;在温度为35、37、39、40、42 ℃下反应15 min,进行实时荧光RPA反应,检测荧光强度。
1.6荧光定量PCR反应
采用Probe qPCR Mix试剂盒,使用前期研究报道的引物探针[5],在20 μL的反应体系中,2×qPCR Mix 10 μL,上下游引物0.8 μL,探针0.4 μL,cDNA模板2 μL,加水补齐至20 μL,进行荧光定量PCR反应。反应条件为95 ℃ 2 min;94 ℃15 s、60 ℃ 1 min,共40个循环。将pUC19-SVV质粒标准品10倍倍比稀释(2.8×106~2.8×100拷贝/μL)进行荧光定量PCR检测,测定CT值。
1.7特异性试验
应用1.5中所筛选的最优反应体系,以FMDV、CSFV、PRRSV、PEDV、TGEV的cDNA作为模板,利用最佳反应条件进行实时荧光RPA检测,评价该方法的特异性。
1.8敏感性试验
应用1.5中所筛选的最优反应体系,并参照方法1.6,将pUC19-SVV质粒标准品按10倍倍比稀释至7个浓度(2.8×106~2.8×100拷贝/μL),分别作为模板,以最佳反应条件进行检测,确定该方法的最小检出量。测定荧光强度超过1 500 mV时所需的时间,同时进行实时荧光PCR反应,比较两种检测方法的敏感性。
1.9重复性试验
应用1.5中所筛选的最优反应体系,对2.8×106、2.8×105、2.8×104、2.8×103、2.8×102、2.8×101、2.8×100拷贝/μL,共7个稀释梯度的pUC19-SVV质粒标准品做3批重复检测,并以ddH2O作为阴性对照,确定检测方法的重复效果。
1.10统计分析
采用SPSS 18.0进行数据的统计分析,计量资料以“均数±标准差”表示;组间计量资料的比较采用t检验,P<0.05为差异有统计学意义。

表1引物和探针
2 结果
2.1引物筛选
本研究设计了3组引物探针组合,通过NCBI的BLAST,并与主要猪病病毒(FMDV、CSFV、PRRSV、PEDV、TGEV)序列比对分析,确定其特异性良好。在39 ℃下,使用组合1、2、3,对2.8×102拷贝/μL样品进行RPA扩增。结果显示,组合1、3样品相比阴性对照,随时间推移荧光强度逐渐升高(图1-A),其中组合3荧光强度可达3 000 mV以上,高于组合1和2,差异极显著(P<0.0001)(图1-B)。此外,组合3达到1 500 mV所需时间显著小于组合1,而组合2荧光强度未达到1 500 mV(图1-C)。因此,选择组合3引物探针用于后续方法的研究。
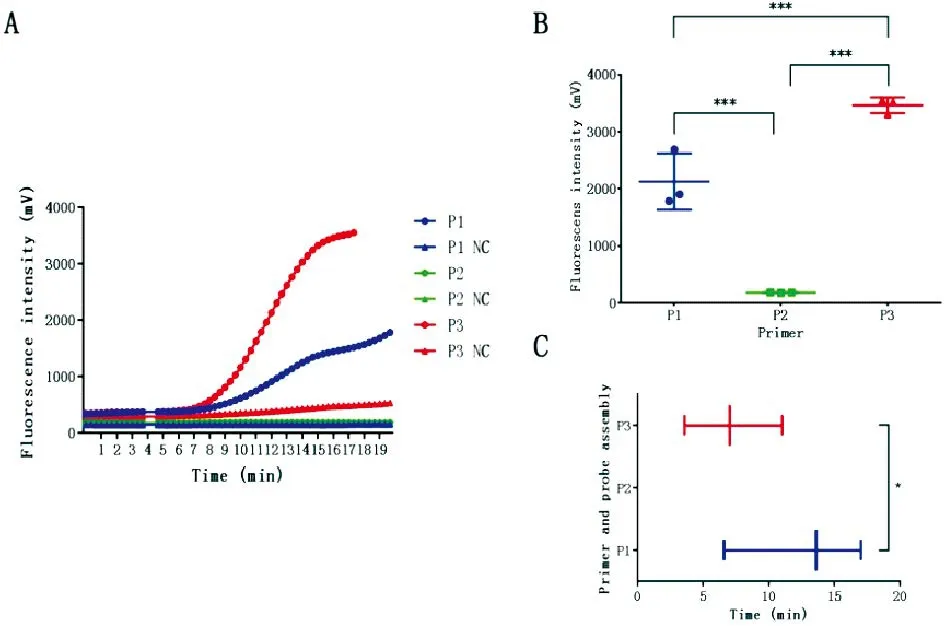
图1 SSV RPA引物探针组合筛选
2.2实时荧光RPA反应条件优化
为了筛选反应最佳温度和最适时间,特选取35、37、39、40、42 ℃下,最长反应15 min,检测浓度为2.8×103拷贝/μL样品的RPA扩增情况。结果显示,反应温度越高,随着反应时间的推移荧光强度上升越快,温度为40 ℃和42 ℃时,在6 min内荧光强度即超过1 000 mV。而在3次重复实验中,40 ℃的重复性好于42 ℃(图2)。因此本研究选择40 ℃为本方法的工作温度。
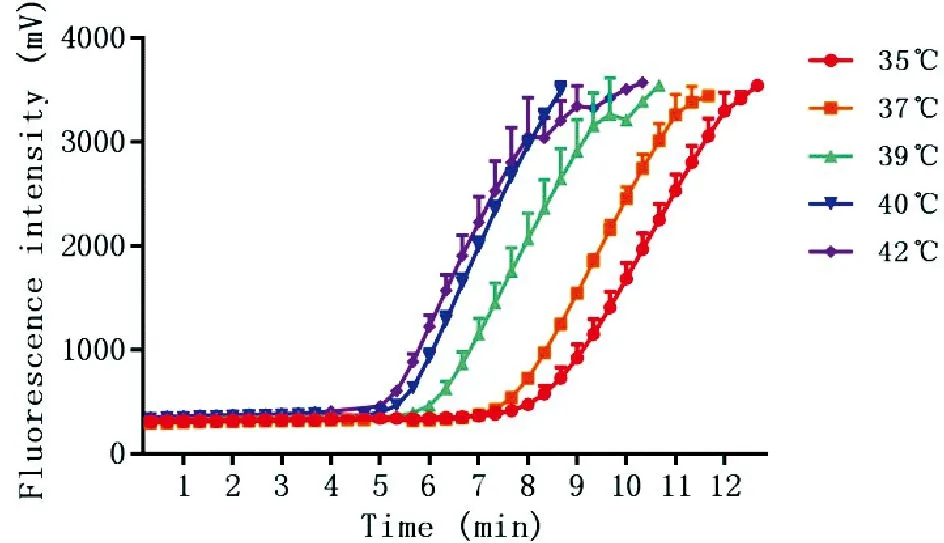
图2不同温度条件下RPA反应
在40 ℃的条件下,利用组合3引物探针,将拷贝数为2.8×106~2.8×100拷贝/μL的7个稀释度标准品和ddH2O,作为阴性对照扩增20 min,结果显示,扩增10 min时,浓度为28个拷贝/μL样品的测定结果为阳性。当扩增20 min时,2.8 拷贝/μL样品荧光强度值缓慢提升到1 000 mV。阴性对照从实验开始至结束一直未出现明显扩增。因此,本实验选择10 min作为扩增设定时间,检出限为28个拷贝/μL(图3)。
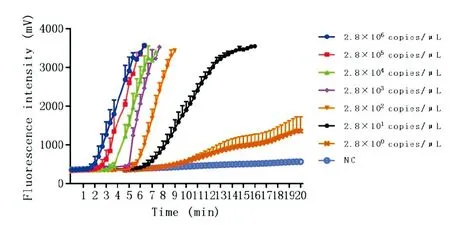
图3不同浓度质粒标准品RPA反应时间
2.3特异性试验
为了确定RPA方法的特异性,选取浓度为2.8×105、2.8×101拷贝/μL SVV阳性标准品以及FMDV、CSFV、PRRSV、PEDV、TGEV的cDNA进行反应,cDNA浓度均为10 ng/μL,用量为5 μL。结果表明,随着反应时间的推移,反应10 min后,SVV阳性标准品荧光强度明显升高,相比之下,其他病毒阳性cDNA测得的荧光强度无明显升高变化,说明本方法可以特异性扩增SVV核酸,可用于SVV的检测(图4)。
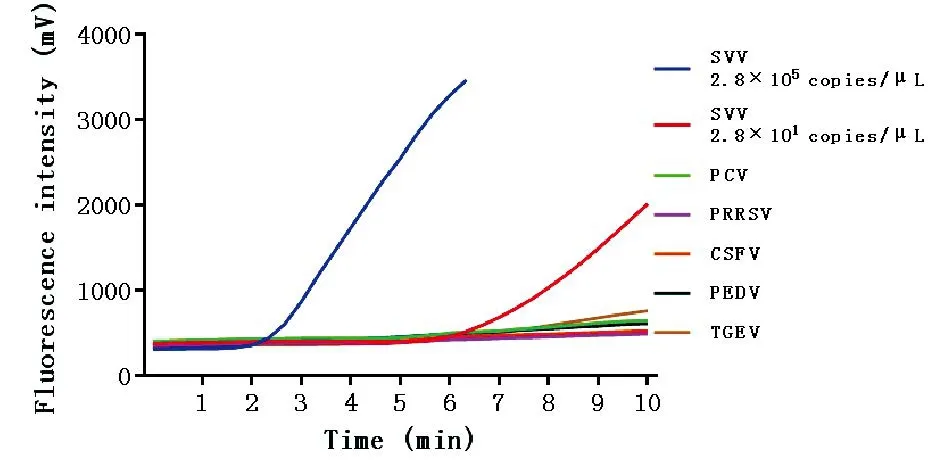
图4 SVV实时荧光RPA的特异性试验
2.4敏感性试验
为了确定实时荧光RPA方法的最小检出量,本研究分别选取不同稀释度标准品作为模板进行检测,以实时荧光RPA监测仪要求的荧光强度1 500 mV作为阳性检出限,并与荧光定量PCR方法进行敏感度比较。结果显示,RPA方法可在4 min内检测到浓度为2.8×106拷贝/μL的样品,对应的荧光定量PCRCt值为16.06±0.03,在10 min内,可检测最低浓度为2.8×101拷贝/μL的样品,对应的荧光定量PCRCt值为34.41±0.46(图5),说明实时荧光RPA敏感度与荧光定量PCR方法相当,但检测所需要的时间从荧光定量PCR的2 h缩短至10 min。
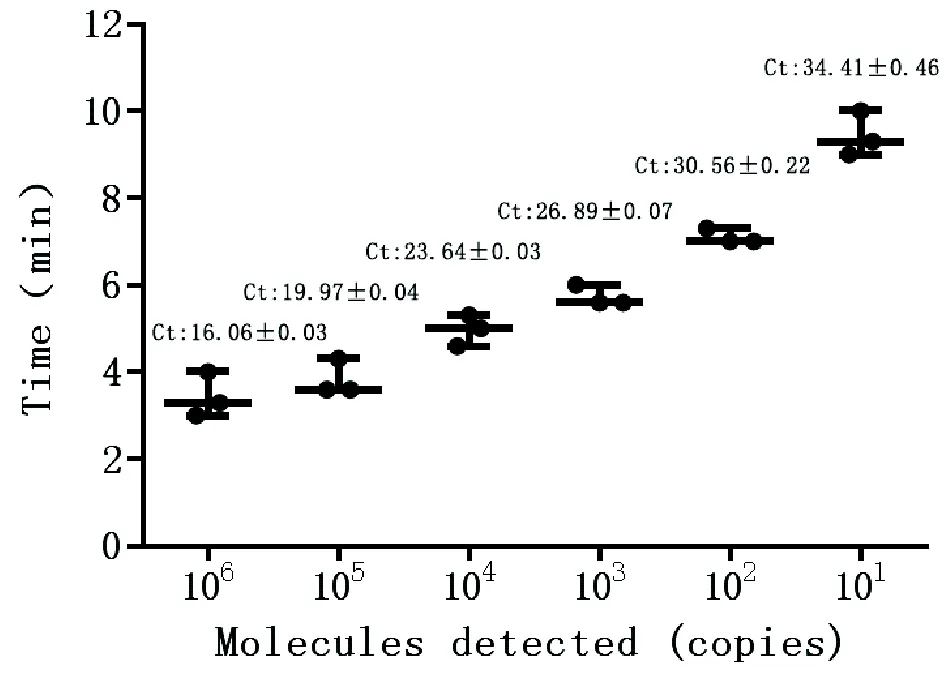
图5 SVV实时荧光RPA的敏感性试验
2.5重复性试验
为了评价本检测方法的重复性,采用了6个不同稀释梯度的pUC19-SVV质粒标准品作为模板,进行3次重复试验。结果如表2所示,反应10 min,各时间点荧光强度值组间变异系数范围在0.39%~39.78%,荧光强度达1 500 mV所需时间变异系数范围在2.44%~14.95%。样品浓度越高,检测所需时间越短,2.8×106拷贝/μL样品在4 min内,荧光强度值即可达到1 500 mV。

表2SVV实时荧光RPA的重复性试验
3 讨论
通常认为,猪水疱性疾病(Vesicular disease,VD)由口蹄疫病毒(FMDV,小RNA病毒科口疮病毒属)、水疱性口炎病毒(VSV,弹状病毒科水疱病毒属)、猪传染性水泡病毒(VESV,杯状病毒科水疱疹病毒属)、猪水疱病(SVD,小RNA病毒科肠病毒属)4种病毒引起。但近年来,美国、巴西、澳大利亚等国陆续发现了猪“水疱性”临床症状,而经检测,上述4种病毒均为阴性。随后,该病被确定为猪原发性疱疹病(Swine idiopathic vesicular disease,SIVD)[2]。SVV本身并不会给生产造成严重影响。但由于动物感染该病毒后,口部、鼻腔部以及蹄冠带等部位出现疱疹,需要进行快速、准确鉴别诊断,以排除动物感染FMD的可能。目前,针对SVV感染的诊断方法包括病毒中和试验、间接ELISA、竞争ELISA方法、PCR方法[10-11]。此外,本实验室成功建立了快速、敏感的TaqMan荧光定量PCR诊断方法,仅需2 h,即可通过核酸的特异性扩增,完成鉴别诊断[5]。
在RPA诊断方法研究中,Wang等[9]采用琼脂糖凝胶电泳方式,检测RPA扩增的犬细小病毒2型,在10 min可最低检测到10拷贝DNA分子;Abd El Wahed 等[7]采用实时荧光的方式,检测中东呼吸综合征冠状病毒,在10 min可最低检测到10拷贝RNA分子;Teoh等[12]建立的登革热实时荧光RPA方法耗时20 min,检出限为10个拷贝的RNA分子;Rohrman等[13]建立的侧流层析试纸条RPA方法检测HIV,在10 min可最低检测到1 000个拷贝数的DNA分子;Crannell等[8]开发的侧流层析试纸条RPA方法检测贾第鞭毛虫,在30 min可最低检测到10个拷贝数的DNA分子。本研究开发的SVV实时荧光RPA方法,在10 min内可检测28个拷贝数的DNA分子,敏感度与上述研究结果类似,在反应时间上,将荧光定量PCR耗时2 h缩短至10 min,在保证检测敏感度的同时提高了检测效率。
RPA方法开发近10年,除了其等温、快速扩增的优点外,引物设计复杂、生产成本较高给本方法的实际应用造成一定的困难。在引物设计方面,由于单链绑定蛋白需要寡核苷酸长度在30~35 bp以上才能将引物整合到双链DNA[14],因此RPA的上下游引物长于普通PCR及qPCR引物;此外,RPA探针长度约为46~52 个核苷酸,也长于qPCR的探针,加之目前无软件辅助,RPA引物探针设计难度高于普通PCR及qPCR。尽管如此,RPA商业开发公司,TwistDX公司在引物设计方面给出了相关建议:扩增产物长度在500 bp以内,以100~200 bp 为宜;5′端3~5个核苷酸应当避免出现多个G;在3′端应有GC;避免连续出现多个相同核苷酸;GC 含量占30%~70%;避免引物形成二聚体和二级结构[6]。在实际的实验中,按照上述建议设计了3组探针引物。结果发现,有2组可用于实验,其中组合3(148 bp)的扩增效果好于组合1(210 bp),也印证了“片段长度100~200 bp 为宜”的要求。在生产成本方面,以本研究应用的实时荧光RPA为例,单个样品的检测成本约50元人民币,高于实时荧光定量PCR(约20元/样)。但是,实时荧光RPA监控仪价格为45 000元左右,远低于实时荧光定量PCR仪(30万~50万),且该仪器体积小,便于携带,反应耗时短,更适于POC(床旁)及现场检测。例如,2014年几内亚暴发埃博拉疫情时,RPA技术被成功应用到移动实验室对埃博拉病毒的现场快速诊断中[15]。综上,本研究设计并成功筛选出一组引物探针,建立了实时荧光RPA方法,用于SVV核酸的检测。结果显示,反应在40 ℃ 10 min内,可最低检测到阳性标准品的浓度为28 拷贝/μL,且不与FMDV、CSFV、PRRSV、PEDV、TGEV等发生交叉反应。本方法特异、敏感、重复性良好,且使用方便、耗时短,可在猪群出现水疱性临床症状的早期做出快速诊断,便于及时采取有效措施,控制疫病的传播扩散。
[1] 樊晓旭,迟田英,赵永刚,等. 塞尼卡谷病毒病研究进展[J]. 中国预防兽医学报,2016,38(10):831-834.
[2] HAUSE B M,MYERS O,DUFF J,et al. Senecavirus A in pigs,United States,2015[J]. Emerg Infect Dis,2016,22(7):1323-1325.
[3] WU Q,ZHAO X,BAI Y,et al. The first identification and complete genome of Senecavirus A affecting pig with idiopathic vesicular disease in China[J]. Transbound Emerg Dis,2016.
[4] GIMENEZ-LIROLA L G,RADEMACHER C,LINHARES D,et al. Serological and molecular detection of Senecavirus A associated with an outbreak of swine idiopathic vesicular disease and neonatal mortality[J]. J Clin Microbiol,2016,54(8):2082-2089.
[5] 樊晓旭,赵永刚,迟田英,等. 塞尼卡谷病毒TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报,2016,38(12):959-962.
[6] 樊晓旭,赵永刚,李林,等. 重组酶聚合酶扩增技术在疾病快速检测中的研究进展[J]. 中国动物检疫,2016,33(8):72-77.
[7] WAHED A A E,PATEL P,HEIDENREICH D,et al. Reverse transcription recombinase polymerase amplification assay for the detection of middle East respiratory syndrome coronavirus[J]. PLoS Curr,2013,5.
[8] CRANNELL Z A,CABADA M M,CASTELLANOSGONZALEZ A,et al. Recombinase polymerase amplif i cationbased assay to diagnose Giardia in stool samples[J]. Am J Trop Med Hyg,2015,92(3):583-587.
[9] WANG J,LIU L,LI R,et al. Rapid and sensitive detection of canine parvovirus type 2 by recombinase polymerase amplification[J]. Arch Virol,2016,161(4):1015-1018.
[10] YANG M,VAN BRUGGEN R,XU W. Generation and diagnostic application of monoclonal antibodies against Seneca Valley virus[J]. J Vet Diagn Invest,2012,24(1):42-50.
[11] BRACHT A J,O´HEARN E S,FABIAN A W,et al. Real-time reverse transcription PCR assay for detection of senecavirus A in swine vesicular diagnostic specimens[J]. PLoS One,2016,11(1):e0146211.
[12] TEOH B T,SAM S S,TAN K K,et al. Early detection of dengue virus by use of reverse transcription-recombinase polymerase amplif i cation[J]. J Clin Microbiol,2015,53(3):830-837.
[13] ROHRMAN B A,RICHARDS K R R. A paper and plastic device for performing recombinase polymerase amplif i cation of HIV DNA[J]. Lab Chip,2012,12(17):3082-3088.
[14] PIEPENBURG O,WILLIAMS C H,STEMPLE D L,et al. DNA detection using recombination proteins[J]. PLoS Biol,2006,4(7):e204.
[15] OUMAR F,OUSMANE F,BARRÉ S,et al. Development and deployment of a rapid recombinase polymerase amplif i cation Ebola virus detection assay in Guinea in 2015[J]. Euro Surveill,2015,20(44):30053.
(责任编辑:朱迪国)
Establishment of a Real-time Fluorescent Recombinase Polymerase Amplif i cation(RPA)for the Detection of Seneca Valley Virus
Fan Xiaoxu1,Hadengchuriya1,2,Wang Yingli1,Wang Jiao3,Liu Chunju1,Chi Tianying1,Zhao Yonggang1,Zhang Zhicheng1,Wu Xiaodong1,Wang Zhiliang1
(1. National Research Center for Exotic Animal Disease,China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010018;3. Changzhou Animal Disease Prevention and Control Center,Changzhou,Jiangsu 213002)
Seneca valley virus(SVV)can affected swine,which can cause vesicular lesions similar to the infection of foot and mouth disease virus,with the neonatal mortality rate of 30%~70%. A real-time RPA method was established in this study,based on recombinase polymerase amplification technology (RPA). Assemblies of primers and probes targeting SVV 3D gene were developed and screened,while reaction conditions were optimized before sensitivity,specif i city and repeatability of the test were determined. The results showed that the lowest concentration of 28 copies/μL could be detected within 10 min at 40 ℃. No cross reaction was found between SVV and the foot and mouth disease virus,classical swine fever virus,porcine reproductive and respiratory syndrome virus,porcine epidemic diarrhea virus and transmissible gastroenteritis virus. In the 3 repeated tests of six series diluted samples(2.8×106~2.8×101copies/μL),the coeff i cient of variation of time when the fl uorescence intensity reached 1 500 mV was in the range of2.44%~14.95%. The isothermal and rapid amplif i cation method provides technical support for the differential diagnosis of vesicular disease among swine,and it is of great signif i cance to take appropriate preventive measures in a timely manner.
Seneca valley virus;real-time;f l uorescence;recombinase polymerase amplif i cation
S852.65
A
1005-944X(2017)08-0081-06
10.3969/j.issn.1005-944X.2017.08.022
国家重点研发计划(2016YFD0501104)
并列第一作者:樊晓旭、哈登楚日亚
王志亮

